Химияның негізгі ұғымдары: масса мен энергияның сақталуы, моль және тотығу-тотықсыздану


- Химиялық негізгі түсініктер. Масса мен энергияның сақталу заңы;
- Химиялық негізгі заңдылықтар
Бізді қоршаған орта - табиғат материядан тұрады. Біз материяның химиялық түрін зерттейміз.
Бұл теңдіктен материяның екі түрін байқадық, ол зат пен өріс және жүйенің пайда болғанын көрдік. Жүйенің фазалары, құрамды бөлшектері төртеу. Бір агрегатты күйде, сондықтан гомогенді жүйе.
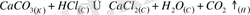
Екінші теңдікте гетерогенді жүйенің мысалы келтірілген, өйткені оның құрамы әр түрлі агрегатты күйде (Қ, С, Г) . Жүйенің құрамды бөлшегі бір-бірінен шекарамен бөлінеді және әр фазаның физикалық, химиялық қасиеттері ерекше болады.
Зат - бір немесе бірнеше денелер жиынтығы олар бір-бірімен әрекеттеседі, қоршаған ортадан ойша бөле аламыз. 1) массасы бар, 2) кеңістікте орын алады.
Өріс - химиялық заттар бір-бірімен әрекеттесетін және орналасатын материялық орта. Зат пен өріс бір-біріне айналады екен.
Моль -бұл 0, 012 кг көміртегі 12 С изотопында болатын атомдар санына тең құрылымдық бірліктер (молекулалар, атомдар, иондар, электрондар, ) болатын заттың мөлшері.
Cl 2 М = 72 г/моль
H 2 М = 2 H 2 SO 4, М =98
O 2 М =32 г/моль
CO 2 М = 44 г/моль
Көмітектің бір моліндегі атомдар санын есептейік: N=0. 012/1. 993*10 26 =6. 02*10 23 моль -1
N=N A
Қорытынды: Заттың 1 молін білу үшін оның молярлық массасын табу керек.
Структуралық бөлшек деген - атом, молекула, ион . Қалыпты жағдайда атомның 1 молінде Авогадро санына тең бөлшек болады, яғни 6, 02*10 23 моль -1 .
Атом- молекулалық ілім қағидасы:
- Заттар молекулалардан тұрады;
- Жай заттың молекулалары бір түрлі атомдардан тұрады;
- Күрделі заттардың молекулалары әр түрлі атомдардан тұрады;
- Атомдар, молекулалар үнемі Броун қозғалысында болады
5. Дальтон, Ломоносов қағидалары.
Заттар массасының сақталу заңы.
М. В. Ломоносов 1756 жылы жүргізілген зерттеулер бойынша химиялық түрленулер кезінде заттар массасының өзгермейтіндігін дәлелдеген. Бұл заңды заттар массасының сақталу заңы деп келесідей тұжырымдады:химиялық реакцияға қатысатын заттардың массасы реакция нәтижесінде түзілетін заттардың массасына тең болады.
∑m реагент = ∑ m өнім
Әр түрлі жүйелер қоршаған ортамен массасын және энергиясын алмастыра алады. Жүйелер бірнешеу болады:
1. Ашық жүйе-сыртқы ортамен масса және энергияны- алмастырады.
2. Жабық жүйе- сыртқы ортамен энергияны алмастырады.
2. Оқшауланған жүйе- сыртқы ортамен ешқандай алмасу болмайды. Мұндай жүйелерде масса қосындысы сопst, энергия қосындысы да сопst.
Эйнштейн - Ферми заңы.
Жүйеде энергияның өзгеруі массаларының өзгеруіне эквивалентті болады
∆Е =∆ mc 2
с-вакуумдағы жарық жылдамдығы
∆ m - массасының дефектісі
∆ Е - энергияның өзгеруі
Заттың құрам тұрақтылық заңы.
Оны 1801жылы Пруст ашқан. Ол былай тұжырымдалады:алыну әдісіне қарамастан кез-келген таза заттың сапалық және сандық құрамы әрқашанда түрақты болады. Химияның дамуына байланысты құрамы тұрақсыз заттар да табылған. Оларды бертоллидтер деп атайды.
Сонымен құрам тұрақтылық заңы әр химиялық қосылыстың сандық мөлшерін анықтайды.
Эквиваленттер заңы.
Эквивалент түсінігі химияға әртүрлі элеметтердің әрекеттесуші қабілетін салыстыру үшін енгізілген.
Біз екі ұғымды қолдандық: бірінші- эквивалент бірлігі моль, екінші m экв бірлігі г/моль. Химиялық эквивалент сутек атомының бір молімен әрекеттесетін немесе сутегінің осы мөлшерін химиялық қосылыстардан ығыстыратын заттың мөлшері. Заттың бір эквивалентінің массасын эквиваленттік масса (m экв ) деп атайды.
m э =А/В=1/1 =1 г/моль, (сутекке)
Химияның негізгі заңдарының бірі эквиваленттер заңы: химиялық элементтер бір-бірімен эквиваленттеріне сай нақты мөлшерде эрекеттеседі немесе олардың массаларының бір біріне қатынасы, эквиваленттерінің қатынасына тура пропорционал болады.
Қ+Қ Қ+С, Қ+Г Г+Г; С+С, С+Г
m 1 /m 2 =m »1 /m »2 m 1 /V 1 =m 2 /V »2 V 1 /V 2 =V »1 /V »2
Сутекпен оттектің эквивалент көлемдерін табу:
Н 2 О 2 16/2=8
2 г/моль - 22, 4 л 32 г/моль - 22, 4
1 - Х л 8 - Хл
V Э2 =11, 2 л Х=22, 4×8/32=5, 6
m ЭН2 =1 m ЭО2 =8 г/моль
V ЭН2 =11, 2 г V ЭО2 =5, 6 л
Күрделі заттардың эквиваленттік массаларын табуға арналған формулалар:
m Эоксид =М оксид /элемент×атом саны×элемент валент.
m Эқышқыл =М қышқыл /сутек атом санын
m Энегіз =М негіз /ОН тобының санына.
m Этұз =М тұз /N Ме ×Me вал
N Ме метал атомының саны, Me вал металдың қосылыстағы валенттілігі.
m ЭAl2(SO4) 3 =342/2*3=57 г/моль
Қалыпты жағдай Т=273 К, Р 0 1 атмосфера 101, 3 КПа мм л.
Авогадро заңы: бірдей жағдайда(температура, қысым) әртүрлі газдардың тең көлемдеріндегі молекула сандары бірдей болады.
Бірінші салдары:
Әртүрлі газдардың 1 молінің стандартты қалыпты жағдайда көлемі де бірдей болады.
V 1 моль =22, 4л,
Екінші салдары: кез-келген заттың бір моліндегі молекула саны бірдей болады, оны Авогадро саны деп атайды, ол 6, 02*10 23 молекула. Газ көлемі мен масса арасында қ. ж. мынадай байланыс бар.
m=n*М=(V/V M ) M.
Газдың молярлық массасын табу үшін оны сутек арқылы алынған екі еселенген тығыздығын қолданамыз.
m X =2d H2
d=Д, бір газдың екінші газға қарағандағы тығыздығы. Оны табу үшін екі газ салыстырылады. Осы екі газдың молярлық массасын салыстырамыз. Бірақ көлемдері бірдей болады.
d=Д=М 1 /М 2 m 1, m 2 - бірдей көлемдердің массасы
d=2V ауа /28 азот
Бұл сандардың практикалық қолданылуы бар.
d=Д= М 1 /М 2 M X =17d (NH3)
М Х =32d (O2) M X =71 (Cl 2 )
III салдары. Қ. ж. әр түрлі газдардың 1 молінде Авогадро санына тең бөлшек болады.
1 моль =N A =6, 02×10 23 моль -1
Егер газ жағдайы қ. ж. өзгеше болса онда барлық негізгі параметрлерді байланыстыратын Менделеев- Клапейрон теңдеуін қолданады.
1 Идеал газдың теңдігін аламыз
Р 0 V 0 /T 0 =PV/T (1)
идеал газ үшін Р 0 V 0 /T 0
эксперименттік газ үшін PV/T
Р 0 V 0 /T 0 =R(2) R=8, 31 Дж/моль×К=0, 082 л×атм/моль×К=62360 ммсб. мл/моль К
1 моль PV=RT (3)
Бірақ көп жағдайда мольдің саны 1-ге тең болмайды, сондықтан моль санын есептеу керек.
n=m/M, n NaOH =160/40=4 (4)
PV=nRT (5)
PV=m/M RT (6)
Бұл теңдікті қолданып газдың молярлық массасын табуға болады.
ТОТЫҒУ-ТОТЫҚСЫЗДАНУ РЕАКЦИЯЛАРЫ
Дәріс жоспары:
1. Тотығу дәрежесі.
2. Ең маңызды тотықтырғыштар мен тотысыздандырғыштар.
3. Тотығу және тотықсыздану процесстері.
4. Тотығу тотықсыздану реакциаларына теңдеулер құру.
Қосылыстағы элементтің тотығу дәрежесі (тотығудың дәрежесінде) сол элементтің атомынан басқа атомға ығыстырылған электрондарсанымен, басқа атомдардан берілген элементтің атомына (тотығудың теріс таңбалы дәрежесінде) ығысумен аныкталады. тотығу дәрежесін аныктау үшін келесі ережелерді еске алу керек:
1) элементтің тотығу дәрежесі жай заттарда 0-ге тең деп алынады;
2) молекуланың құрамына кіретін барлык атомдардың тотығу дәрежелерінің алгебралық қосындысы 0-ге тең;
3) қосылыстардың тотығу дәрежесі тұрақты болатын сілтілік металдар (+1), жерсілтілік металдар (+2), сутегі (+1 металдардың гидридтерінен басқа), оттегі (+2, пероксидтерден басқа) .
Мысалы, NH 3 , N 2 N 4 , NH 2 , N 2 O, NO, HNO 2 , NO 2 , HNO 3 қосылыстарында тотығу дәрежесі: -3, -2, -1, +1, +2, +3, +4, +5-ке тең болады.
Тотығу-тотықсыздану реакциялары - деп нәтижесінде әрекеттесуші заттар құрамына кіретін бір немесе бірнеше элементтердің тотығу дәрежесі өзгеретін реакциялар аталады.
Тотығу дегеніміз - тотығу дәрежесінің өсуімен жүретін атомның электрон беруі.
Тотықсыздану - тотығу дәрежесінің төмендеуімен жүретін атомның электронды қосып алуы. электрон қосып алушы элемент тотықтырғыш деп аталады. Электрон беретін элемент тотықсыздандырғыш деп аталады.
мысалы:
4AI+3O 2 =2AI 2 O 3
Реакциядағы алюминийдің тотығудәрежесі0-ден -3-ке дейін көтеріледі, тотықсыздандырғыш қызметін атқарады; реакция нәтижесінде алюминидің тотықсыздандырғыш формасы тотығады. Бұл реакцияда оттегі дәрежесі 0-ден (-2) ге дейін төмендейді де, тотықтырғыш болып табылады, ол реакция нәтижесінде тотықсызданады.
Тотықтырғыштар және тотықсыздандырғыштар
Тотығуы ең жоғары дәрежесінде элементтер тек қана тотықсыздана алады. Себебі, олардың атомдары электрон қабылдауға ғана жарайды. Мысалы, S +6 , N +5 , Mn +7 , Cr +6 және т. б.
Тотығудың ең төменгі дәрежесіндегі элементтер тек қана тотыға алады. Себебі, олардың атомдары электрон беруге ғана ыңғайлы. Мысалы, S -2, N -3 , I -1 және т. б.
Тотығудың аралық дәрежесіндегі элементтер 2 жақты: тотыға да, тотықсыздана алады. Мұндай жағдай реакцияға түсетін элементтерге және реакция жүргізу жағдайына байланысты электронды қабылдай да, бере де алады.
Ең маңызды тотықтырғыштар
1. Элементар ең маңызды тотықтрғыштар бейметалдар (F2, CL2, BR2, I2, O2) тотықтырғыш роліндегі галогендер -1 тотығу, оттегі-2-ге ие болады.
2. Құрамында оттегі болатын қышқылдар мен тұздар арасында біршама маңызды тотықтырғыштар KМnO 4 , K 2 CrO 4 , K 2 Cr 2 O 7 , концентрацияланған күкірт қышқылы, азот қышқылы және нитраттар, галогендердің оттекті қышқылдары. Mn +7 тотықтырғыш ретінде ортаның қышқылдығына байланысты алуан түрлі өнімдерге дейін тотықсыздана алады: қышқыл ортада - Mn 2+ ке дейін, бейтарапта MnO 2 -ге дейін сілтілікте MnO 4 -2 -ке дейін
5K 2 SO 3 +2KMnO 4 +3H 2 SO 4 =6K 2 SO 4 +2MnSO 4 +3H 2 O,
3K 2 SO 3 +2KMnO 4 +H 2 O =3K 2 SO 4 +2MnO 2 +2KOH,
K 2 SO 3 +2KMnO 4 +2KOН=К 2 SO 4 +2K 2 MnO 4 +H 2 O
Калий хроматы және дихроматы құрамында Cr +6 ионы болуы арқасында тотықтырғыш ролін атқарады, ол Cr +3 ионына дейін қайта тотықсызданады
K 2 Cr 2 O 7 3H 2 S+4H 2 SO 4 =Cr 2 (SO 4 ) 3 +3S+K 2 SO 4 +7H 2 O.
Концентрленген күкірт қышқылының H 2 S+6O4 дәрежесі арқасында тотықтырғыш қасиет көрсетеді, ол тотықсызданып +4 (SO 2 ), 0 ( күкірт), немесе -2 (H 2 S) дейін тотықсыздана алады (тотықсыздандырғыш күйі күшті болса, күкірттің тотықсыздануы терең жүреді)
Cu+2H 2 SO 4 =CuSO 4 +SO 2 +2H 2 O,
3Mg+4H 2 SO 4 =3MgSO 4 +S+4H 2 O,
4Zn+5H 2 SO 4 =4ZnSO 4 +H 2 S+4H 2 O
Азот қышқылы НNO 3 құрамындағы азоттың “+5” тотығу дәрежесіне сәйкес тек тотықтырғыш қасиет көрсетеді. Тотықтырғыш қасиет оның концентрациясының өсуімен күшейе түседі
қышқыл концентрациясы
←
NO 2, NO , N 2 O , N 2, NH 4 +
→
тотықсыздану қасиеті
Галогендердің оттекті қышқылдары (HOCI, HCIO 3 , HBrO 3 және т. б. ) және олардың тұздары әдетте галоген қышқылдарының -1 (хлор және бром жағдайында) немесе 0 (йод болса) дәрежесіне дейін тотықсызданады.
KCIO 3 +6FeSO 4 +3H 2 SO 4 =KCI+3Fe 2 (SO 4 ) 3 +3H 2 O,
HIO 3 +5HI=I 2 +3H 2 O,
KBrO+MnCI 2 +2KOH=KBr+MnO 2 +2KCI+H 2 O
3. Сутегі +1 тотығу дәрежесінде тотықтырғыш көбінесе қышқылдар қосылыстарында (ережеге сай кернеу қатарында сутекке дейін тұрған металдармен қарым қатынасына)
Mg+H 2 SO 4(сұйытылған) =MgSO 4 +H 2 0 ↑
4. Тотығудың жоғары дәрежесіндегі металдар иондары (Fe 3+ , Cu 2+ және т. б. ) біршама төмен дәрежесінде ионға айналады.
2FeCI 3 +H 2 S=2FeCI 2 +S+2HCI.
Ең маңызды тотықсыздандырғыштар
1. Элементтер заттар арасында тотықсыздарғыштарға (активті) металдар (сілтілік, жер сілтілік, цинк, алюминий, темір және т. б. ), сондай-ақ, кейбір бейметалдар (сутегі, көміртегі, фосфор, кремний) жатады. Мұнымен қатар металдар қышқылдық ортада оң мәнді зарядталған иондарға дейін, сілтілік ортада гидроксидтерге дейін тотығады. Көміртегі CO және CO 2 -ге дейін тотығады.
2. Оттексіз қышқылдарда (HCI, HBr, HI, H 2 S) және олардың тұздарында болып әдетті элементар заттарға дейін тотықсызданатын қасиеттері CI-дан F-қа дейін күшейеді.
3. Тотығудың ең төменгі дәрежесіндегі металдар (Sn 2+ Fe 2+ Cu +2 иондары және т. б. ) тотыға отырып, өздерінің дәрежесін көтереді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz