Ерітінділер теориясы және молекулалық құрылымның кванттық-химиялық негіздері


Ерітінділер теориясы пәніне кіріспе
Ерітінділер туралы ұғым.
Екі немесе одан да көп заттардың біркелкі араласу нәтижесінде түзілген өн бойында қасиеті бірдей жүйелер ерітінділер деп аталады.
Заттардың агрегаттық күйлеріне байланысты ерітінділер былай бөлінеді:
Газ күйіндегі ерітінділер қатарына газдар қоспасы - ауа, тұман, мұнай бетіндегі газ күйіндегі көмірсутектер қоспасын жатқызуға болады.
Сұйық ерітінділер - сұйық бойында еріген қатты, сұйық, газ заттары, теңіз, мұхит сулары, бензин, керосин, бояулар және т. б. дүниеліктер.
Қатты ерітінділер түрі - құймалар (болат, шойын) түрлі минералдар.
Табиғатта таза зат өте сирек кездеседі, көбісі қоспа, ерітінді түрінде ұшырасады.
Жан - жануарлар, өсімдік дүниеліктерінде орын алатын биохимиялық, физикалық және химиялық құбылыстар сұйық ерітінді түрінде өтеді.
Сұйық ерітінділер - еріткіш бір немесе бірнеше затты еріту арқылы алынатын болғандықтан, бұлардың түзілу табиғатын талдау барысында екі түрлі көзқарас бар - физикалық және химиялық.
Ерітінділердің физикалық теориясы.
ХІХғ - ң соңында ерітінді физикалық түзіліс, онда еріткіш пен еріген зат арасында ешбір әрекеттесу жоқ деп есептелді. Ерітіндінің түзілуін еріткіштің енжар ортасында еріген зат бөлшектерінің таралуымен түсіндірген. Кейін келе бұл теория тек идеалды ерітіндінің тәртібін ғана сипаттайтыны белгілі болады (мысалы, көптеген газ ерітінділері), онда еріген зат бөлшектерімен еріткіш бөлшектері өзара ешбір әрекеттеспейді. Бұл теорияны Я. Вант - Гофф, С. Аррениус, Оствальд т. б. ғалымдар жақтады.
Ерітінділердің химиялық теориясы.
Д. И. Менделеев ерітінділерді зерттеуге 40жылдай ғылыми жұмысын арнаған оның ерітінділердің химиялық теориясы 1887ж жасалды және экспериментпен бекітілді.
Бұл теорияның негізгі шарты:
- Еру - ол, физика - химиялық күрделі процесс, оған энергияны жұмсауды талап ететін (∆H>0), бөлінуімен (∆H2<0) байланысқан, еріген заттың молекуласы мен еріткіш молекуласының әрекеттесуі енеді.
- Еру процесі экзотермиялық (мысалы, суда NaOH H2SO4ерігенде), эндотермиялық (мысалы, суда NH4NO3ерігенде) болуы мүмкін. Зат ерігенде бөлінетін жылуды еру жылуы деп атайды.
- Еріткіш пен еріген заттың химиялық әрекеттесуі нәтижесінде сольваттар немесе гидраттар (егер су еріткіш болса) түзіледі. Құрамында су молекуласы болатын кристалды заттарды криссталлогидраттар деп атайды.
Ал, кристаллогидрат құрамына енетін суды кристалдық су дейді. Табиғи минералдардың көпшілігі кристаллогидратқа жатады:
Na 2 SO 4 ∙10H 2 O - глаубер тұзы
KAl (SO 4 ) 2 ∙10H 2 O - алюминий ашутасы.
Сольваттар (гидраттар) донорлы - акцепторлық, ион - дипольдік әрекеттесу есебінен, сутектік байланыс, сол сияқты дисперсиялық әрекеттесу (мыс, бензол мен толуол ерігенде) есебінен түзіледі.
CuSO 4 - сусыз тұзы ақ түсті.
CuSO 4 ∙5H 2 O - көк түсті, оның спирттегі ерітіндісі (сольват) қоңыр түсті. Ерітінділердің химиялық теориясы затты еріткенде пайда болатын жылу эффектісін түсіндіруге мүмкіндік береді. Еру процесінің жылу эффектісін (∆H еру ), заттың кристалдық торын бұзу үшін қажетті (∆H тор ) және сольваттау процесінде бөлінетін (∆H сольв ) жылу қосындысы түрінде беруге болады:
∆H еру = ∆H тор + ∆H сольв
Егер ∆H тор > ∆H сольв болса, онда еру процесі эндотермиялы, егер ∆H тор < ∆H сольв болса, онда еру процесі экзотермиялы.
Құрамдастардың арасында химиялық әрекеттесудің болуы еріген кездегі көлемдік эффектіні де түсіндіреді. Айталық, 1л этанолды 1л суды еріткенде 2л ерітінді емес, керісінше 1, 93л алынады. Мұндай жағдайдағы көлемнің кішіреюі су мен спирттің гидроксиді топтарының арасында сутектік байланыстардың түзілуімен түсіндіріледі.
Д. И. Менделеевтің ерітіндінің химиялық теориясы негізінде физика - химиялық талдау, кешенді қосылыстар химиясы, сусыз ерітінділердің электрохимиясы сияқты жаңа ғылыми бағыттар пайда болады. Бұл теорияға үлес қосқан ғалымдар: Д. П. Коновалов, И. А. Каблуков, Н. С. Курнаков, В. А. Кистяковский т. б.
Ерітінділердің концентрациясы.
Ерітіндінің концентрациясы дейтініміз - ерітіндінің белгілі бір салмақ мөлшерінде, не белгілі бір көлемінде еріген заттың мөлшері. Ерітінділердің концентрациясын, яғни ерітінділердің құрамын кескіндеудің бірнеше әдісі бар:
1. Массалық процент пен өлшенетін (проценттік) ерітінділер, яғни ерітіндінің 100 масса бөлігінде еріген заттың массасы. Мысалы, қанттың 12 проценттік ерітіндісі десек, ол ерітіндінің 100 грамында 12г қант, 88г су бар. Еріген заттың массалық үлесі ω(омега) - ол еріген зат массасының ерітіндінің жалпы массасына қатынасын көрсететін өлшемсіз шама. Өлшем бірлігі үлес, %.
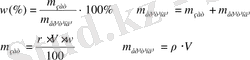
Еріген заттың массалық үлесін ерітіндінің пайыздық (проценттік) концентрациясы деп атайды.
2. Мольдікпен өлшенетін (мольдік) ерітінділер. Ерітіндінің метрінде бір моль зат еріген ерітіндіні мольдік ерітінді дейді, сондықтан ерітіндінің бір литрінде мольдің қаншасы ерігендігін көрсететін сан сол ерітіндінің мольдік концентрациясын көрсетеді: оны М әрпімен белгілейді.
С м немесе еріген зат мөлшерінің 1л ерітіндіге қатынасын көрсетеді. Өлшем бірлігі моль/л;
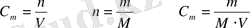
1М - бір молярлық ерітінді (1л - де еріген заттардың 1мольі болады) .
0, 5М - жарты молярлық ерітінді.
0, 1М - децимолярлылық ерітінді.
0, 01М - сантимолярлық ерітінді.
0, 001М - миллимолярлық ерітінді.
Мысалы, 3М делінсе, 1л ерітіндіде 3моль, ал 0, 2М делінсе 0, 2моль зат ерігені. Мольдік концентрациялары бірдей ерітінділер эквимольді (эквимолярлық немесе эквимолекулалық) деп атайды.
3. Нормальдықпен өлшенетін (нормальдық) ерітінділер. Ерітіндінің 1 литріндебір моль - эквивалент зат ерісе ерітіндіні нормаль ерітінді дейді; сондықтан ерітіндінің бір литрінде моль - эквиваленттің (заттың эквивалентіне тең етіп алынған грамм саны) қаншасы ерігенін көрсететін сан, сол ерітіндінің нормальдық концентрациясын көрсетеді. Оны С н немесе Н әрпімен белгілейді. Өлшем бірлігі моль/л:

Мысалы, ерітіндінің 1 литрінде 3моль эквивалент ерітілсе, оны 3 нормальдық (3н), ал 0, 5моль эквивалент ерітілсе, оны жарты нормальдық (0, 5н) ерітінді дейді.
- Титр - еріген зат массасының ерітінді көлеміне қатынасын көрсетеді. Өлшем бірлігі г/мл:

мұндағы: m - еріген заттың массасы (г) ;
V - ерітінді көлемі (мл) ;
Э - эквиваленттің молярлық массасы;
С н - эквиваленттік концентрациясы.
Титрі белгілі ерітіндіні (титрленген ерітіндіні) дайындай үшін, қажетті көлемге есептелінген заттың дәл өлшендісін алып, дистилденген суда толық ерітіп, оны керекті көлемге жеткізеді.
- Моляльдықпен өлшенетін ерітінділер.
Еріткіштің 1000 грамында еріген заттың бір молі болса, ондай ерітіндіні моляльдық ерітінді деп атайды. Еріткіште еріген заттың мөлшеріне сай ерітінді 0, 1 0, 05 2, 0 т. б. моляльды бола алады. Мәселен, қанттың С 12 Н 22 О 11 судағы децимоляльды ерітіндісі 34, 2г қанттан және 1000г немесе 1 литр судан тұрады.
Лекция №1
Ерітінді түзілген кезде жылу бөлініп немесе жылу сіңірілуі химиялық құбылысқа жатады. Химиялық құбылыс кезінде ерітінді түзетін заттардың қасиеттері (кенет) бірден өзгереді. Мысалы, химиялық реакция нәтижесінде заттардың түсі кенет секірмелі түрде өзгереді, бірте - бірте өтеді.
Химиялық процесс өткенде заттардың тығыздығы, жылу сиымдылықтары, оптикалық, термиялық т. б. қасиеттері кенет өзгереді.
Физикалық процесте ерітіндінің көлемі оны түзетін заттардың алғшқы көлемдерінің қосындысына тең, демек көлем аддитивті болады. Аддитивті қасиет ерітінді құрамына пропорционал болады:
у = у в С А + у в С в
мұндағы
у - А және В компаненттерінен тұратын ерітіндінің аддитивті қасиеті;
у А - А заттың таза күйіндегі қасиеті;
С А - А заттың ерітндідегі концентрациясы;
у в - В заттың таза күйіндегі қасиеті;
С в - В заттың ерітіндідегі концентрациясы.
Кейде ерітінді қасиетінің өзі емес, оның қандай у А бір функциясы жоғарыдағы аддитивтік теңдеуге бағынады.
Мысалы,
lgу = С А lg у А + С В lg у В.
Сөйтіп, ерітіндінің түзілуі физикалық болса, оның қасиеттері аддитивті қаситтерге жатады. Ал, ерітінді химиялық процестердің нәтижесінде түзілсе, оның қасиеті аддитивті заңдылықтан ауытқиды.
Көп атомды молекулалардың қасиеттері.
Үш немесе одан көп ядролар мен оларға сәйкес электрондардан тұратын тұрақты жүйе көп атомды молекулаларға жатады. Үш атомды сызықты молекула ең қарапайым болғанымен оны сипаттау үшін екі тәуелсіз табиғи координаттар керек. Олар к 1 (А-В) және r 2 (В-С) және де АВС бұрышы 180 0 - қа тең болу керек. Молекуланың потенциалды энергиясы осы екі координаталардың функциясы болып Е = f (r 1 r 2 ) кеңістікте жазықтық түрінде кескінделеді. Молекуланың потенциялды энергиясы өз орнындағы ядролар төңірегіндегі электрондар энергиясы мен ядролардың тебісу энергияларынан тұрады. Минимумда ол бір ғана мәнеге ие болуға тиіс Е(r e ) = E E - электрондық деңгей. Минимумы бар потенциялдық жазықтық үш атомды молекуланың тепе - теңдік конфигурациясын анықтайды. Мұндайда молекуланың параметрлері мынадай болады.
r e (A - В), r e (В-С), Е(r e ) = E АВС.
Сызықты емесе үш атомды және одан күрделі басқа молекулалардың тепе - теңдік конфигурациясы көп өлшемді кеңістіктегі потенциялды энергияның минимумымен анықталады. Мысалы, НСО молекуласы үшін керекті параметрлер: тепе - теңдік радиустар r e (Н-С), r t (С-О) және бұрыш < НСО немесе r e (Н-С), r e (С-О) және r e (Н . . . О) . Сонымен, көп таомды молекула деп, ядролар мен электрондардан тұратын тұрақты динамикалық жүйені айтамыз. Бұл жүйенің тепе - теңдік конфигурациясы оның потенциалдық энергия жазықтығының минимумындағы координаттарымен анықталады. Минимумның тереңдігі молекуланың диссоциациялану энергиясын D e белгілейді. Көп атомды молекулалар әр түрлі электрондық күйлерде болады. Онда күй өзінің потенциялдық жазықтығы мен тепе - теңдік параметрлері арқылы сипатталады. Егер потенциалды энергияның жазықтығында екі не одан көп минимумдар болса, молекула екі изомерлі деуге болады. Әр изомер тепе - теңдік конфигурацияның параметрлерімен сипатталынады. Потенциалды жазықтықта минимум болмаса жүйенің электрондық күйі тұрақсыз дейді. Электрон күйлерінің ең төмен энергиялы күйі негізгі, ал қалғандары қозған күйлер болып табылады. Молекуланың электрондық термдерін талдағанда салыстырудың ыңғайына қарай негізгі күйді нольдік санақ ретінде алады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz