Белгіленген атомдар әдісі: тұрақты және радиоактивті изотоптар, ядро құрылысы мен ыдырау заңдары


Кіріспе
«Белгіленген» атомдар әдісі. Стабильді изотоптар және радиоактивті индикаторлар.
«Белгіленген» атомдар жиынтығы деп химиялық қосылысқа кіретін атомдардан өзгеше атомдарды айтады. Осы белгіленген атомдарды қолданып, әр түрлі процестерді зерттеуге болады. Белгіленген атомдар химияда, физикада және биологияда қолданылады. Сонымен қатар техникада және технологияларда, ауыл шаруашылығында және медицинада қолданылады. Белгіленген атомдарды енгізудің негізгі себебі - ол изотоптар болады.
Изотоптар дегеніміз - зарядтары бірдей химиялық элементтер. Ядроны мынадай символмен белгілейді:

мұндағы, Х - химиялық элементтердің символы,
А - ядроның массалық саны
Z - ядроның заряды.
Бір элементтің изотоптары ядро құрамымен ерекшеленеді және олардың электрондық қабаттары бірдей болады. Оларды бір-бірінен айыру үшін белгіленген атомдар әдісімен айқындайды.
Изотоптарды стабильді және стабильді емес деп екіге бөледі. Радиоактивтілік дегеніміз атомдық ядролардың өздігінен түрленуін айтады. Ол түрлену кезінде атомның физикалық және химиялық қасиеттері өзгереді. Изотоп стабильді немесе орнықты болады, егер белгілі әдістер арқылы оның радиоактивтілігі байқалмайтын болса.
Табиғаттағы көптеген элементтер изотоптардың қоспасынан тұрады. Олардың бір-бірінен айырмашылығы өте аз. Химиялық жолмен ол изотоптарды жеке бөліп алу мүмкін. Стабильді изотоптар ретінде жеңіл элементтердің изотоптары қолданылады. Мысалы, дейтерий (
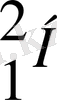 ), көміртегі - 13, азот - 15, оттегі - 18 және т. б.
), көміртегі - 13, азот - 15, оттегі - 18 және т. б.
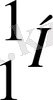 ,
,
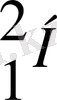 ,
,
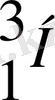
 -сутегі
-сутегі
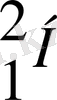 -дейтерий атомының ядросы
-дейтерий атомының ядросы
 -тритий атомының ядросы
-тритий атомының ядросы
Изотоп құрамын сандық анықтау масс-спектрометр арқылы жүзеге асырылады. Сонымен қатар изотоптық құрамды атомдардың тығыздығы, жылу өткізгіштігі, сыну көрсеткіштігі арқылы да анықтайды; соңғы кезде инфрақызыл және жоғары жиілікті спектр арқылы және сонымен қатар ядролық магниттік резонанс арқылы қолданады.
Стабильді изотоптардың көмегімен белгіленген атомдардың әдісі стабильді изотоптар әдісі деп аталады. Стабильді изотоптардың ерекшелігі олардың орнықтылығында және оларда ядролық сәулеленулер жоқ болады. Бірақ ондай стабильді изотоптары бар элементтер өте аз. Осы әдіспен істелінетін өте күрделі техника және олардың өте төмен сезімділігі осы әдістің кемшілігі болып табылады.
Радиоактивті изотоптарды қолданатын белгіленген атомдар әдісі радиоактивті индикаторлар әдісі деп аталады.
Радиоактивті изотоптарды периодтық жүйедегі барлық элементтерден алуға болады. Радиоактивті изотоптар әдісінің артықшылығы жоғары сезімділігі, ерекшелігі, өте үлкен дәлдікпен анықталуы, сонымен қатар қарапайымдылығы және өлшеуіш аппаратурасының орындалуы. Сондықтан радиоактивті индикаторлар әдісі кеңінен таралады.
Қазіргі уақытта 250 стабильді және 1100 аса радиоактивті изотоптар саналды. Барлық химиялық элементтердің радиоактивті изотоптары белгілі, соның ішіндегі көптеген элементтер үшін алынған изотоптары радиоактивті индикаторлар ретінде қолданылады. Изотоптары радиоактивті химиялық элементтерді радиоактивті элементтер деп атайды. Ондай элемент ретінде Менделеевтің периодты жүйесіндегі полонийдан (Z=84) бастап элементтер кіреді. Бірақ, практикада таза радиоактивті элементтермен немесе изотоптармен жұмыс істеу өте сирек кездеседі. Белгіленген атомдар әдісінде радиоактивті заттар қолданылады, ол заттардың құрамында радиоактивті атомдар бар. Радиоактивті заттар ұғымына радиоактивті элементтер немесе радиоактивті изотоптардың еркін күйлері немесе қосылыстары кіреді.
Радиоактивті индикаторлар әдісінің өте жоғары сезімталдығы басқа тәсілдерге қарағанда үлкен дәлдікпен тәжірибелер жасайды. Мысалы, өлшенетін радиоактивті изотоптардың мөлшері 10 -10 -10 -15 г болады, бірақ кейбір жағдайда жеке радиоактивті атомдар да абйқалуы мүмкін.
Белгіленген атомдар әдісінің 3 негізгі бағыттары бар.
1. Белгіленген атомдарды әр түрлі объектілерде заттардың орын ауыстыруын зерттеу болып табылады. Белгіленген заттарды берілген жүйеге немесе организмге енгізеді және белгілі бір уақыт аралығында жүйенің белгілі бір нүктелеріндегі белгіленген қосылыстарды табу болып табылады. Мысалы, металдарда белгіленген атомдардың орын ауыстыруы арқылы диффузияның немесе өздік диффузияның коэффициенттерін анықтауға болады.
2. Белгіленген атомдар әдісін әр түрлі процестермен түрленулердің механизмін анықтауға қолданылады, заттардың химиялық құрылысын зерттеу, атомдардың және топтардың қозғалғыштығын анықтауға болады. Мысалы белгіленген атомдар арқылы фотосинтез процессінің негізгі проблемалары шешілді.
3. Белгіленген атомдар әдісі заттың мөлшерін анықтауда қолданылады. Радиоактивті индикаторлар қолдану арқылы заттың сандық мөлшерін анықтауда басқа жаңа әдістер ашылды. Оларға мыналар жатады: изотоптық аралыстыру әдісі активациялық анализ, радиометриялық титрометрия және т. б. Осы әдістердің жоғары сезімталдығы мен дәлдігі өте тез және дәл автоматикалық регистрациялар жатады, олар көпшілік анализдерде өте маңызды.
Радиоактивті индикаторлар әдісін қолданған кезде зерттеушінің алдынан көптеген проблемалар шығады. Біріншіден, радиоактивті изотопты таңдап алу, оның ядролық сипаттамаларын анықтау, яғни ол радиоактивті изотоптық ыдырау схемасын анықтау одан шығатын сәулеленудің энергиясын анықтау және радиоактивті изотоптық жартылай ыдырау периодын анықтау.
Өлшеуіш аппаратурасын рационал қозғалу үшін ионизациялық сәулелердің өлшенетін принциптерімен танысу қажет. Сонымен қатар радиоактивті заттың мөлшері өте аз болғандықтан және олардың сұйықтарда өте аз мөлшерде ерігендіктен, олардың ерекшеліктерін білу қажет.
Радиоактивті сәулелердің организмге әсері болғандықтан, сәулелерді заттармен әсерлесу процестерін білу қажет.
Сондықтан менің дипломдық жұмысымда қысқаша түрде радиоактивтіліктің теориялық мәліметтері келтірілген және сонымен қатар атомдық ядролардың құрылысы, радиоактивті сәулелердің өлшеу әдістері және дозометрия орын алады.
І тарау. Радиоактивтілік
1. 1. «Белгіленген» атомдар әдісі дамуының тарихи бөлімдері
1896 жылы Беккерельдің урандық сәулеленуді ашуы қазіргі таңдағы атомдық энергия мен радиоактивтілікті изотоптарды іс жүзінде қолданумен аяқталған ғылым дамуының жаңа бөліміне қызмет етті.
М. Кюри уранның және басқа элементтердің сәулеленуі атомдардың айналуымен байланысты екенін бірінші болып көрсетті және бұл құбылысты радиоактивтілік деп атады. Табиғи элементтердің радиоактивтілігі мен олардың бірігуін үйрену нәтижесінде Болтвуд уранның препаратынан химиялық қасиеті бойынша торийге ұқсас қатты радиоактивті ионийді белгілеп алды. Соддидің ұсынысы бойынша, бірдей химиялық, бірақ әр түрлі радиоактивті қасиетке ие бір химиялық элемент атомының әр түрлі болуын изотоптар деп атады. Изотоптардың болу себебін түсіндіру тек атомдардың құрылысын анықтағаннан кейін ғана мүмкін болды.
1913 жылы Хевеши Резерфордтың ұсынысы бойынша, D-радий деп аталатын радиоактивті изотопты кәдімгі қорғасыннан ажыратуға әрекет етуге қамданды. Екі жыл жұмыс жасап, Хевеши іс жүзінде изотоптарды бөлудің мүмкін еместігіне көз жеткізді. Алайда, онда орнықты изотоптар қасиетінен анықтауға мүмкіндік беретін индикаторлар ретінде радиоактивті изотоптарды қолдану идеясы туды. Мұны Хевеши келесі түрде талқылады: «ерітінді 1 грамм қорғасыннан тұратындай етіп, қорғасын нитраты мөлшерін ерітейік. Мұнда активтілік миллион бірлікке (электроскоппен өлшенетін) тең болатындай етіп, өте аз мөлшерде D-радий қосамыз және бұл «белгіленген» қорғасынмен өте қиын операцияны орындаймыз. Егер біз бұл операциялардың нәтижесінде алынған фракциядан бірдей радиоактивтіліктің болуын байқасақ, онда фракцияда бастапқы қорғасынның бір мың миллиграммы қатысты деген қорытынды жасауымыз керек». Біраз уақыттан кейін бұл әдісті Вл. И. Саицын қиын ерітілетін торий және «белгіленген» торий изотоптарының 234 (уран - Х 1 ) және 228 (радиоторий) массаларымен ерітіндісін анықтау үшін қамданды.
Торийдің меншікті α радиоактивтілігі болмашы ғана, сондықтан анықтау сезімталдығы өте төмен. Радиоактивтілік бойынша торийдің қиын ерітілетін аз мөлшерін анықтау үшін, қатты радиоактивті торий изотопын жеткілікті түрде ұзақ сақталған уранның немесе торийдің табиғи бірігуінен алдын-ала бөліп алуға болады. 1г уранмен тепе-теңдікте 234 массалы 1, 4·10 -11 г торий изотопы болып табылады. Іс жүзіндегі мұндай салмақсыз мөлшерді радиоактивтілік бойынша кәдімгі торийдің салмақты мөлшерімен араластырған жағдайда да оңай анықтауға болады.
Торий оксалатының ерітіндісі 0, 5·10 -5 моль/л-ге тең екендігі анықталды. Дәл сол уақыттағы торийдің біріккен ерітіндісін анықтаудың танымал тәсілдерінің ешқайсысын радиоактивті изотоптарды қолданумен алынған дәлдіктей етіп жасау мүмкін болмады.
1921 жылы Кеңес Одағында В. Г. Хлопиннің үздіксіз қатысуымен және басқаруымен радиоактивтілік бойынша табиғи радиоактивті изотоптарды қолдану арқылы жұмыстың дамуын қамтамасыз ететін алғашқы радий препараты дайындалды.
И. Е. Старик қорғасын изотопын радиоактивті индикаторлар ретінде, тау жыныстарындағы олардың жасын орнату арқылы қорғасынның аз мөлшерін радиометрлік анықтау үшін қолданды.
Алайда радиоактивті индикаторлар әдісі изотоптарды таңдау мүмкіндігінің шектелуінен және сәйкес табиғи радиоактивті изотоптардың көзінің болмауынан кең таралуға ие болмады. Бұл кедергі ерлі-зайыпты И. және Ф. Жолио-Кюридің жасанды радиоактивтілікті ашуының, циклотронда ядролық реакция бойынша көптеген радиоактивті изотоптарды алуды жүзеге асырудың және ауыр ядролардың бөлінуін ашудың арқасында жойылды.
Кеңес Одағында радиоактивті изотоптарды қолдану мен алу бойынша жұмыстар дамыды және оны академик И. В. Курчатов мүмкін болғанша қолдады.
Радиоактивті изотоптарды «белгіленген» атомдар ретінде бірінші болып А. Е. Полесицкий, А. А. Гринберг, С. З. Рогинский және т. б. қолдана бастады.
Ядролық энергетиканың ерекше прогрессі нәтижесінде периодтық жүйедегі барлық элементтер үшін радиоактивті изотоптарды іс жүзінде алу мүмкіндігі пайда болды. Бұл «белгіленген» атомдардың әмбебап әдісін қамтамасыз етті. Радиоактивті изотоптар мен сәулеленуді кең қолданатын білімнің жаңа бұтақтары пайда болды. Оларға радиохимия, радиобиология, радиогеология, радиациялық химия және т. б. жатады. Қазіргі уақытта радиоактивті индикаторлар әдісін іс жүзінде қолданбайтын облыстарды есептеу қиын, ол тіпті металлургия мен машина құрастыруда, агрономия мен зоотехникада, балық шаруашылығы мен тоқыма өнеркәсібінде да қолданылады.
«Белгіленген» атомдар әдісімен орындалған зерттеулер жыл сайын халық шаруашылығыда үлкен экономикалық пайда әкеледі. Шын мәнісінде, «белгіленген» атомдардың роліне білімнің кез-келген бөліміндегі ғылыми зерттеулерде баға жетпейді. Әсіресе химияның барлық облыстарында «белгіленген» атомдар әдісі кең қолданысқа ие.
1. 2. Ядролардың құрылысы мен беріктілігі
Химиялық элементтердің ядролары протондар мен нейтрондардан тұрады. Ядролық бөлшектер - протон және нейтрон - жалпы терминмен жиі айтылады: нуклондар . Протон оң зарядқа ие, сан мәні жағынан электрон зарядына 1, 6·10 -19 к (4, 8·10 -10 CGSE) тең, нейтрон электрлі бейтарап. Ядродағы протондар саны периодтық жүйедегі элементтің жағдайын анықтайтын атом номеріне (Z) тең. Қазіргі уақытта элементтердің белгілі атомдық номерлері 1-ден (сутегі) 103-ке (лоуренсий) дейінгі аралықта жатады. Ядродағы нуклондардың толық саны массалық сан А деп аталады. Ядродағы нейтрондар саны А- Z айырмасына тең.
Ядродағы протондар мен нейтрондарды ұстап тұратын табиғи күш нақты анықталмаған. Нейтрон зарядқа ие болмағандықтан, бұл күштер қарапайым электростатикалық (кулондық) тартылыс күші бола алмайтыны белгілі. Сонымен қатар, ядролық бөлшектердің байланысын түсіндіру үшін талап етілетін күштен бірнеше реттілікке әлсіз гравитациялық күштер де шығарылып тасталады. Ядролық күштер өте аз әсер ету радиусына ие - ядроның өлшеміне қарағанда бірнеше есе аз (~10 -13 см) . Нуклондар арасындағы әсер ететін күштер ауыспалы күш деп аталатын санға апарып береді. Ядрода нуклондар мезон деп аталатын ерекше бөлшектердің ауысуы үздіксіз өтетіндіктен байланысады деп есептейді; мезондардың массалары электрон мен протон массаларының арасындағы аралық орынды иеленеді.
Ядролық физикада масса бірлігіне 1/12 массалы 12 С көміртегі изотопы қабылданған; бұл шама атомдық бірлік масса (а. б. м. ) деп аталады 1 а. б. м. =1, 66·10 -24 г. Массалық сандар берілген изотоп массасының М дәл мәніне анағұрлым жақын толық санды ұсынады. Протон массасы 1, 00760а. б. м., нейтрон массасы - 1, 00899а. б. м., электрон массасы - 0, 00055а. б. м. құрайды.
Ядролық физикадағы энергияның шамасы әдетте электрон-вольтпен (эв) беріледі, 1эв 1в-қа тең тұрақты электр өрісіндегі потенциалдар айырмасынан өтіп, электронды иемденеді, бұл жерден 1эв=4, 8·10 -10 ·1/300=1, 6·10 -12 эрг. Әдетте анағұрлым ірі бірліктер қолданылады: 10 3 эв-қа тең килоэлектрон-вольт (кэв), 10 6 эв-қа тең мегаэлектрон-вольт (Мэв) .
Радиоактивті айналу процессінде ядроның потенциалдық энергиясы азаяды. Е кинетикалық энергиямен бөлшектерді шығару Эйнштейн теңдеуіне сәйкес жүйенің тыныштық массасының ∆m шамасына өзгеруімен сипатталады:
E= ∆mc 2 (1. 1)
Өз кезегінде, ұшып шыққан бөлшектердің релятивистік массасы ∆m -ге ұлғаяды, сондықтан жүйенің толық массасы сақталады. Химиядағыдай, реакцияның экзотермиялығы пайда болған өнімдердің тұрақтылығын көрсетеді, ядролық айналу кезіндегі тұрақты ядролар тыныштық массасының азаюына негізделген. Егер (1. 1) Эйнштейн теңдеуінің көмегімен анықталған бұл екі жүйенің энергия айырмасы оң шамаға ие болса, ядролық жүйе басқа ядролық жүйелермен салыстырғанда тұрақты болады. Ядролардың тұрақтылығын байланыс энергиясының шамасымен сипаттауға болады:
Е бай =[Zm p +(A-Z) m n -M] ·931Мэв (1. 2)
Мұндағы m p , m n және М - протонның, нейтронның және а. б. м. -мен белгіленген қарастырылып отырған ядроның массалары, ал 931Мэв - бір атомдық бірлік массаға эквивалентті энергия. Бір нуклон үшін орташа байланыс энергиясы тең:
ε=(( Zm p +(A-Z) m n -M) /A) ·931Мэв (1. 3)
Жинақталған протондар мен нейтрондардың тұрақтылығын иеленбейтін ядролар, сонымен қатар периодтық жүйенің соңындағы ауыр ядролар радиоактивті ыдырап, ең соңында орнықты ядроларға айналады.
1. 3. Радиоактивті ыдырау заңдары
Радиоактивті ядролардың өздігінен айналуы шығыс радиоактивті изотоп атомының (ядросының) санының үздіксіз азаюына және туынды өнімдердің пайда болуына әкеледі. Радиоактивті ыдырау ықтималдық процесстер қатарына қатысты, және оған статикалық талдау әдісі қолданылады.
Кейбір кездейсоқ оқиғалардың пайда болу ықтималдылығы деп жағымды оқиғалар санының оқиғалардың жалпы санына қатынасын атайды. М арқылы t уақыт ішінде ыдыраған атомдар санын белгілейміз, ал N 0 арқылы-шыққан атомдар санын белгілейміз. Онда таңдалған уақыт өтуі аралығындағы жеке атомдардың ыдырау ықтималдылығы (р) тең:
p t =M/N 0 (1. 4)
t уақыт ішінде ыдырамаған атомдардың ықтималдылығы (q) тең:
q t =1-p t =(N 0 -M) N 0 =N t /N 0 (1. 5)
мұндағы N t =N 0 -M - t уақыт ішінде ыдырауға ұшырамаған атомдардың орташа саны.
∆t уақыт ішіндегі жеке атомның ыдырау ықтималдылығы р ∆t берілген уақытта немесе одан ертеректеу уақытта атомның болу шартынан тәуелді емес. Бұл ықтималдылық тек ∆t аралық шамасынан ғана тәуелді және өте аз уақыт аралығына ∆ t пропорционал, осылайша
р ∆t = λ· ∆t ,
мұндағы λ пропорционалдық коэффициенті берілген радиоактивті изотоп үшін сипатталатын тұрақты болып табылады.
Жеткілікті аз уақыт аралығында ∆t ыдырамайтын атом ықтималдылығы мынаған тең:
q ∆t = 1-λ· ∆t .
Бірақ егер атом ∆t уақыт ішінде ыдырамаса, онда ол екінші дәл сондай уақыт аралығында да ыдырамайды, тағы да (1-λ· ∆t ) -ға тең. Атомның бірінші де, екінші де уақыт аралығында ыдырамайтын ықтималдылығы бұл ықтималдықтарды жасауға тең болады; ары қарай да осы сипатқа ұқсас талқылай отырып, мынаны аламыз:
q 2 ∆t = (1-λ· ∆t) 2
q 3 ∆t = (1-λ· ∆t) 3
. . .
q n ∆t = (1-λ· ∆t) n
Қарастырылып оытрған ∆t уақыт аралығы аз болған сайын соңғы теңдеу соғұрлым нақтырақ болады. ∆t=t/n екенін ескере отырып және n→∞ шегіне өте отырып, мынаны аламыз:
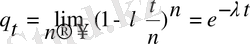

1-cурет. Радиоактивті ыдыраудың типтік қисығы
1-суреттегі қисықпен уақыт бойынша радиоактивті изотоптардың атом сандарының өзгерісі көрсетілген.
(1. 5) -ден алынған q t -ның мәнін қойсақ, мынаны аламыз:
N t =N 0 e -λt (1. 6)
(1. 5) және (1. 6) теңдеулерін біріктіре отырып, уақыт бойынша ыдыраған атомдар санының өзгеруі үшін тәуелділікті табуға болады.
M=N 0 (1-e -λt ) (1. 7)
λt-ның аз мәні үшін e -λt =1-λt теңдігі дәл орындалады, онда:
М=N 0 λt, немесе M/t=λN 0 .
M/t қатынасы -dN/dt арқылы сипаттауға болатын ыдыраудың орташа жылдамдығын көрсетеді (- таңбасы радиоактивті изотоптардың уақыт бойынша атом санының N азаятынын көрсетеді) және осылайша
-dN/dt=λN (1. 8)
(1. 8) теңдеуі дифференциалды формада радиоактивті ыдыраудың негізгі заңын сипаттайды. Оны N(0) =N 0 және N(t) =N t шартында интегралдау негізгі ыдырау заңының интегралды түрін сипаттайтын (1. 6) теңдеуге әкеледі.
(1. 8) негізгі ыдырау заңына сәйкес шексіз аз уақыт аралығында dt ыдырайтын ядролар саны dN, берілген уақыт мезетін иеленген ядролар санына N пропорционал. λ тұрақтысы радиоактивті изотоптар ядросының тұрақсыздығын сипаттайды және тұрақты ыдырау немесе радиоактивті тұрақты деп аталады. (1. 8) -ден байқағанымыздай,
λ=(- dN/N) / dt (1. 9)
Бұл жерден λ ыдырау тұрақтысы жартылай ыдырау периодымен салыстырғанда уақыт бірлігі өте аз шарт бойынша бірлік уақыт ішінде ыдырайтын dN/N атомның бір бөлігіне тең екендігі көрініп тұр. λ қайтымды уақыт өлшемін иеленеді және бәрінен бұрын сек -1 -мен белгіленеді. Радиоактивті ыдыраудың негізгі заңының мәні мынада, бірдей уақыт аралығындағы тұрақты бөліктің радиоактивті изотоп атомдарының берілген уақытты иеленген жалпы мөлшерінен ыдырауында.
Радиоактивті зат атомдарының ыдырау жылдамдығын -dN/dt а препараттың абсолютті радиоактивтілігі (немесе абсолютті активтілік) деп аталады. (1. 8) негізінде
а =λN (1. 10)
Абсолютті активтілік бірлігіне 1 кюри қабылданған. Кюри - 3, 7000·10 10 ыдырау/сек өтетін радиоактивті көздің активтілігі. Абсолютті активтілікті сипаттау үшін сонымен қатар кюридің мың бөлігін (милликюри, мкюри) және кюридің миллион бөлігін (микрокюри, мккюри) қолданылады. Осылайша,
1 кюри 3, 7·10 10 ыдырау/сек=2, 22·10 12 ыдырау/мин;
1 мкюри 3, 7·10 7 ыдырау/сек=2, 22·10 9 ыдырау/мин;
1мккюри 3, 7·10 4 ыдырау/сек=2, 22·10 6 ыдырау/мин; (1. 11)
«Белгіленген» атомдар әдісінде қолданылатын үлгілердің активтілігі әдетте микромилликюри диапазонында жатады.
Абсолютті активтілік бірлігі ретінде сонымен қатар резерфорд (Р) 1Р деп аталатын шама да ұсынылған. 10 6 ыдырау/сек өтетін радиоактивті препараттың активтілігі бар. Микрорезерфорд 1ыдырау/сек активтілікке сәйкес келеді. Бұл бірлік кюриге қарағанда анағұрлым ыңғайлы, кең таралымға ие болмаған.
Сонымен қатар, уақыт бойынша абсолютті активтіліктің азаюы негізгі ыдырау заңына бағынады. (1. 6) теңдеуінің 2 жағын да λ-ға көбейтіп, (1. 8) -ді назарға ала отырып, мынаны аламыз:
a t =a 0 e- λt (1. 12)
мұндағы a 0 - бастапқы уақыт мезетіндегі абсолютті активтілік, a t - t уақыт мезетіндегі абсолютті активтілік.
Практикалық жұмыста радиоактивті заттармен препараттардың абсолютті активтілігі ережедегідей үздіксіз анықталмайды. Сәулеленудің әр түрлі қасиеттерін қолданатын өлшеу құрылғылары әдетте а -ға пропорционал шаманы береді; бұл шаманы тіркей активтілігі І деп атайды. Тіркеу активтілігінің ядролық бөлшектер есептегішімен жұмыс кезінде импульсте минутқа сипатталатын есептің жылдамдығы болып табылады (имп/мин), ал абсолюттік және тіркеу активтілігінің шамасын байланыстыратын пропорционалдық коэффициенті есеп коэффициенті (ϕ) деп аталады:
I=ϕ a (1. 13)
(1. 8) және (1. 9) теңдеуінің негізінде уақыт бойынша тіркеу активтілігінің өзгерісін өлшеудің ұқсас шарттарын сонымен қатар негізгі ыдырау заңы ретінде көрсетуге болады:
I t =I 0 e -λt (1. 14)
Мұндағы I t және I 0 - t уақыт мезетіне сәйкес тіркеу активтілігінің мәні.
Радиоактивті иотоптардың орнықтылығын жартылай ыдырау периоды шамасымен жиі сипаттайды. Берілген изотоптағы атомдар мөлшерінің жартысының ыдырауы кезіндегі жартылай ыдырау периодын Т уақыт аралығы деп аталады. Жартылай ыдырау периодына тең уақыттағы радиоактивті изотоптан тұратын препараттың абсолютті активтілігі а және тіркеу активтілігі І (мысалы, есеп жылдамдығы) екі есе азаяды:
N t /N 0 = a t /a 0 =I t /I 0 =1/2=e -λt (1. 15)
Бұл жерден шығатыны:
λT=ln2=0, 693 (1. 16)
Соңғы қатынастың негізінде жартылай ыдырау уақытына еселі; әрі уақыт ішінде радиоактивті изотоптың ыдырау дәрежесін тез есептеуге мүмкіндік беретін формуланы алуға болады. t=mT болсын, онда:
a mT /a 0 =1/e mλT =1/e mln2 .
е негізі бойынша соңғы теңдеуді логарифмдеп және потенциалдап, мына теңдеуге келеміз:
a mT /a 0 =1/2 m , (1. 17)
мұндағы m=t/T.
ІІ тарау. Сәулеленуді тіркеу
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz