Магний шикізатын өндіру және өңдеу әдістері: карналитті сусыздандыру, электролиз және қалдықтарды өңдеу


СОДЕРЖАНИЕ
КІРІСПЕ4
1 ТЕОРИЯЛЫҚ БӨЛІМ6
1. 1 Магнийдің шикізат көзі6
1. 2 Шикізатты өндіруге дайындау6
1. Сусыз магний хлоридін өндіру әдістері17
2. Магний хлоридінің түйіршіктерін алу әдістері17
3. Титан-магний өндірісінің қалдықтарын өңдеу17
4. Гидратталған магний хлоридінен сусыз магний хлориді бар17
5. Карналлит сапасының ток бойынша шығымға әсері18
ҚОРЫТЫНДЫ19
ҚОЛДАНЫЛҒАН ӘДЕБИЕТТЕР ТІЗІМІ20
Қазақстан Республикасы Білім және ғылым министрлігі
«Химия, металлургия және байыту» кафедрасы
КУРСТЫҚ ЖҰМЫС
Тақырыбы: Магний шикізатын өндіру
КІРІСПЕ
Маңызды қосылыстары және қолданылуы
Магний - күміс түсті ақ металл, атомдық массасы оттегіне қатысты жоғары химиялық белсенді, хлормен жақсы әрекеттеседі, сұйытылған минералдық қышқылдарда жақсы ериді.
Маңызды физико-химиялық қасиеттері:
Хлорлы сумен магний әрекеттеспейді, қайнап жатқан хлорлы сумен әрекеттесіп сутегі және магний гидроксидін түзеді.
Сұйытылған сілті ерітінділерімен магний әсерлеспейді. Тұздардың сулы ерітіндісінде магний аздап коррозияға ұшырайды. Хлорид ерітінділерінде интенсивті түрде коррозияланады.
MgО - магний оксиді, балқу температурасы 2825 0 С, балқу температурасы - 3600 0 С, суда ерігіштігі өте аз - 0, 086 г/дм 3 (30 0 С-де), қышқылдармен әрекеттеседі.
MgСО 3 - магний карбонаты, тығыздығы 3 г/см 3 , магний оксидіне ыдырап, 500 0 С температурада СО 2 бөле жүреді.
MgSO 4 - магний сульфаты, 1137 0 С балқып ыдырайды, судағы ерігіштігі 374 г/дм 3 (250 0 С-да) .
MgCl 2 - магний хлориді, өте гигроскопиялық қосылыс, 714 0 С балқиды және 1370 0 С қайнайды; ерігіштігі 555 г/дм 3 (25 0 С-да) . Құрамында MgCl 2 -сі бар минералдары карналит және бишофит.
Магний көптеген металдармен балқымалар түзеді, олар жай магнийге қарағанда химиялық тұрақты және механикалық берік болады.
Магний қосылыстарының тағы бір ерекшелігі олардың тығыздықтарының аз болуы (1, 7-1, 83 г/см 3 ) осыған қарамастан олар механикалық берік және соққыларға төзімді, үйкеліс кезінде жарқылдақ болмауы.
Қолданылуы:
- алюминий негізінде қоспалар алуда
- автокөлік детальдарын
- ұшақтар
- композициялық материалдар жасауда
- қысым арқылы құйылған магнийді автокөлік құрылысында қолданылады.
Аса маңызды тұтынушысы болып металлургия саласы саналады. Оны металлотермиялық әдіс арқылы тотықсыздандырғыш металл ретінде көптеген металдар өндірісінде қолданады (V, Cr, Zn, Ti, Be, Hf, U) .
Кейінгі кезде магнийдің маңызды тұтынушысы ретінде қара металлургия дамуда. Оны балқыған шойынға қосса оның механикалық қасиеттері жақсарады.
Магнийдің ұнтағын химия өндірісінде органикалық синтез реакцияларында, гальваникалық элементте анод ретінде, жер асты құбырларын коррозиядан қорғау үшін, кеме корпусын және т. б. қаптауда қолданады.
Асбесті 2MgO ∙ 2SiO 2 ∙ 2H 2 O жылу сақтайтын қосылыстар, электрөткізбейтін және құрылыс материалдарын жасауда қолданылады.
1 ТЕОРИЯЛЫҚ БӨЛІМ
1. 1 Магнийдің шикізат көзі
Магний өндірісінің бір ерекшелігі оның шикізат көздерінің көп болуы. Ол 1-ші кестеде келтірілген. Негізгі шикізат көзі болып: магнезит, доломит, теңіз суы (0, 1-0, 4 % MgCl 2 ), тұзды көлдер, жерасты хлорлы тұздар (∼ 32 % MgCl 2 ) . Сонысен қоса магнийді титанды магниотермилық тотықсыздандыру кезінде титан хлоридінен бөліп алады.
1 кесте - Магнийдің маңызды минералдары
Магнезиттің ірі кен орындары Ресей, Қазақстан, Индия, Қытай, Корея, Бразилия, Югославия, Греция, Австралия, АҚШ, Канада т. б.
Мұхиттар, теңіздер, және кейбір минералды көлдер магний өндірісінің шексіз таусылмайтын шикізат көзі болып табылады.
Қазақстанда Ақтөбе, Көкшетау, Шығыс Қазақстан облыстарында магнезит пен доломиттің ірі кен көздері бар. Кейбір кен орындар Өскемен титан-магний комбинатына жақын орналасқан. Карбонаттың шикізаттан УКТМК-да шликотермиялық әдіспен магний өндіріге болады.
1. 2 Шикізатты өндіруге дайындау
Бүкіл әлемде магнийді өндіруде бір-біріне ұқсамайтын екі әдісті қолданады - электролиттік және термиялық, бұлардың бірнеше модификациялары бар, ол олардың шикізат көзіне, өндіріс масштабтарына байланысты.
Аса көп қолданатын электролиттік әдіс. Бұл әдістің шикізат көзі болып MgCl 2 саналады, оны теңіз суынан, магнезит және доломит шикізаттары. Шикізатты электролизге дайындау келесі кезеңдерден құралады: концентрлеу, сусыздандыру және хлорлау.
Магнийді теңіз суынан бөліп алу. Теңіз суы екі нұсқа бойынша өңдейді:
- Әктаспен;
- Күйдірілген доломитпен (СаО + MgO-ң күйдірілген өнімі) .
Суда еріген магний хлориді СаО + MgO мен әрекеттесіп, ерімейтін Mg(OН) 2 және еритін СаCl 2 түзіледі:
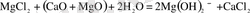
Mg(OН) 2 тұнбасын фильтрлеу арқылы СаCl 2 -ден бөледі немесе қыздырып қатты MgO алады немесе тұз қышқылымен өңдейді.
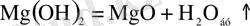
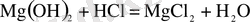
Алынған 15 % магний хлоридін бумен өңдеп гидратор алады:

Мұндай өнімді электролизбен өңдеу мүмкін болмағандықтан оны сусыздандыру қажет.
Бір гидраттық түрден екінші гидраттық түрге өткен кездегі температуралар эксперименталдық түрде анықталған, 0 С.
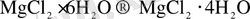
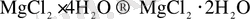
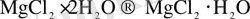
Екісулы магний хлоридінің бірсулысына өткен кезде, басқа да қосылыстар түзіледі. Магний гидроскохлориді MgOHCl және хлорлы сутегі түзіледі.

 -ң гидролизі 304-554
0
С интенсивті түрде жүреді. 554
0
С бастап магний гидроксидінің диссоциациясы басталады:
-ң гидролизі 304-554
0
С интенсивті түрде жүреді. 554
0
С бастап магний гидроксидінің диссоциациясы басталады:

700
0
С-да MgOHCl толығымен MgO және HCl-ға ыдырайды. Осыған байланысты гидраттарын қыздыру арқылы сусыз
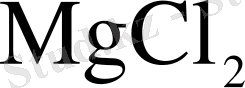 алу мүмкін емес.
алу мүмкін емес.
Сусыз карналитті өндіру
Карналитті сусыздандыру екі сатымен жүргізіледі - екісулы және сусыз карналит алу.
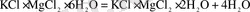

 -ның
-ның
 -ға өтуі 90
0
С басталып аяғына дейін жүреді, ал
-ға өтуі 90
0
С басталып аяғына дейін жүреді, ал
 -ға өтуі 150
0
С басталып 180-200
0
С аяқталады.
-ға өтуі 150
0
С басталып 180-200
0
С аяқталады.
Карналитті балқытпай қыздыру кезінде одан бумен қоса HCl-да бөлінеді. Бұл деградациядан басқа карналиттің гидролизі жүріп, нәтижесінде хлорлы сутегі, гидролизденген карналлит
 және магний гидроксохлоридтері
және магний гидроксохлоридтері
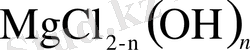 түзіледі. Бұл қосылыстар карналитті ары қарай қыздырғанда термиялық диссоциацияланып магний тотығы түзіледі.
түзіледі. Бұл қосылыстар карналитті ары қарай қыздырғанда термиялық диссоциацияланып магний тотығы түзіледі.
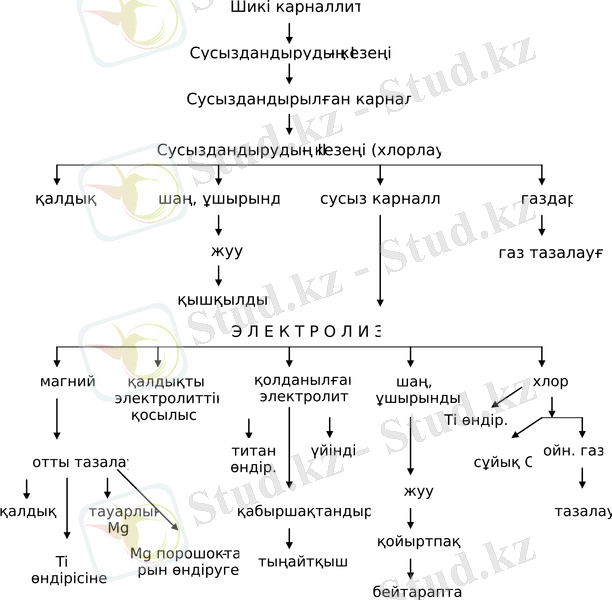
Сурет 1 - Магнийді электролиттік жолмен карналиттен өндіру
Гидролиз дәрежесі деп - гидролизге түскен
 -ң сусыздандыру кезіндегі мөлшерінің
-ң сусыздандыру кезіндегі мөлшерінің
 -ң бастапқы гидраттағы мөлшеріне қатынасына тең.
-ң бастапқы гидраттағы мөлшеріне қатынасына тең.

Г - гидролиздену дәрежесі, %
 - сусыздандырылған өнімдегі магний тотығының және магний хлоридтерінің мөлшерлері, %
- сусыздандырылған өнімдегі магний тотығының және магний хлоридтерінің мөлшерлері, %
2, 36 -
 және
және
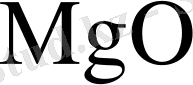 -ң молекулярлық салмақтарының қатынастары.
-ң молекулярлық салмақтарының қатынастары.
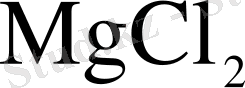 -ң шығымы:
-ң шығымы:
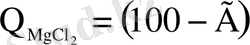 .
.
Карналитті сусыздандыру барысында оның балқу температурасы да өседі: алтысулы карналлит 167, 5
0
С балқиды да,
 және
және
 -ға ыдырайды, екісулы карналлит 263, 8
0
С балқып ыдырамайды, сусыз карналлит - 490
0
С балқиды.
-ға ыдырайды, екісулы карналлит 263, 8
0
С балқып ыдырамайды, сусыз карналлит - 490
0
С балқиды.
Алтысулы карналлитті тез қыздыру арқылы сусыз карналлит алу мүмкін емес, себебі бастапқы материал өзінің кристалдық суында балқиды, оны ары қарай сусыздандыру гидролиз және техникалық қиыншылықтарға әкеледі. Өндірістік масштабтарда толығымен сусыздандырылған және
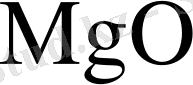 қосылыстары жоқ карналлит алу мүмкін емес.
қосылыстары жоқ карналлит алу мүмкін емес.
Толығымен сусыздандырып және зиянды қосылыстарынан арылту үшін, алдын ала сусыздандырылған карналитті балқытады, ал
 қосылысын сусыз балқымадан тұндыру немесе
қосылысын сусыз балқымадан тұндыру немесе
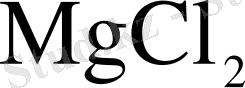 -ге шығару хлорлау арқылы бөліп алады. Сусыздандыруды екі кезеңмен жүргізеді:
-ге шығару хлорлау арқылы бөліп алады. Сусыздандыруды екі кезеңмен жүргізеді:
1. Бірінші сусыздандыру қатты кезінде температура аса үлкен емес 200-300 0 С нәтижесінде сусыз карналлит алынады.
2. 750-800 0 С балқытып және тереңдете сусыздандырып сусыз карналлит алу.
Балқытылған және қатты қыздырылған карналлитте әрқашанда қатты
 тотықтары болады, олар гидролизденген карналиттің термиялық ыдырау нәтижесінде түзіледі. Мұндай қосылысты көміртегінің қатысында хлормен өңдесе, онда
тотықтары болады, олар гидролизденген карналиттің термиялық ыдырау нәтижесінде түзіледі. Мұндай қосылысты көміртегінің қатысында хлормен өңдесе, онда
 тотығы хлорланады:
тотығы хлорланады:

Балқымадағы магний гидроксохлоридінің ыдырауы:

Балқыған карналитті хлорлау арқылы толығымен сусыздандырып және
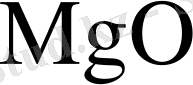 -ны
-ны
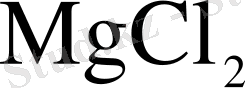 -ге өткізу арқылы гидролиз кезіндегі жоғалымдарды азайтуға болады.
-ге өткізу арқылы гидролиз кезіндегі жоғалымдарды азайтуға болады.
Балқымадағы
 -ның хлорлануы температураның өсуімен өседі, 750
0
С температурада ол өзінің оптималды мәніне жетеді. Өндірісте карналлит құрамында
-ның хлорлануы температураның өсуімен өседі, 750
0
С температурада ол өзінің оптималды мәніне жетеді. Өндірісте карналлит құрамында
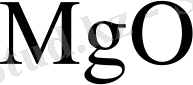 -дан басқа (Fe
2
O
3
, Al
2
O
3
, SiO
2
) тотықтарда болады, оларда хлорланып FeCl
3
, AlCl
3
түзеді.
-дан басқа (Fe
2
O
3
, Al
2
O
3
, SiO
2
) тотықтарда болады, оларда хлорланып FeCl
3
, AlCl
3
түзеді.
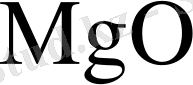 мен Fe
2
O
3
-тің хлорлану жылдамдықтары бірден, ал Al
2
O
3
пен SiO
2
-ң хлормен әрекеттесуі баяуырақ.
мен Fe
2
O
3
-тің хлорлану жылдамдықтары бірден, ал Al
2
O
3
пен SiO
2
-ң хлормен әрекеттесуі баяуырақ.
Сусыздандырудың бірінші кезеңі айналмалы құбырлы пештерде жүргізіледі. Отын ретінде генераторлық газдар, табиғи газ немесе мазут қолданылады. Жанған газ температурасы 1200 0 С болады, оны суытпай барабанды пешке беруге болмайды себебі карналлит балқып кетеді. Газ температурасын төмендету үшін оны араластыру камерасында суық екіншітекті ауамен сұйылтады.
Барабаннан шыққан сусыз карналлит температурасы 200-250 0 С.
Айналмалы пеште карналитті бірінші кезеңдік сусыздандырудың технологиялық көрсеткіштері:
2 кесте - Карналитті сусыздандыруға дейінгі және сусыздандырудан кейінгі химиялық құрамы
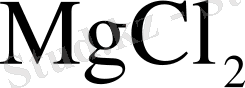


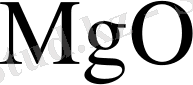

Бастапқы байытылған
карналлит
Сусыздандырылған карналлит:
Айналмалы пеште
Сусыздандыру кезіндегі
шаң айналмалы пеште
Құбырлы пештен шығатын газдармен ұшқан карналлит жақын циклондарда ұстап, сусыздандырылған карналлитпен араластырып тереңдете сусыздандыруға яғни балқытуға жібереді.
Карналитті қайнау қабатты пештерінде бір кезеңмен жүргізу кезінде карналиттің гидролизденуін жойып және сусыз, гидролизденбеген қатты карналлит алуға болады.
Процестің технологиялық көрсеткіштерін көтеру үшін қайнау қабатында хлорлы сутегінің артық мөлшері болуы тиіс.
Карналитті сусыздандыруды қайнау қабатты және құбырлық пештерде жүргізу кезіндегі технологиялық көрсеткіштерін салыстырамыз:
- қайнау қабатты пешінде процесс интенсивті жүреді
- өнімділігі 1, 5-2 есе үлкен
- қайнау қабатты пешінде сусыздандырудың оптималды температурасын ұстап тұруға болады
- бір кезеңмен сусыз және гидролизденген карналлит алуға болады
- қайнау қабатты пеші экономикалық тиімді және қолдану мерзімінің ұзақтығы.
Карналлитті тереңдете сусыздандыруды балқыту арқылы стационарлы пеште немесе хлораторда жүргізеді.
Стационарлы пешпен хлоратордың көрсеткіштерін салыстыру:
1. Хлоратордың өнімділігі екі-үш есе үлкен
2.
 -ні тиімді қолдану хлораторда 10-12 % жоғары
-ні тиімді қолдану хлораторда 10-12 % жоғары
3. Хлораторда меншікті электр энергиясының шығыны 8-10 % төмен, себебі хлорлау кезінде жүретін экзотермиялық реакциялардың жылулары хлораторда қалады.
Хлораторда алынған карналлит құрамында
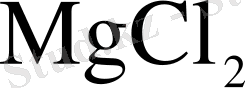 52 %, ал стационарлы пеште 49 %-ды құрайды.
52 %, ал стационарлы пеште 49 %-ды құрайды.
Карналлиттік хлоратор негізгі үш бөліктен тұрады: балқытқыш, реакциялық камера және миксер (тұндырғыш), бәрі бір қаптамада орналасқан.
Қатты сусыздандырылған карналлитті және ұсатылған мұнай коксымен үздіксіз балқытқышқа тиейді, онда карналлит балқып судың көп бөлігінен ажырайды. Процеске қажетті жылуды балқымаға батырылған электродтар бөледі. Балқытқыштағы балқыма деңгейін үнемі қадағалап отырады, карналлитті тиеу және оның балқымасының мөлшерінің өсуі кезінде, балқыма астауша арқылы реакциялық камераға құйылады.
Хлоратордың реакциялық камерасына өткен карналлит құрамында 4 %
 ; 0, 3-0, 5 % су және карналлитпен тиелген мұнай коксының барлық мөлшері болады.
; 0, 3-0, 5 % су және карналлитпен тиелген мұнай коксының барлық мөлшері болады.
Фурмалар арқылы реакциялық камераның төменгі бөлігіне қысыммен хлорлы ауа және магний электролизераларының анодтық газдары (65-75 % Cl) үрленеді. Хлор MgOHCl және MgO мен хлордың шығынын үнемі қадағалап отырады, оны қолдану дәрежесі 50 %-дан төмен болмау керек. Сонда балқымада 0, 6-0, 8 % MgO қалады, бұл процеске тиімді әсер етеді, себебі басқа тотықтардың хлорлануын тежейді, электролизге зиянды темір хлоридтерін және кремнийдің хлоридтерінің түзілуіне кедергі жасайды.
MgO-ның кейбір бөлігі миксерде және қалғаны электролизге жіберілетін сусыз карналлит құрамында болады (
 ) .
) .
Реакциялық камерада тотықтардың хлорлануынан бөлек сульфаттардың тотықсыздануы жүреді, олар 750-820
0
С толығымен жүруі мүмкін, осы шартта ғана
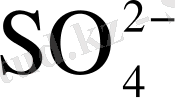 -тің балқымадағы мөлшерін 0, 02-0, 03 %-ға дейін төмендетуге болады.
-тің балқымадағы мөлшерін 0, 02-0, 03 %-ға дейін төмендетуге болады.
Өндірістік практикада көрсетілгендей қосындылар тез тұнады, ал кокс балқыма бетіне қалқып шығады, егерде миксердағы температура 700-720 0 С төмен болмаса.
Сусыз карналлитті ковштарға құйып электролиз цехына апарады.
Хлорлаудың газдық өнімдері - НСl, СО, СО 2 , ұшқыштары FeCl 3 , AlCl 3 аулақтайтын газдармен хлоратордан шығып газ тазалауға кетеді.
Хлорлау процесінің технологиялық көрсеткіштері және хлоратордың жұмыс істеуінің технологиялық режимі келесідегідей:
3 кесте - Сусыз карналлит және қалдықтың мөлшерлік құрамы
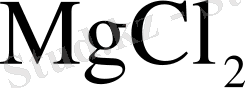


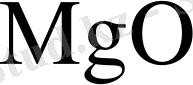
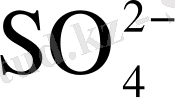
Хлоратордан алынған
сусыз карналлит
Стационарлы пештен
алынатын карналлит:
Жоғарыда атап өтілген артықшылықтарына қарамастан хлоратордың да кемшіліктері бар: хлорды қолданудың төмендігі (50 % төмен), ол хлордың жоғалымына және аулақтайтын газдардың тазалануына кететін шығындарды өсіреді. Хлоратордан шығатын KCl ∙ MgCl 2 құрамында көміртегі болады, ол карналлит электролизіне кері әсер тигізеді.
1. 3 Магнийді электролиттік өндіру
Магнийді электролиттік өндіру үшін электролит келесі талаптарға жауап беруі тиіс:
1. Балқу температурасы төмен болуы қажет;
2. Тығыздығы сұйық магний тығыздығынан 0, 1-0, 2 г/см 3 -қа жоғары болуы қажет;
3. Гидролизденбеуі ұшпауы тиіс;
4. Тұтқырлығы аз болуы қажет;
5. Қосылыстар мөлшері аз болуы қажет, ол ток бойынша шығымға әсер етеді;
6. Жоғарғы электрөткізгіштік қасиеті болуы керек.
Магний өндірісінде 4 түрлі электролит қолданылады, олардың атаулары құрамындағы тұздың мөлшеріне байланысты:
Тиімді электролитті таңдау бастапқы магний шикізатының қасиеттеріне, электролиздердің конструкциясына байланысты. Мысалы: калийлік электролит электролиздерді сусыз карналитпен қамтамасыз еткенде түзіледі, ал шикізат ретінде таза MgCl 2 қолданғанда натрийлі-калийлік электролит қолданған тиімді.
Электролит құрамына оның негізгі құрамынан басқа да компоненттер қосылады, олар электролит қасиеттерін жақсартады, электролиттегі MgCl 2 -ң еруін ұлғайтады, электрөткізгіштігін көтереді.
Электролиздерде жүретін процестер. Балқыған MgCl 2 -ні иондық балқымаларға жатқызады. Оның диссоциациясын келесі түрде көрсетуге болады:
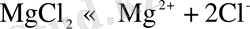
Электролиздегі процесті жүретін аймағына байланысты үш топқа бөлуге болады:
1. Катодтық, катодты және осыған жанасатын электролит аймағы
2. Анодтық, анодты және анодтық электролитке батырылған аймағы
3. Электролиттің барлық мөлшерінде - электродтар арасындағы саңылауларда.
Катодтық процестер. Магнийлік электролиздерде жүретін процесс - оның жұмыстық бетінде магний иондарының разрядталуы және металдық магнийдің бөлінуі. Электролиттің температурасы магнийдің балқу температурасынан жоғары, сондықтан ол катодта сұйық күйінде бөлінеді.

Бұл кезде магнийдің бөлінуі тепе-теңдік потенциалында жүреді. MgCl 2 -ң жоғарғы концентрациясында электрохимиялық поляризацияның мәні 20 мВ аспайды. MgCl 2 -ң концентрациясының азаюымен магнийдің потенциалы концентрациялық поляризацияға байланысты теріс мәнге ие бола бастайды және балқымадағы MgCl 2 -ң белсенділігі азаяды. Химиялық поляризация болмайды.
MgCl 2 -ң мөлшері 5-7 % болғанда және ток тығыздығын 0, 5 А/см 2 болғанда Mg 2+ , Ca 2+ және сілтілік металдардың ток бойынша шығымының азаюын әкеледі. MgCl 2 -ң концентрациясын және катодтық ток тығыздығын ескеріп, ток бойынша шығымды көтеру үшін концентрацияның төменгі мәні 10-12 % (салм) шамасында болуы қажет.
Анодтық процестер. Графиттік анодтағы хлор иондарының разрядталуы:
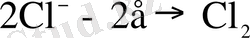
Графиттік анодта хлордың электролиттік бөлінуі кезінде поляризация 0, 1 В шамасында байқалады. Поляризацияның болу себебі газ пленкасының кедергісі және анодпен хлор атомдарының сорбциясы, одан әрі хлор молекулаларының десорбциясы байқалады.
Өндірісте 0, 4-0, 5 А/см 3 ток тығыздығында хлор иондарының разрядталуы асқын кернеусіз жүреді, анодтық эффект байқалмайды.
Электролитпен электродтарда жүретін зиянды процестер:
1. Магнийдің тотығуы. Электролит бетіне қалқып шығатын сұйық магнийдің ауаның оттегісімен әрекеттесуі - ток бойынша шығымның азаюына әкеледі. Ток бойынша шығымның азаюы MgО-ң түзілуінен және магний тамшыларының қоқысқа әкетілуі.
2. Су қосылыстарының әсері. Судың кері әсері келесі реакциялардың жүруімен түсіндіріледі
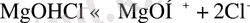

MgО катодты пассивтендіріп, оның магниймен шайылуын қиындатады; магний кішкене тамшы түрінде бөлінеді.
3. Марганец пен темір қосылыстары. Бұл қосындылар магнийге қарағанда оң электродтық потенциалдары бар, сондықтан олар катодта негізгі металмен шөгіп ток бойынша шығымды және алынатын магнийдің сапасын төмендетеді.
Темір иондарының магниймен тотықсызданып электролиздер түбіне шөгуі де мүмкін.
4. Сульфатты қосылыстар. Сульфаттардың электролиттегі мөлшері аз болған жағдайдың өзінде ақ, ол ток бойынша шығымды азайтады. Ол келесі реакциямен түсіндіріледі:
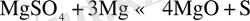
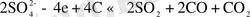
Тотықсыздандыру барысында түзілетін күкірт балқымада
 полимерлері түрінде болады, олардың иондық сұйықтарда жоғарғы беттік энергиялары және қатты катодта адсорбцияланып, оның пассивтелуіне әкеледі.
полимерлері түрінде болады, олардың иондық сұйықтарда жоғарғы беттік энергиялары және қатты катодта адсорбцияланып, оның пассивтелуіне әкеледі.
Қалдықтың түзілуі. Жоғарыда айтылған зиянды қосылыстар электролиттен бөлініп электролиттік ванна түбіне шөгеді. Электролиттің сұйық тұздарын сіңірген тұнба қара немесе қара қоңыр түсті қалдық түзеді. Қалдық Mg, Al, Si, Fe тағы басқа металдардың тотықтарынан тұрады. Онда тағы электролитте ерімейтін фтор тұздары, көміртегі, карбид, нитридтер, сульфидтер болады. Қалдықта MgО-ң болуы MgCl 2 -ң гидролизі кезінде магнийдің ауаның оттегісімен тотықсыздануы нәтижесінде болады.
Al 2 O 3 және SiO 2 қалдыққа, бастапқы шикізатпен, техникалық фторлы тұздармен және графит анодтарының тозуы салдарынан келуі мүмкін.
Қалдық тығыздығы 1, 8-1, 9 г/см 3 шамасында. Қалдықтың құрамы: хлоридтер - 65 %, магний оксидтері - 18 %, металдық магний - 4 %. Қалдықтың қатты бөлігінің 70-90 % MgО құрайды.
Таза шикізатты натрийлі-калийлі электролитпен өңдегенде қалдықтың меншікті ең аз мөлшері алынады, ал натрийлі-кальцийлі электролитпен өңдегенде қалдықтың ең көп меншікті мөлшері мөлшері алынады.
Қалдықсыз процесс ойлап табылған, мұнда қалдық мөлшері минималды - 0, 02-0, 03 кг/кг магний.
Бұндай процестің негізгі шарттары:
- электролизер түбінің анодтық поляризациясы (бұл кезде кремний, алюминий, темір қосылыстарының хлорлануынан ток бойынша шығым азаяды)
- шикізатпен үздіксіз қамтамасыз ету
- қалдықтың бөлек электролиздік жәшікте жинау
- табанының қыздырылуы
- өте таза шикізат қолданылуы керек.
Осы шарттарды орындау үшін электролизердің конструкциясының көптеген өзгерісіне әкеледі.
Магнийді өндіруге арнлған электролизерлар.
Қазіргі магний өндірісінде екі түрлі электролизерлар қолданылады - диафрагмалы және диафрагмасыз.
Диафрагмалы электролизерларда анодтар және катодтар арасында диафрагмалар орналасқан. Диафрагма электролитке 15-25 см батырылған және электролиз кезінде алынатын анодтық және катодтық өнімдерді бөледі, олардың қосылуын болдырмайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz