Тұздардың гидролизі: механизмдері, түрлері және қолданылуы


Кіріспе
ГИДРОЛИЗ (гидро . . . және грек. lysis - айыру, ыдырау) - су мен түрлі заттар арасындағы иондық алмасу реакциясы. Гидролизге тұздар, гижридтер, тиоангидридтер. галогенангидридтер, әр түрлі органик. қосылыстар (белоктар, майлар. эфирлер, т. б. ) ұшырайды. Гидролиз кезіндегі еріген зат пен су құрамындағы иондардың қосылуынан нашар диссоциацияланатын заттар түзілетіндіктен, сутек және гидроксид иондарының концентрациясы өзгереді. Сондықтан Гидролиз нәтижесінде тұздардың көпшілігінің ерітінділері қышқылдык, не сілтілік реакция көрсетеді Гидролиз - қайтымды процесс. Сандық тұрғыдан Гидролизді Гидролизге к о н ст а н т а с ы м е н (Гидролиз реакциясынын тепе-тендік константасымен), яғни К және Гидролизге ұшыраған иондар мен молекулалар бөлшектері санының ерітіндіге енгізілген бөлшектердін жалпы санына қатынасын білдіретін гидролиздену дәрежесімен (а г ) сипаттайды. Тұздар Гидролизді хим. өнеркәсібінде, лаб-ларда көптеген маңызды процестердің, ал органик. қосылыстар Гидролизді су әсерінен органик. қосылыстардың екі және одан да көп заттар кұрап ыдырауынын негізі болып табылады. Күрделі эфир. глюкозид. амид байланыстарының Гидролизді организмнің тіршілігінде үлкен рөл аткарады. Гидролиз ағаш өндеу өндірісі мен аш. қалдықтарынан этил ширті, глюкоза, т. б. заттарды алуда қолданылады.
Негізгі бөлім
2. 1. Күшті негіз бен күшті қышқылдан түзілген тұз
Тұз иондарының су молекуласындағы иондармен концентрацияларының өзгеруін гидролиз деп атайды. Немесе гидролиз деп тұздардың су әсерінен ыдырауын айтады. Сондықтан, тұздардың ерітіндісіне индикаторлар қосқанда не қышықылдық, не сілтілік орта көрсетеді.
Тұздар гидролизінің 4 түрлі жағдайы бар, оның үш жағдайында олар гидролизденеді, ал төртінші жағдайда гидролизденбейді. Көп негізді қышқылдар, мен көп қышқылды негіздердің тұздары сатылап гидролизденеді.
1. Күшті негізбен әлсіз қышқылдан түзілген тұз.
Бұл тұзды күшті негіз NаОН-пен әлсіз қышқыл, СН 3 СООН-дан түзілген деп қарастыруға болады. Алдыменен молекулалық тендеуін, сонан соң толық иондық теңдеуін жазамыз. Ең соңында қысқаша иондық теңдеуін көрсетеміз;
СН 3 СОО+ Nа + +Н 2 О=СН 3 СООН+NаОН
СН 3 СОО+Н 2 О-СН 3 СООН+ОН Реакция нәтижесінде әлсіз электролит СН 3 СООН түзіледі, ал ортада (ерітіндіде) гидроксил иондары көбейіп, ортаның қасиетін сілтілік етеді. рН>7
Демек, әлсіз қышқыл мен күшті негізден түзілген тұздың ерітіндісі сілтілік орта береді.
К 2 SО 3 +Н 2 О=КНSО 3 +КОН
КНSO 3 +Н 2 О=Н 2 SО 3 +КОН
2. Күшті қышқылмен әлсіз негізден түзілген тұз.
NH 4 CI+H 2 O=NH 4 OH+NCI
NH 4 + +CI - +H 2 O=NH 4 OH+H + CI -
NH 4 + +H 2 O=NH 4 OH+H + рН<7
азот қышқылы (2н; 1:1 және тығ. 1, 4), күкірт қышқылы (2н және тығ. 1, 84), тұз кышқылы (2н; 1:1 және тығ. 1, 19), сірке қышқылы (2н), натрий гидроксиді (2н), аммиак (2н), аммоний хлориді (қанық), аммоний сульфиді (0, 5н), калий иодиді (О. 1н), калий нитраты (0, 5н), нейтраль лакмус ерітіндісі, кадмий сульфаты (0. 5н), мырыш сульфаты (0. 5н), мырыш хлориді (0. 5н), кобальт нитраты (0. 5н), натрий карбонаты (2н), натрий ацетаты (2н), мыс сульфаты (2н), сынап хлориды (0, 5н), сынап нитраты (II) (2н), сынап нитраты
(I) (2н), күкіртсутек суы. Азот қышқылы (конц. тығ. 1, 4 және 2н), күкірт қышқылы (конц. тығ. 1, 84 және 2н), тұз қышқылы (конц. тығ. 1, 84 және 2н), натрий (40% және 2н), аммоний гидроксиді (25% және 2н), мыс (II) хлориді (0. 5н), мыс сульфаты (0. 5н), калий иодиді (О. 1н), глюкоза (10%), сынап
(II) нитраты (2н), калий роданиді (0. 5н), натрий карбонаты (2н), күкіртті қышқыл, крахмал клейстері, күміс нитраты (0, 1н), қалайы (II) хлориді (0, 5и), натрий бромиді (0, 5н), натрий хлориді (2н), натрий тиосульфаты (1н) .
2. 2 Күшті негізбен әлсіз қышқылдан түзілген тұз
Мыс (II) тұздың ерітіндісіне алдын ала үйкегіш қағазбен тазаланған және сумен жуылған темір пластинкасын салындар. Не байқалады? Ерітіндінің және металдың беті, түсі қалай өзгереді? Реакцияның теңдеуін жазыңдар, кестеде стандартты электродтық потенциал мәндерін жазып алыңдар да, салыстырыңдар. Қандай қорытынды жасауға болады?
Бес пробиркаға аздаған мөлшерде мыс жаңқаларын салыңдар және бірнеше тамшы қышқыл ерітінділерін қосыңдар; біріншісіне - конц. Н 2 SО 4 , екіншісіне - сұйытылған Н 2 SО 4 , үшіншісіне-конц. HNОз, төртіншісіне - сұйытылған НNОз, бесіншісіне - НСІ. Не байқалады? Ерітінділердің түсі қалай өзгереді? Барлық пробиркада реакция жүреді ме? Бөлініп шыққан газдардың ерекше иісін және түсін анықтаңдар. Реакциялардың теңдеулерін жазыңдар және коэффициенттерін қойыңдар. Осы реакцияларда мыс қандай қасиет көрсетеді?
а) мыс (II) сульфатының ерітіндісі мен сілтіні әрекеттестіріп мыстың (II) гидроксидін алыңдар. 1 үсін байқаңдар, реакцияның теңдеуін жазыңдар.
б) Пробирканы мыс гидроксидімен қыздырыңдар, тұнбаның түсі қалай өзгереді? Реакцияиың тендеуін жазыңдар.
а) Мыс (II) тұзының ерітінділерінде лакмус қағазы көмегімен реакцияның ортасын тексеріңдер. Гидролиз реакциясының теңдеуін жазыңдар.
б) Мыс (II) сульфатының ерітіндісіне натрий карбонаты ерітіндісін қосыңдар. Қандай өзгерістер байқалады? Аралас тұздар гидролизінің реакция теңдеуін жазыңдар.
Өте сұйытылған мыс (II) сульфатының ерітіндісіне аммиактың ерітіндісі түзілген тұнба ерігенше тамшылатып құйыңдар, қандай өзгеріс болады? Реакциялардың теңдеулерін жазыңдар. Түзілген комплексті қосылыстың диссоциациялану және тұрақсыздық константасының теңдеулерін жазыңдар. Комплексті ионның ішіндегі мыстың ионын қалай анықтауға болады?
Мыс (1) сульфатының ерітіндісіне КІ ерітіндісін күйыңдар. Тұнба түзіледі. Ерітіндінің бір бәлігіне крахмал ерітіндісін қосыңдар. Ерітіндінің түсі қалай өзгереді? Реакцияның теңдеуін жазыңдар.
Ерітіндінің екінші бөлігіне натрий сульфитінің ерітіндісін құйыңдар. Не байқалады? Реакцияның теңдеуін жазыңдар.
Ортаның қасиеті қышқылдық болады, себебі реакция нәтижесінде әлсіз негіз NН 4 ОН және күшті қышқыл пайда болады.
Zn(NO 3 ) 2 →ZnOHNO 3 →Zn(OH) 2
AI(СН 3 СОО) 3 +ЗН 2 О= ЗСН 3 СООН+А1(ОН) 3
Мұндай жағдайда ортаның қасиеті реакцияу нәтижесінде пайда болған қышқыл мен негіздің салыстырмалы күштеріне байланысты болады Мысалы: СН 3 СООН-күші А1(0Н) 3 күшінен артық Сондықтан, орта әлсіз қышқылдық қасиет береді.
А1 3+ +ЗСН 3 СОО+ЗН 2 О=ЗСН 3 СОО-ЗН + +А1(ОН) 3 ↓
А1 3+ +ЗН 2 О=Н + + А1(ОН) 3 ↓
(NH 4 ) 2 S= 2NН 4 ОН + Н 2 S
Егерде негіздің күші артық болса, өлсіз негіздік қасиет болар еді.
Қышқыл мен негіздің күштері тең болса нейтралды орта болады.
2. 3 Әлсіз негізбен қышқылдан түзілген тұз
Күшті қышқыл мен күшті негізден түзілген түздар
КС1+Н 2 О= КОН+НСІ
гидролизденбейді, орта нейтралды.
Гидролиз сатылып өтетін процесс
1. Nа 2 СО 3 +Н 2 О=Nа+ Н СО 3 +Nа + + ОН -
Nа + + СО 3 2- +Н 2 О=НСО 3 +Nа + +ОН-
СЩ 3 2- +Н 2 О=НСО 3 +ОН - рН>7.
2. SbС1 2 +Н 2 О= SbОНС1 2 +НС1
SbС1 2 +Н 2 О= Sb(ОН) С1 2 +НС1
Sb(ОН) 2 С1 ► SbОС1+Н 2 О
антимонил хлориді.
Гидролиз кейде аяғына дейін жүрмеуі мүмкін, ондайда аралық продуктілер (қосылыстар) тұрақты келеді. Мысалы:
Ғе(СН 3 СОО) 3 +Н 2 О →Ғе(СН 3 СОО) 2 +СН 3 ООН
Ғе(СН 3 СОО) 2 +Н 2 О → Ғе (ОН) 2 СН 3 СОО+СН 3 ООН
негіздік тұз, гидролиз осымен тоқталады.
2. 4 Әлсіз негізбен әлсіз қышқылдан түзілген тұз.
Гидролиз реакциясын тездету үшін температураны өсіреді немесе ерітіндіні сұйылтады. Кейде гидролиз өз бетімен тез жүріп, аяғына дейін жүреді. Мысалы;
Реакция нәтижесінде А1(0Н) 3 , СО 2 , Н 2 О түзіледі. Гидролиз реакциясының маңызы өте зор, оны химиялық зерттеулерде, ерітінділер даярлағанда, өндірісте еске алып отыру керек.
жоғары болады. Әдетте буффер ерітінділерді 0, 1 н ерітінділер әзірлейді.
Организмдегі ерітінділердің рН-ын реттеп тұратын қандағы ацетат, фосфат, карбонат буфферлері және амин қьшқылдары мен белоктар әсері деп білеміз.
Ал өсімдіктер топырақ рН-ы белгілі бір тұрақты шама болып өсіп жетіле алады. Мөселен, картоп - рН 4-8; қара бидай рН 4-7; бидай, бұршақ - рН 5-8; жоңышқа - рН 6-8, т. б, Өсімдік өсетін топырақ ерітіндісі де буфферлік қаспа көрсетеді. Әр жердің топырағының белгілі рН мәні болады Қышқылдығы жоғары топырақты әкпен өсіп оның рН-ын төмендетеді. Сілтілігі жоғары топырақты гипстейді.
Кейбір түздардың судағы ерітіндісінің ортасын анықтасақ оның не сілті не қышқыл екенін көруге болады. Мұның себебі тұз иондарының су молекуласымен әрекеттесуші іздеуіміз керек. Мысалы, аммоний хлоридін суда ерітсек, ол ерітіндінің диссоциацияланады.
NН 4 СІ→NН 4 + СІ-
Су молекуласы өте аз мөлшерде Н + жәие ОН иондарының береді:
Н 2 О→Н + + ОН-
Демек, NН 4 С1 судағы ерітіндісінде NН + 4 , СІ-, Н + және ОН иондары болады. Әр аттас иондар бір-бірімен әрекеттесуі мүмкін;
NН 4 + + ОН- МН 4 ОН әлсіз негіз
Н + және С1 - иондары өте ерімтал НСІ түзетіндіктен ерітінідіні иондар түрінде болады.
Бұдан NН 4 СІ суда еріп, су молекуласымен ион алмасып, нәтижесінде Н + ионы артық қалғанын, яғни ерітінді ортасы қышқыл екенін көреміз. Шынында, NН 4 С1 судағы ерітіндісі қышқыл ортаны көрсетеді.
Тұз иондарының полюсті су молекуласымен әлсіз электролиз түзіп әрекеттесуін тұз гидролизі дейді.
Гидролиз қайтымды процесс. Оған массаның әсер заңын пайдалнуға болады. Жоғарыда келтірілген мысал үшін жазылады:
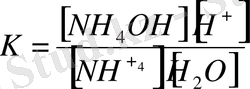
Судың концентрациясы [Н 2 0] тұрақты, сондықтан оны К-мен (біріктіріп жазамыз:
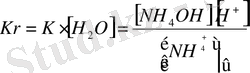
Мұнда К- гидролиз константасы.
Гидролизді сан жағынан гидролиз дәрежесі (һ) арқылы сиптауға болады. Гидролиз дәрежесі (һ) гадролизге ұшыраған молекула санының (п) жалпы еріген молекула санына (N) қатынасын көрсетеді.
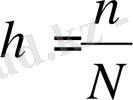
Гидролиз температураға және ерітінді концентрациясына тәуелді. Температура артқан сайын гидролиз дәрежесі де артады. Енді концентрациясы неғұрлым аз болса, гидролиз соғұрлым жақсы болады. Демек, гадролиз жақсы жүру үшін температура ары, ерітінді сұйық болуы тиіс.
Енді тұздың гидролиз жүретін жағдайларын қарастырайық. келген тұзды негіз бен қышқыл әрекеттесуінен түзілген өнім қарастыруға болады. Осыған орай тұзды 4 типі болады. осы типтер гадролизі қалай жүретінін қарастырайық.
1. Әлсіз қышқыл мен күшті негізден түзілген түз гидролизі. қышқыл қалдығы судан сутегі ионын қосып алып әлсіз тролит түзеді.
Гидролиз жүреді, нәтижесінде ОН"" иондары ерітіндіде пайда болады. Ерітінді ортасы сілтілік рН>7.
2. Күшті қышқыл мен әлсіз негізден түзілген тұз гидролизі катион бойынша жүреді. Катион су молекуласының ОН ионын
байланыстырып әлсіз электролит түзеді. Ерітіндіде арты иондары пайда болады. Ерітінді ортасы қышқыл рН<7. ретінде NН 4 С1 тұзын алуға болады:
иондық т. б
3. Әлсіз қышқыл және әлсіз негізден түзілген тұз гидрол катион және анион бойынша жүреді. Мысал ретінде СН 3 СООNН 4 тұзын алайық.
СН 3 СООNН 4 →СН 3 СОО - +NН + 4
СН 3 СОО - +Nа + 4 +НОН→СН 3 СООН+NН 4 ОН
Гидролиз нәтижесінде әлсіз қышқыл және әлсіз негіз түзеледі Ешқандай Н + не ОН иондары артық емес. Ерітінді ортасы түзілген әлсіз қышқыл мен әлсіз негіздің диссоциасы константасына тәуелді, Егер әлсіз қышқыл диссоциациясы константасы әлсіз негіздікінен көп болса, ерітінді қышқыл, әлсіз негіз диссоциация константасы әлсіз қышқылдікінен көп болса, онда ерітінді негіздік орта көрсетеді. Екеуінің де диссодиация константасы бірдей болса, ерітінді бейтарап болады.
4. Күшті қышқыл мен күшті негізден түзілгсн тұз гидролизм ұшырамайды. Ерітінді ортасы бейтарап рН = 7 болады. Мысалы ретінде NаСІ тұзының суда еруін алайық:
NаСІ+Н 2 О→NаОН+НСІ
Nа + +СІ - +НОН→Nа + +ОН - +Н + +СІ -
НОН→ОН - +Н +
Бұл теңдеудің сол жағында әлсіз электролит су Н 2 О бар, иондар арасында реакция әлсіз электролит түзілетін жаққа жүретіні белгілі. Сондықтан бұл жағдайда тұз гидроллит ұшырымайды, тепе-тендік сол жаққа ығысқан.
Гидролиз қайтымды процесс болғандықтан оған массалар әсер заңын қолданып қажет жаққа тепе-тендікті ығыстыруға болады: Мәселен (NН 4 ) 2 S тұзының гидролизі мына теңдеумен өрнектеледі:
(NН 4 ) 2 S+HOH→NH 4 HS+NH 4 OH
Егер гидролиз процесін тежеу қажет болса, ерітіндіге реакция өнімінін бірін қосады (NН 4 ОН) . Сонда Ле-Шателье принципі бойынша тепе-теңдік реакцияға кіретін зат жаққа (NН 4 ) 2 S ығысады. Гидролиздің осы қасиетін химиялық анализде көп пайдаланады. Кейде гидролиз нәтижесінде түзілген өнімдер негізін не газ тұнба болып реакциядан бөлінеді. Бұл кезде гидролиз қайтымсыз бір-бағытта жүруі мүмкін. Онда тепе-тендік орнына теңдік белгісін қою керек:
А1 2 S 3 + 6Н 2 О = 2А1(ОН) 3 ↓ +ЗН 2 S↑
Гидролиздің теңдеуін құруды әлсіз ионның сумен әрекеттесуінен бастап қысқаша иондық түрден бастайды. Содан иондық, молекулалық теңдеуге көшеді.
Көп негізді қышқылдан немесе көп қышқылды негізден түзелген тұз гидролизі сатылы жүреді. Мысалы, Nа 2 СО 3 тұзының гидролизі анион арқылы СО 3 2 жүреді де алдымен судың бір молекуласымен әрекеттесіп қышқыл анион түзіледі. Содан соң кіші сатыда ол тағы су молекуласымен байланысып әлсіз қышқыл түзеді.
І. Бірінші саты:
а) қысқаша иондық теңцеуі
СО 3 2 + НОН→НСО 3 - + ОН- Р н>7
б) иондық түрде
2Nа - + СО 2- 3 + НОН→Nа + + Н СОз + Nа + +ОН
в) молекулалық түрде
Nа 2 СО 3 + НОН→NаНСО 3 +NаОН
Екінші саты:
а) НСО - 3 +НОН→Н 2 СО 3 +ОН
б) Nа + +НСО 3 +НОН→Н 2 СО 3 +Nа + +ОН -
в) NаНСО 3 +Н 0Н→Н 2 СО 3 + Nа + ОН
Әдетте, гидролиздің бірінші сатысы жүреді. Ал екінші саты тек ө те сұйытылған кезде немесе қыздырғанда ғана жүреді.
Көп қышқылды әлсіз негізден түзілген тұзға мысал ретінде( СиС1 2 -ні алуға болады. Бұл жағдайда гидролиз катион арқылы екі сатыда жүреді.
I. Бірінші саты:
а) қысқаша иондык түрде
Си 2+ +НОН→СиОН + +Н + +СІ + рН<7
б) иондық түрде
Си 2+ + 2С1→НОН→СиОН + +СІ - +Н + +СІ -
в) молекулалық түрде
Н + рН<7
СиСІ 2 + Н 2 О СиОНСІ + НСІ
II. Екінші саты:
а) СиОН + + НОН→Си(ОН) 2 +Н +
б) СиОН + + С1-+ НОН→Си(ОН) 2 +Н + +СІ -
в) СиОНСІ + Н 2 О→Си(ОН) 2 + НСІ
Іс жүзінде екінші саты бойынша гидролиз жүрмейді.
Тұздар гидролизі - жалпы гидролиз ұғымынын бір мысалы ғана, Гидролиз деп - әр түрлі заттардың сумен алмасып ыдырауын айтады. Яғни гадролизге тек тұздар ғана емес көптеті органикалық заттар - күрделі эфирлер, майлар, углеводтар, белоктар ұшырайды. Ал ағаш гидролизі арқасында бірталай бағалы заттар - этил спирті, белоктық ашытқыштар, глюкоза, қатты көміртегі оксиді, фурфурол, скипидар, метил спирп және т. б. алынады. Тау жыныстары гидролиз нәтижесіндс ыдырайды Тұз гидролизін суды тазарту және оның кермектігін азайту үшін пайдаланады. Тірі организмде полисахаридтер, белоктар т. б органикалық заттар гидролизі үздіксіз жүріп жатады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz