Булану, қаныққан бу және ауа ылғалдылығы; беткі керілу мен капиллярлық құбылыстар; қатты денелердің құрылымы мен деформациялары


Газ тектес, сұйық және қатты денелердiң қасиеттерi
Қаныққан және қанықпаған булар
Жылулық қозғалыс әсерiнен пайда болатын кинетикалық энергияның артықтығынан қашанда молекуланың жеке бөлшектерiнiң сұйық бетiнен бөлiнiп шыға алады. Заттың сұйық күйден газ күйiне өту процесiн буға айналу деп атайды. Неғұрлым сұйықтың температурасы жоғары болса, соғұрлым сұйық тезiрек буға айналады .
Буға айналудың екi түрi бар: булану және қайнау . Кез келген температурада және тек сұйық бетiнен шығып бу күйiне айналуды - булану деп атайды. Бу - буланудың әсерiнен пайда болатын газ. Булану барысында сұйық салқындайды.
Буланған молекулалардың белгiлi бiр бөлiгi хаостық (ретсiз) қозғалыс жасай отырып қайтадан сұйық бетiне түсуi және оның молекулаларына айналуы керек. Соныменен, булану процессiмен қатар бiрмезгiлде конденсация деп аталатын керi процесс те жүредi.
Конденсация - бұл заттың салқындау немесе сығылуының салдарынан газ тектес күйден сұйық күйге айналу процессi. Сұйық бетiндегi будың қысымы неғұрлым жоғары болса , сол температурада конденсацияға ұшырайтын молекулалар саны да соғұрлым көп болады.
Бетi ашық ыдыстағы сұйықтың булану процесi конденсация процесiнен басым болып келедi. Ал бетi жабық ыдыста сұйық пен будың арасында, булану процесi мен конденсация процесстерi бiрiн-бiрi толықтыратындай, динамикалық тепе-теңдiк орнайды. Өз сұйығымен динамикалық тепе-теңдiкте болатын буды қаныққан бу деп атайды.
Температура тұрақты болған жағдайда қаныққан будың қысымы оның алатын көлемiне байланысты болмайды.
Егер сұйықтың булануы конденсациядан басым болса немесе сұйық толық буланып кетсе, онда оның устiндегi буды қанықпаған бу деп атайды. Буларға, тек бу қанықпай тұрған жағдайда ғана , идеалды газдар үшiн орныққан заңдарды қолдануға болады.
§ 2. 2 Ауаның салыстырмалы және абсолюттi ылғалдылығы. Шық нүктесi
Жер атмосферасындағы су буының бар екендiгiн сипаттайтын шама ылғалдылық деп аталады.

Берiлген жағдайдағы 1 м 3 ауа құрамындағы су буларының массасы ауаның абсолюттiк ылғалдылығы f деп аталады (2. 1, 2. 2 - суреттер) . Әдетте оны CИ өлшем бiрлiк жүйесiнде емес г/м 3 бiрлiгiмен өрнектейдi:
f = ρ бу (г/м 3 ) ≈ P(мм. сынап бағанасы бойынша) .

Бұл жерде су буының қысымы деп оның үлестiк қысымын айтады, яғни атмосфераны құрайтын - азот, оттегi және т. б. компоненттерi жоқ, болғандығы су буының жасайтын қысымы.
Ауаның салыстырмалы ылғалдылығы φ деп ауадағы су буының қысымы p -ның атмосфералық температурадағы судың қаныққан буының қысымы p k - ға қатынасына тең шаманы айтады.
φ = (p/p k ) · 100 % (2. 1)
p k шамасының мәндерi белгiлi сәйкес кестелерден анықталады. Ауаның температурасы төмендеген сайын оның салыстырмалы ылғалдылығы артады , себебi неғұрлым ауаның температурасы төмен болса, соғұрлым су буы қанығуға жақындай түседi.
Салыстырмалы ылғалдықты өлшеу үшiн арнайы психрометр деп аталатын прибор қолданылады.
Салқындату барысында (процесiнде) бұрын қанықпаған бу қаныққан буға айналатын температура шық нүктесi деп аталады. Шық нүктесiне тең температурада атмосферадағы су буы конденсациялана бастайды. Тұман пайда болып, шық түседi, қатты дене беттерi терлей бастайды.
§ 2. 3 Қаныққан бу қысымының температураға тәуелдiлiгi. Қайнау
Көлем тұрақты болған жағдайда қаныққан будың қысымы температураға өте қатты тәуелдi болады , сондықтан Шарль заңын қаныққан буға қолдануға болмайды . Температура жоғарлаған сайын, будың конденсациялануына қарағанда, сұйық тезiрек буланады. Қысымның күрт өсуiне негiзiнен будың тығыздығының ұлғаюы тiкелей әсерiн тигiзедi.
Қайнау - бұл тек қана ашық беттегi сұйықтың интенсивтi булануы емес, сонымен қатар бу көпiршiктерiн түзетiн қуыс көлемiндегi сұйықтың да интенсивтi булануы.
Егер сұйық бiрқалыпты қыздырылмаған болса, онда су көпiршiктерi қалқып шыққан кезде олардың iшiндегi қысым бу конденсациясының есебiнен азаяды да, көпiршiктер жарылып кетедi. Ал сұйық жеткiлiктi қыздырылған болса, онда көпiршiктер жарылуын тоқтатады да, сұйық бетiне еркiн қалқып шығады. Сұйық қайнайды (2. 3 - сурет) .
Көпiршiк iшiндегi қысым үш қосылғыш арқылы анықталады: p = p 0 + ρgh + 2σ/r , мұндағы p 0 - сыртқы қысым , ρgh - биiктiгi h болатын сұйықтың жоғарғы қабаттарының гидростатикалық қысымы , 2σ/r - радиусы r болатын көпiршiк бетiнiң майысуына(қисаюына) байланысты өзгеретiн қысым (§2. 4 - қараңыз), ρ және σ - сұйықтың тығыздығы және беттiк керiлу коэффициентi (§ 2. 4 - қараңыз) . Мына төмендегi шарт орындалған кезде сұйық қайнай бастайды .
p k ≥ p 0 +ρgh+2σ/r (2. 2)

мұндағы p k - қаныққан будың қысымы . Әдетте 2σ/r << p 0 және ρgh << p 0 . Бұдан, былай болатындығы шығады:
p k ≥ p 0 .
Сонымен, барлық сұйықтың температурасы бiрдей, ал қаныққан будың қысымы әдетте оның бетiне түсiрiлген сыртқы қысымға тең немесе сол қысымнан сәл артық болған жағдайда сұйық қайнай бастайды.
Сұйықтың қаныққан буының қысымы сыртқы қысымға тең болғандағы сұйықтың температурасы қайнау температурасы деп аталады. Атмосфералық қысымның қалыпты жағдайындағы сұйықтың қайнау температурасы қайнау нүктесi деп аталады.
Су бетiне түсiрiлген сыртқы қысымның өсуiмен бiрге қайнау температурасы жоғарлайды да, қысымның азаюына байланысты температурасы төмендейдi . Барлық басқа шарттары бiрдей болған жағдайда да, әр түрлi сұйықтардың қайнау температуралары әртүрлi болып келедi (2. 3 - сурет) .
§ 2. 4 Беттiк керiлу. Беттiк қабаттың молекулалық картинасы
«Сұйық - газ» деп бөлiнетiн шекаралық қабаты бар болғанда, ашық беттегi молекулалар, сұйықтың iшiндегi молекулалар тарапынан, өте күштi төменге қарай тартылыс күшiне ұшырайды және де газдың молекулалары тарапынан аз ғана жоғары тартылысқа ұшырайды. Сол себептен шекаралық қабаттағы молекулалар сұйықтың iшкi жағына қарай тартылады . Олардың ашық беттегi саны азаяды да, беттiң ауданы да барынша кiшiрейедi. Осының әсерiнен қисайған беттiк қабат , жазық қабатқа қарағанда, сұйыққа молекулалық қысым деп аталатын қосымша қысым түсiредi.
Сұйықтың бетiн изотермалық түрде үлкейту үшiн, артық молекулалық қысымға төтеп берердей белгiлi бiр жұмыс жасау керек . Бұл жұмыс таңба жағынан терiс және жүйенiң потенциалдық энергиясының өзгеруiне тең:
A = - (W s -W v ) = ΔW . (2. 3)
Мұндағы W s және W v дегенiмiз сәйкес беттiк қабаттың молекулаларының және де сұйық iшiндегi молекулалардың потенциалдық энергиялары . A < 0, болғандықтан, ΔW > 0 болады және W s > W v . Бұдан, сұйық бетiн түзейтiн молекулалардың, сұйық көлемi iшiндегi басқа молекулаларға қарағанда потенциалдық энергиясының артық екендiгi шығады.

Сұйықтың ашық бетiндегi молекулалардың артық потенциалдық энергиясы беттiк энергия деп аталады. Егер денеге сыртқы күштер әсер етпейтiн болса, онда беттiк энергияның мәнi өте аз болады және сонымен бiрге сол беттiң ауданы да өте кiшкентай болады (2. 4-сурет) .
Бiрлiк ауданның беттiк энергиясы σ - меншiктi беттiк энергия деп аталады:
σ = W/S ,
мұндағы W - S ауданға жинақталған беттiк энергия. СИ өлшем бiрлiк жүйесiнде меншiктi беттiк энергия Дж/м 2 - пен өлшенедi.
Беттiк қабаттың бөлшектерi, сұйық бетiне жанама жазықтықта жатқан және сұйық бетiнiң ауданын мейлiнше кiшiрейтуге бағытталған, (негiзделген) күштiң әсерiне ұшырайды. Бұл күштер - беттiк керiлу күштерi F деп аталады.
Оларды сандық жағынан бағалау үшiн беттiк керiлу коэффициентi деген ұғым енгiзiледi. Бұл коэффициент сұйықтың бос бетiнiң ауданын бiрлiкке изотермалық түрде арттыру үшiн жасалатын жұмыс ретiнде анықталады.
Жоғарыдағы айтылғанарды ескерсек: ΔW = -A =σΔS . Бұдан
σ = - A/ΔS ( A <0) екендiгi шығады. (2. 4)
Егер сұйықтың ашық бетi тұйық сызықпен шектелген болса, онда бұл сызық - жұғылу периметрi деп аталады. Ондай беттер үшiн σ = F / L , СИ өлшем бiрлiк жүйесiнде σ шамасының өлшем бiрлiгi Н/м .
Беттiк керiлу коэффициентi меншiктi беттiк энергияның мағынасын бередi: 1 Н/м = 1 Дж/м 2 . Беттiк күштi серпiмдiлiк күшiмен шатастыруға болмайды.
§ 2. 5 Қыл түтiктiк құбылыстар. Қыл түтiктегi сұйықтың көтерiлу деңгейi
Қатты дене бетiмен үлдiр секiлдi ағып-жайылатын сұйық жұғатын сұйық деп аталады, ал тамшыға айналып, жиылып тұратын сұйық жұқпайтын сұйық деп аталады. Жұғу және жұқпау эффектерi қатты қабырға маңындағы ашық беттердiң қисаюымен бiрлесiп (қатар) жүредi. Өте тар түтiкшелер - капиллярлар қарастырылған жағдайда, ондай қисайған беттер мениск деп аталады.


Жұғу құбылысы, қатты дене бетiне және менискке олардың қиылысу нүктелерiнде жүргiзiлген жанамалар арасындағы шектiк бұрыш δ арқылы сипатталады. Ол сұйықтың iшiнен бастап өлшенедi. Жұғатын сұйықтар үшiн шектiк бұрыш сүйiр болып келедi: 0 ≤ δ < π /2 (2. 5 - сурет), ал жұқпайтын сұйықтар үшiн - ол доғал: π /2 < δ ≤ π (2. 6 - сурет) . δ = 0 жағдайы идеалды жұғуға, ал δ = π жағдайы идеалды жұқпауға сәйкес.
Ойыс бетпен шектелген сұйықтың қысымы қоршаған орта қысымынан аз болып келедi. Сол себептен қыл түтiктегi жұғатын сұйықтың бiр бөлiгi, көтерiлген сұйық деңгейiнiң гидростатикалық қысымы осы қысымдардың айырымын компенсациялағанға шейiн, сырттан сорыла беретiн болады. Керiсiнше, дөңес бет астындағы сұйықтың қысымы, оның үстiндегi қоршаған орта қысымынан әлде қайда үлкен. Егер қыл түтiктердi жұқпайтын сұйығы бар кең ыдысқа салып қойса, онда оның (сұйықтың) қыл түтiктегi деңгейi ыдыстағы деңгейiнен төмен болып орналасады.
2. 1. - суретте келтiрiлгендей, қыл түтiктегi сұйықтың көтерiлу (түсу) деңгейiн h - ты анықтайық. Идеалды жұғу (жұқпау) кезiнде қыл түтiкше iшiндегi менисктiң пiшiнi дұрыс жартылай сфера тәрiздес және олардың түсiретiн қосымша қысымы p м мынаған тең:
p м = 2 σ/r , (2. 5)
σ - сұйықтың беттiк керiлу коэффициентi, r - қыл түтiк радиусы, p м >0 болса мениск дөңес болады, p м <0 -мениск ойыс болады.
p a - қоршаған ортаның қысымы болсын. Сонда мениск астындағы сұйықтың қысымы мынаған тең болады: p a - 2 σ/r . Кең ыдыстың ашық бетi деңгейiнде бұл қысымға, тығыздығы ρ сұйықтың көтерiлу деңгейiнiң F A салмағы әсерiнен түсiрiлетiн гидростатикалық қысымы p ст қосылады:
p ст =F A /S = mg /πr 2 = π r 2 h · ρg/ π r 2 = ρgh .
Тепе-теңдiк жағдайы орныққандықтан, астыңғы жағынан да, үстiңгi жағынан да сол деңгейге бiрдей қысым әсер етедi. Соның салдарынан
p a - 2σ/r + ρgh = p a .
Бұдан
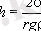 (2. 6)
(2. 6)
екендiгi шығады.
§ 2. 6 Кристалдық және аморфтық денелердiң құрылысы. Анизотропия

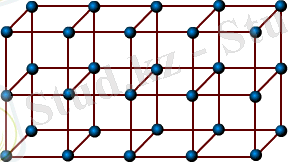
Атомдары немесе молекулалары реттелiп орналасқан және периодты түрде қайталанып тұратын iшкi структурасын түзетiн қатты денелер кристаллдар деп аталады. Кристалдардың қырлары әрқашан жазық және дұрыс геометриялық пiшiндi болып келедi (2. 7, 2. 8 - суреттер) . Бөлшектердiң орналасуының салыстырмалы түрде орныққан скелетi кристалдық торлар деп аталады, ал сол торлардың орналасқан орындары түйiндер деп аталады (2. 9 - сурет) .

Кристалдардың сыртқы пiшiнiнiң дұрыстығы - олардың реттелген құрылысының бiр ғана салдары емес. Олардың ең басты ерекшелiгi кристалдың физикалық қасиеттерiнiң ондағы таңдалған бағытына байланыстылығында. Кристалдардың бұл қасиетi анизотропия деп аталады.
Барлық кристалды денелер анизотропты болып келедi. Анизотропияның бiр себебi - кристалдық тор түйiндерiнiң тығыздығы әр түрлi бағытта әр түрлi болған жағдайдағы, бөлшектердiң дұрыс ретпен орналасуы. Осы бағыттардағы бөлшектердiң өзара әсерi де бiрдей болмайды. Бұдан, әр түрлi бағыттардағы кисталдардың механикалық берiктiгi әр түрлi екендiгi шығады.
Көптеген кристалдар жылу мен электр тогын әр бағытта әр-түрлi өткiзедi. Кристаллдың оптикалық қасиеттерi де оның бағытына байланысты болуы мүмкiн.
Белгiлi бiр температураға дейiн қыздырғанда (әр заттың өз температурасы бар ) зат қатты кристалдық күйден сұйық күйге өтедi. Осы процесс балқу деп аталады, ал балқуға ұшырататын температура балқу температурасы деп аталады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz