Нитроқосылыстардың химиясы: құрылымы, синтезі, қасиеттері және қолданылуы


Мазмұны
Кіріспе . . . 3
І. Тарау Нитроқосылыстар . . . 4
1. 1. Нитроқосылыстар изомериясы, номенклатурасы . . . 4
1. 2. Алыну жолдары . . . 4
1. 3. Физикалық қасиеттері . . . 9
1. 4. Химиялық қасиеттері . . . 11
1. 5. Карбонилді қосылыстармен конденсациясы . . . 18
1. 6. Қолданылуы . . . 20
ІІ тарау. Ароматты нитроқосылыстар . . . 27
2. 1. Ядросында нитротобы бар нитроқосылыстар . . . 27
2. 1. 1. Алу тәсілдері . . . 27
2. 1. 2. Физикалық қасиеттері . . . 30
2. 1. 3. Химиялық қасиеттері . . . 30
2. 1. 4. Жеке өкілдері . . . 39
2. 2. Бүйір тізбегінде нитротобы бар нитроқосылыстар . . . 43
2. 2. 1. Алу тәсілдері . . . 43
2. 2. 2. Физикалық қасиеттері . . . 49
2. 2. 3. Химиялық қасиеттері . . . 49
Қорытынды . . . 51
Пайдаланылған әдебиеттер . . . 52
Ұсыныстар . . . 53
Кіріспе
Құрамында азот қышқылының қалдығы функционал NО 2 тобы бар органиклық қосылыстарды нитроқосылыстар дейді. Олар табиғатта кездеспейді. Бірақ күрделі органикалық синтезде шикізат ретінде кеңінен қолданылады. Ондағы нитро топты органикалық қосылыстарға оңай енгізуге болады, ал содан соң оны кез келген басқа функционалды топтарға ауыстыру жеңіл. Сөйтіп, нитроқосылыстар органикалық синтездің мүмкіншіліктерін көбейтуге көмектеседі.
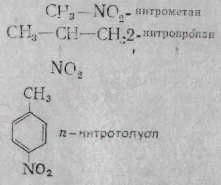
Нитрокосылыстардың аталуы өздеріне сәйкес көмірсутекті қосылыстарға негізделеді:
Алифатты қатардағы нитроқосылыстарды өздеріне сәйкес басқа кластағы қосылыстар мен молекула салмағына орай салыстырғанда, олардың қайнау температуралары біршама жоғары айталық, нитрометан 101°С-та, ннтроэтан 114°С қайнайды. Ароматты нитротуындылар одан да жоғары температурада қайнайды. Нитробензол 20°С-та, о -нитротолуол 222° С-та қайнайды. Құрамында бірнеше нитро тобы бар қосылыстар қатты болады және олар қопарғыш заттар ретінде жиі қолданылады.
І. Тарау Нитроқосылыстар
1. 1. Нитроқосылыстар изомериясы, номенклатурасы
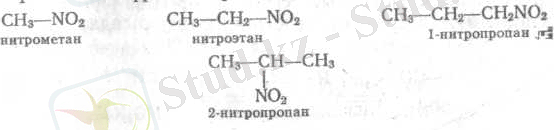
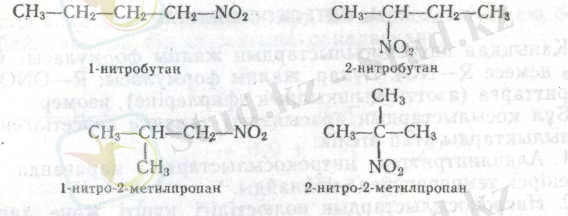
Нитроқосылыстардың изомериясы көпшілігі басқа алмасқан көмірсутектердегі (спирттер, галоген-алкилдер және т. б. ) тәрізді, пропан туындыларынан басталады. Бұлар бірінші, екінші және үшінші нитроқосылыстар деп топқа бөлінеді: R-CH 2 -NO 2 , R 2 CH-NO 2 және R 3 C-NO 2 . Нитроқосылыстар әдетте алдына нитро деген сөз қосылып көмірсутектін, атымен аталады. Систематикалық номенклатура бойынша цифрмен нитротоптың тұратын орны көрсетіледі.
1. 2. Алыну жолдары.
Өндірісте нитроқосылысты негізінде алкандарды тікелей нитрлеу арқылы алады. Ал, қалған кейбір әдістері мыналар:
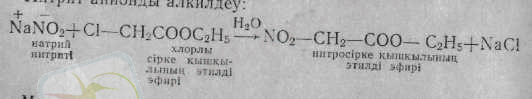
Нитрит-анионды алкилдеу:
Малон қышқылы сияқты, нитросірке қышқылы да оп-оңай СО 2 -ні бөледі. Хлорлы сірке қышқылының эфирін, оның натрий тұзымен алмастырса, нитрометан шығады:
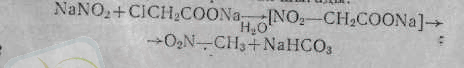
Галогенді алкилдер хлорлы сірке қышқылынақ әлсіз де, активсіздеу келеді. Егер натрий нитритінің орнына күміс нитритін галогенді алкил алса, ерімейтін күміс тұзының тұнбасы шөккендіктен реакция соңына дейін жүреді:
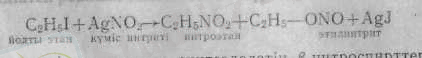
Алкендерді нитрлегенде синтезделетін β-нитроспирттерді судандырғанда (дегидратациялағанда) нитроолефиндер алынады:
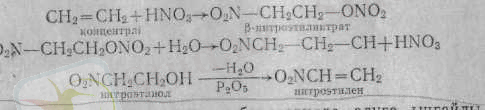

КоноваловАлександр Иванович
А. И. Коновалов (30. 01. 1934 ж) - химик, академик.
1956 ж Казан университетінің химия факультетін үздік бітіріп, 1963 жылы кандидаттық диссертацияны, 1974 жылы докторлық диссертацияны қорғады. 1992 ж. РҒА мүшесі (академик) ретінде А. И. Коновалов сайланды, 1991 жылдан - ол Татарстан ғылым Академиясының академигі, 1997 жылдан - осы Академияның вице - президенті.
Коноваловтың қанықпаған жүйенің реакциялық қабілеті, әсіресе циклді қосып алу реакцияларын оқу бойынша фундаментальді жұмыстары кең танымал. Оның басшылығымен термохимиялық мәліметке негізделген органикалық қосылыстардың сольватталуының әмбебап әдістері табылды. 1987ж осы зерттеу мемлекет жүлдемен белгіленген. Органикалық қосылыстардың қышқылдығын зерттеу нәтижелері, әртүрлі ортада қышқылдылықты анықтауға әмбебап әдістерін жасауға негіз болған.
Коновалов өз жұмыстарымен бірге супромолекулярлы химия облысындағы зерттеулері сәтті жүргізуде - каликсарендер (олардың қатарында құрамында фосфоры бар) негізінде құрылымдар дизайны жасалған. Олар әртүрлі типтегі органикалық молекулалар мен иондардың рецептрлі қабілетті.
Коновалов атымен өндірілетін табиғи шикізаттар химиясынан барлық дерлік жұмыстары байланысқан. Ол өсімдіктер қатарынан физиологиялық белсенді заттардың бөлінуінің технологиясы мен оның құрамын зерттеген. (көбінесе аморант, люпин, стевия) . 1990 жылдан бастап қазіргі уақытта Коновалов А. Е. Арбузов атындағы органикалық, физикалық химия институтының, РҒА Қазан ғылыми орталығының директоры .
Коновалов шәкірттерінің 4ғылым докторы, 30дан асасы ғылым кандидаты. Басылымдар жалпы саны - 400.
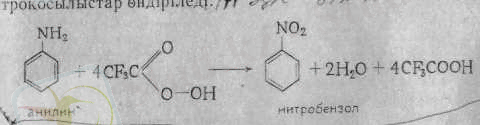
Ароматты нитроқосылысты лабораторияда алуға ыңғайлы әдістін бірі - ароматты аминдерді қышқылмен тотықтыру. Мұны кері жүргізуге де болады. Яғни ароматты нитроқосылыстарды тотьтқсыздандыру арқылы аминдер алады. Бір-біріне оңай түрленетін осы синтез арқылы көптеген ароматты аминдер мен нитроқосылыстар өндіріледі.
1. 3. Физикалық қасиеттері
Май қатарының нитроқосылыстары - жағымды иісті сұйық заттар, ыдырамай тұрғанда айдалып шығарылады; суда аз ериді, улы, металдарды химиялық бүлдірмейді, судағы ерітіндісінің реакциясы нейтрал келеді. Көміртек атомдарының саны 4-тен кем болса қосылыстың тығыздығы 1-ден ауыр, ал егер 4-тен немесе одан көп болса 1-ден жеңіл келеді.
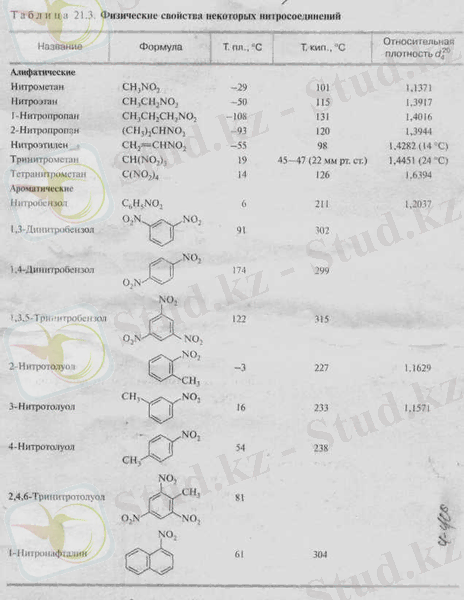
1. 4. Химиялық қасиеттері.
Ннтроқосылыстардың химиялық қасиеті, ондағы нитро топтағы бес валентті азоттың табиғи ерекшелігіне байланысты. Нитроқосылыстардың классикалық формуласы төмендегідей өрнектеледі:
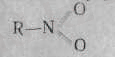
Енді формуладағы азотқа келсек, ол бес валентті. Ол үшін оның он электроны болуы керек. Бірақ азот Менделеев таблицасындағы екінші периодтың элементі. Оның ең сыртқы электрон қабығы тұрақты инертті газ түріне жету үшін, оғаи электрон қажет. Демек, оны дұрыстап өрнектеу үшін азоттың оттекпен бір байланысын еселенген, ал екінші байланысын семиполярлы байланыспен өрнектеген жөн, яғни азот бөлінбеген қос электронын оттскке береді:
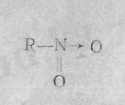
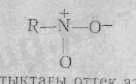
Семиполярлы байланыстың пайда болуы азотта оң, оттекте теріс зарядтың болуына әкеп соғады:
Шын мәнісінде нитрототықтағы оттек атомдарының екеуі де бірдей тең валентті. Оны тепе-теңдік жағдайда көру үшін, былай да өрнектеуге болады:
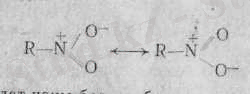
Бұл жай ацилат-ионы бар карбон қышқылдарының қатарында да байқалады:
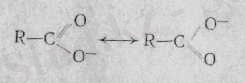
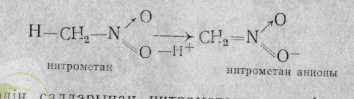
Ацилат-ионынан нитроқосылыстардың айырмашылығы, ондағы орталық азот атомы оң зарядталған. Од заряд -жағдайдағы көрші сутек атомына әсер етеді. Мұның салдарынан нитро топта аса күшті индуктивті және қабысу әсерлері пайда болады. Бұл нитро топты тұрақтандырады:
Бұл екі әсердің салдарынан нитрометанға кушті кышкылдық қасиет тән болады, ол тіпті сілтініи судагы әлсіз ерітіндісімен де тұз құрайды.
Оны қышқылмен өңдегенде, ол әуелі нитроалкандарға изомерлі ациннтроқосылысын береді. Ол тұрақты нитро түрмен тепе-теңдікте болады.
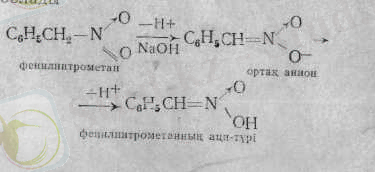
Құрамында қозғалғыш -жағдайдағы сутек бар біріншілік және екіншілік нитроқосылыстар оксоқосылыстармен қосылып, конденсациялану реакциясына түседі.
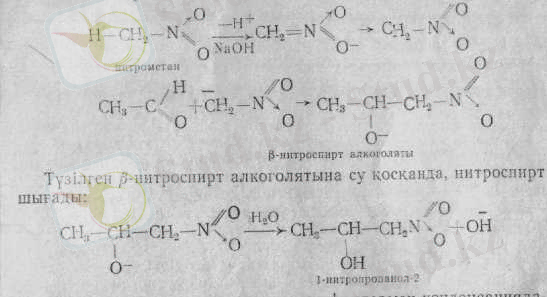
Нитроқосылыстар альдегидтер және кетондармен әрекеттескенде β-нитроспирттер құралады. Бұл рсакцияларда нитрокосылыс анионы карбений анионы іспеттес әрекеттеседі:
Нитрокосылыстар активтелген олефиндермен конденсацияланады. Оны Михаэл реакциясы деп те атайды. Мысалы, активтелген акрил қышқылының туындысын алайық:
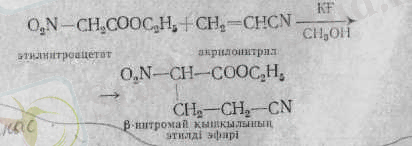
Нитрокосылыстардағы активті сутек атомы негіздердің қатысуымен галогендерде алмасады. Бұл реакция көмегімен біріншілік нитроқосылыстарды екіншіліктен айыруға болады.
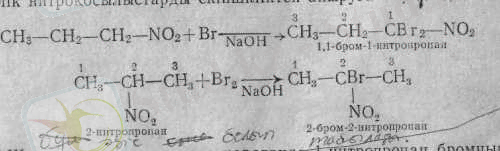
Жоғарыдаға теңдеулерге-қарағанда нитропропан бромның екі атомын, ал оның изомері 2-нитропропан бромның бір атомын қосады.
Нитротопқа 2-жағдайда орналасқан активті сутек атомы біріншілік нитроқосылыстарға азотты қышқылы әсер еткенде нитрозо топқа алмасып, нитрол қышқылдарын түзеді.
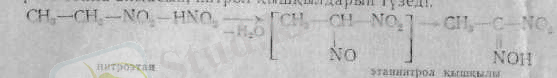
Ал екіншілік нитроқосылысты алсақ, мұндай реакция нәтжесінде псевдонитрол түзіледі:
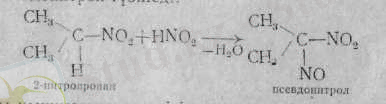
Азотты қышқылмен жүргізілген реакциялар біріншілік және екіншілік нитроқосылыстарды бір-бірінен ажыратуға көмектеседі. Нитроқосылыстардың маңызды реакцияларының қатарына оларды тотықсыздандыру реакциясы жатады. Бұл реакцияны жүргізу жағдайына байланысты әр түрлі азоторганикалық қосылыстар алуға болады.
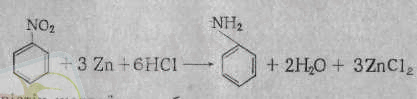
Нитротоптарды толық тотықсыздандыру оларды амин тобына айналдыруға мүмкіндік туғызады. Әсіресе, бұл реакция ароматты қосылыстар үшін маңызды. Онымен анилин және оның туындылары синтезделеді. Бұл реакцияны көрнекті орыс химигі Н. Н. Зинин ашқан:
Өндірістік жағдайларда бұл реакция үшін мырыштың opна арзандау шойын ұнтағы (үгіндісі) қолданылады. Соңғы кезде бұл әдіс өзгеріп, никель, палладий немесе мыс сияқты катализаторлар көмегімен жүргізіледі.
 Николай Николаевич Зинин
Николай Николаевич Зинин
(1812-1880)
Қазан университетінің, кейіннен Петербургтегі Медицина-хирургия академиясының профессоры. Академик Нитробензолдың анилинге тотықсыздану реакциясын ашты. Көптеген жаңа органикалық заттарды - нитроқосылыстардың тотықсыздану өнімдерін синтездеді. «Егер Зинин нитробензолды анилинге айналдырудан басқа ешнәрсе істемесе де, оның есімі химия тарихына алтын эріптермен жа-зыпған болар еді», - деп айтты замандастарының бірі. Қазан органик-химиктерінің мектебінің негізін қалады. А. М. Бутлеров оның шәкірті және Қазан университетінің химия кафедрасындағы ізбасары болды.
Тотықсыздандырғыш ретінде Зинин- алғашқы кезде күкіртті сутекті алған. Қазір оны қолданбайды. Дегенмен, ароматты сақинада бірнеше нитро топ болып, олардың тек біреуін ғана аминге айналдыру керек болса, әлі де болса, сол күкіртті сутекті және оның тұздарын пайдаланады. Егер екі нитро тобы бар, мысалы, м -динитробензолға, біреуіне ғана жететіндей, яғни мөлшері есептеулі Н 2 жіберсе, тек бір ғана амин топ пайда болады:
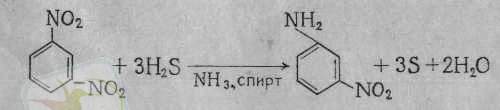
Күкіртті сутек артық болса, екінші нитро топ тотықсызданады.
Алифатты аминдерді де жоғарыда келтірілген әдіс арқылы синтездеуге болады. Бірақ оларды басқаша алу тиімдірек.
Нитробензолды бейтарап (нейтрал) ортада, айталық мырыш және хлорлы аммонийдің қатысуымен тотықсыздандырса, аминді қосылыс түзілмей, фенилгидроксиламин шығады:
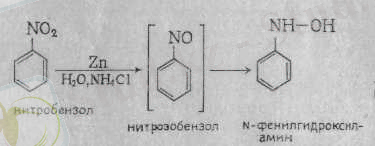
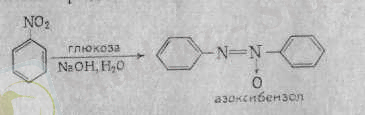
Егер іштробеизолды сілтілік ортада тотықсыздандыра бастаса, ондайда пайда болған аралық бөлшектер еселену, яғни димерлену реакциясына түседі:
Егер аса жұмсақ тотықсыздандырғыш глюкозаны мырыштың есептеулі мөлшерімен ауыстырса, онда азобензол шығады:
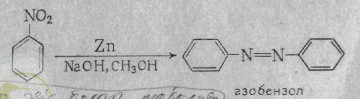
Бұл реакциялардағы мырыш мөлшері артық болса, әуелі азобензол, сосын ол онан әрі сутектеніп, бояу синтезі үшін қажетті шикізат - гидроазобензол түзіледі:
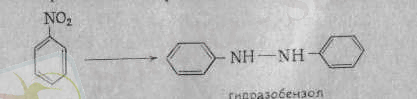
Жоғарыда келтірілген реакциялардан басқа, нитроқосылыстар қатарында орынбасу реакциясы бар.
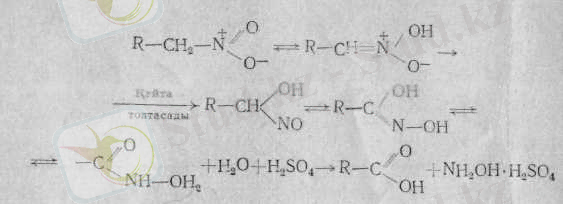
Алифатты нитроқосылыстарға күшті қышқыл әсер етсе, олар карбон қышқылдарына түрленеді:
Біріншілік және екіншілік нитроқосылыстарға сұйытылған қышқылдармен қалыпты жағдайда әсер етсе, онда қайта топтаспайақ, оксоқосылыстар түзіледі:
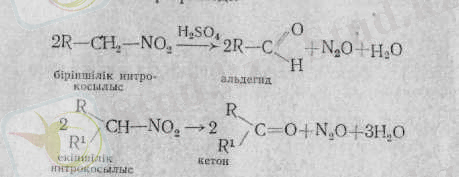
Мұндайда біріншілік нитроқосылыс альдегид, ал екіншілік кетон түзеді. Бұл реакция нитроқосылыстарды бір-бірінен айыра білу үшін қажет.
Ал үшіншілік нитроқосылыстар, мысалы, 2-питро-2-метил пропанды алсақ, ол сілті мен қышқыл әсеріне төзімді, ешбір өзгеріссіз қалады:
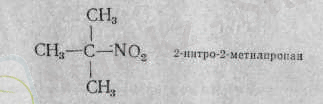
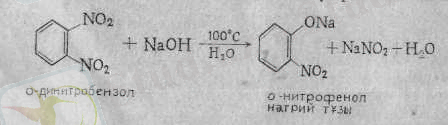
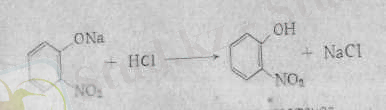
Ароматты қатардағы нитроқосылыстар оларға нуклеофилді реагенттер әсер еткенде, орынбасу реакцияларына түседі. Бұған, әсіресе, бір-біріне арақатынасы орто -немесе, пара -жағдайдағы топтары бар қосылыстар бейімдеу. Мысалы, орто- динитробензол сілті ерітіндісімен қайнатылса, ол opтo -нитрофенолға айналады:
1. 5. Корбонилді қосылыстармен конденсациясы
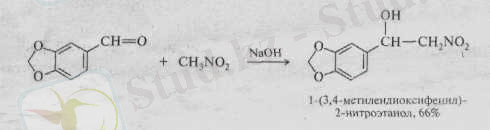
Біріншілік және екіншілік нироқосылыстар метиленді компонент ретінде альдегид және кетондарға қосылуға қабілетті, мұнда нитроспирттер түзіледі.
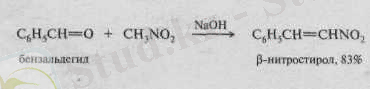
Конденсация негіздік катализаторлардың қатысында нуклеофилді қосып алу механизмі бойынша жүреді және көбінесе судың үзілуіне алып келеді, ол қанықпаған нитроқосылыстар түзілуіне алып келеді.
Нитроқосылыстар тотықсызданған кезде біріншілік аминдер түзіледі. Реакция алғаш орыс химигі Н. Н. Зинин тарапынан (1842) жүзеге асырылған және оның атына ие.
Тотықсызданруға әр алуан реагенттерді пайдаланады. Нитроқосылыстарды металдармен- темір, қалайы, мырыш, амальгамдалған алюминий мен тотықсыздандырады, реакцияны қышқыл немесе сілтілік ортада жүргізеді.

Нитроқосылыстардан аминдер алу үшін каталиттік гидрлеуді пайдаланады. Нитроқосылыстардың жақсы тотықсыздандырғышы болып, сондай-ақ күкіртсутек және сульфидтер, темір (ІІ) тұздары және қалайы (ІV), металдардың комплексті гидридтері табылады. Аммоний сульфидінің есептелген мөлшерін пайдалану арқылы динитроқосылыстардағы екі нитротоптың біреуінің селективті тотықсыздануына қол жеткізу мүмкін.
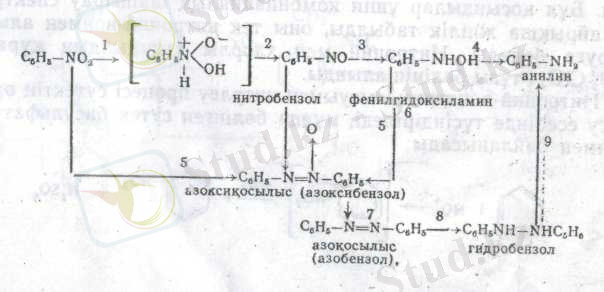
рН ортаға байланысты нитроқосылыстарды тотықсыздандыру процесінде әр түрлі аралық өнімдер түзіледі. Осылай, нитробензолды қышқылды ортада тотықсыздандырған кезде нитрозобензол, финилгидроксиламин және анилин, кезек-кезігімен түзіледі.
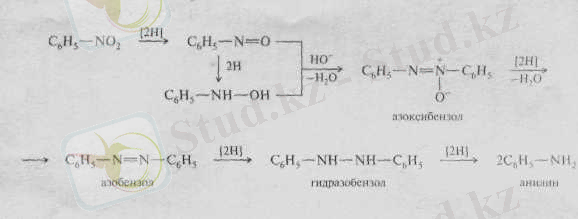
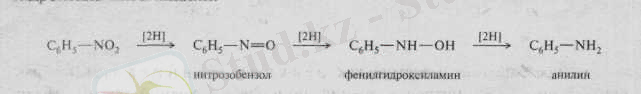
Сілтілі ортада тотықсыздану біраз күрделі кемеді. Алғаш түзілген нитробензол және финилгидроксиламин бір-бірімен азосибензолға конденсацияланады, ел кейін тізбектеле азобензол, гидрозобензол жәнеанилинге тотықсызданады.
1. 6. Қолданылуы
Қопарғыш ааттар ертеден белгілі. Олардың тұңғыш өкілі қара дәрі - оқк-дәрісі (немесе оны түтінді оқ-дәрі деп те атайды) . Ағаш көмірі, күкірт қоспасы мен тотықтырғыштан (селитра) тұрады. Бұл қоспаны oт тигізіп, жандырғанда, тотығу-тотықсыздану реакциясы жүреді. Мұның нәтижесінде көмір CO жәпе СО 2 -ге, ал күкірт SO 2 -ге дейін тотықса, ондағы селитра азот және оның тотығына дейін тотықсызданады. Осындай оқ-дәрісі мылтық, зеңбірек сияқты қарулардың ұңғысында от алса, көп газ бөлініп, ондағы қысым күрт көтеріледі. Оның күшімен оқ ұша жөнеледі.
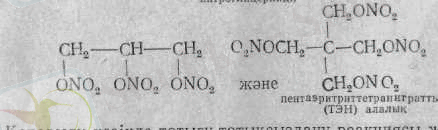
Бертін келе түтінді қара дәрі - түтінсізге ауысты. Ондағы тотығатын да, тотықсызданатын да зат бір-ақ қосылыстың құрамында. Оны - нитроцеллюлоза - дәлірек айтқанда, целлюлоза нитраты немесе азот қышқылының күрделі эфирі де деп береді. Оны алу үшін целлюлозаны нитрлеуші агент деп аталатын концентрлі азот және күкірт қышқылдарының қоспасымен қыздырады. Азот қышқылы мен көп атомды спирттерден алынғап курделі эфирлер де қопарылғыш заттар катарына енеді. Мысалы, гликольдинитраты O 2 NOCH 2 -CH 2 ONO 2 ;
Қопарылу кезінде тотығу-тотықсыздану реакциясы жүріп көміртек СО 2 , сутек Н 2 О, ал нитро топ бос азотқа айналады. Оны жалпы түрде былайша өрнектеуге болады:
C 2 H 4 N 2 O 9 → 2CO 2 +2H 2 O + N 2
Бұдан біз, ол дәрінің ешбір қалдықсыз, яғни түтінсіз жанатынын көреміз.
Нитроглицерин оталғанда, оттек артылып қалады:
С 3 Н 5 N 3 О 9 → 6СО 2 + 5Н 2 О+3N 2 + О 2
Сол себепті опы атылу кезінде оттек жетіспейтін қопарғыш нитроқосылыстармен бірге, араластырып қолданады.
Қопарылудағы реакция жану механизміндей емес, олар қопарылғанда соқпа толқыны пайда болады. Мұндай копарылғыш заттар тау-кенді қопару, әр түрлі құрылыс жұмыстары үшін қолданылады. Көптеген қопарылғыш заттардың кемшілігі олардың басым көпшілігі азғана сілкіністен, соққыдан және отқа жақындағанда оңай жарылуы, атылуы. Сондықтан да қопарылғыш зат ретінде қолдану үшін оларды жан-жақты зерттеп, тек сыртан әсер болғанда қосылыстарды іріктейді.
Мәселен, тұйық күйіндегі нитроглицерин кішкентай соққыдан, қозғалыстан қопарылып, жарылып кетеді. Егер оны инфузорлы топыраққа сіңірсе, ол біршама тұрақталады. Оны динамит дейді. Ол да тау-кен жұмыстарында пайдаланылады. ТЭН - ол да оңай қопарылатын қосылыс. Оны негізгі қопарғыш затретінде сирек қолданады.
Ол капсюлде, негізгі қопарғыш заттар үшін инициатор ретінде қажет.
Инициатор ретінде, өте аз мөлшерде күркіреуік сынап Hg(ONC) 2 немесе, қорғасын азнді РЬ(N 3 ) 2 қолданылады.
Көп тараған қопарылғыш заттар: 2, 4, 6-тринитротолуол (тротил) . Мұны толуолды нитрлеу арқылы алады:
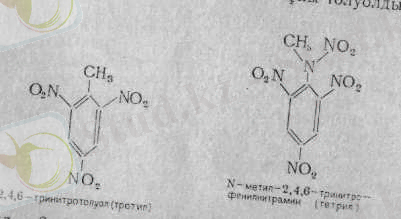
N- мвтич-2, 4, 6- (тетрил) N'-метиланилиннен синтездейді. Гексогенді уротропинді нитрлеп алады.
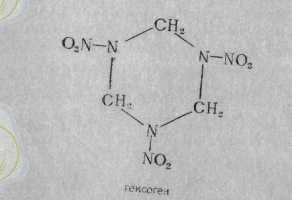
Тротил от-жалын әсеріне тұрақтылық көрсетеді. Ол өзін иницирлеуші болмаса қопарылмайды тек жанады. Мінеки, сондытан да оны оқ-дәрі жасау үшін пайдаланады. Гексоген жылуға төзімді. Оны ыстық цехтардағы жұмыстарда қолданады.
Бейбіт еңбекте жиі қолданылатын, әрі арзан қопарылғыштың бірі - аммоний нитраты NH 4 NO 2 .
Ол қопарылғанда артық көп оттек шығады. Оны ағаш ұнтағы сияқты арзан заттармен қосып пайдаланады. Кейде, оған шамалы ғана алюминий ұнтағын және тротил немесе нитроглицерин сияқтыларды қосады.
ІІ тарау. Ароматты нитроқосылыстар.
Құрамында бензол сақинасы және ядросында немесе бүйір-тізбегінде нитротобы бар заттарды ароматик нитроқосылыстар деп атайды. Нитробензол (C 6 H 5 NO 2 , нитротолуол ( о -, п - және м -изомерлер) СН 3 -С 6 Н 4 -NO 2 , фенилнитрометан С 6 Н 5 -CH 2 NO 2 , динитробензол ( о -, п - және м -изомерлер) C 6 H 4 (NО) 2 осындай заттардың мысалдары болып табылады. Ядросында нитротобы бар нитроқосылыстардың іс жүзінде өте үлкен маңызы бар. Олар бояғыштарды синтездейтіндердің жартылай шикізаты болып табылады, қопарғыш заттар, еріткіштер, иісті заттар т. б. есебінде қолданылады.

Қазіргі көзқарастар бойынша нитротопта семиполярлық байланыс бар, ол нитроқосылыстардың көптеген өзіндік ерекшеліктерінің себебінен табылады:
2. 1. Ядросында нитротобы бар нитроқосылыстар
2. 1. 1. Алу тәсілдері .
Ядросында нитротобы бар нитроқосылыстар ароматик көмірсутектерді азот және күкірт қышқылдарының қосындысымен (нитрлегіш қосынды) нитрлеу арқылы алады:
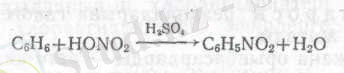
Бензолды нитрлегенде екінші нитротоп мета -қалыпқа енеді. Оның енуін нитрлеудің қатаңырақ жағдайларын - жоғары температураны, концентрациялы қышқылдарды пайдаланып өткізеді. Үшінші нитротоп та үлкен қиындықпен м -қалыпқа кіргізіледі. Динитробензолды түтінді азот және түтінді күкірт қышқылымен бес күн қыздырғанда үш нитробензолдың шығымы тек 45% болады:
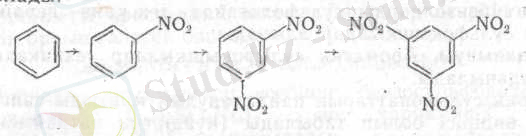
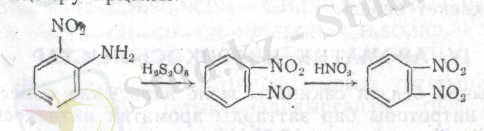
Нитротоптар басқа қалыптарда орналасқан полинитроқосылыстарды тек жолдармен алуға болады, мысалы нитроанилиндерді тотықтыру арқылы:
Ядрода нитрлеуді жеңілдететін орынбасарлар болса, әдеттегі жағдайларда үш нитротоп енгізуге мұрша келеді. Мысалы, толуол келесі схема бойынша нитрленеді:
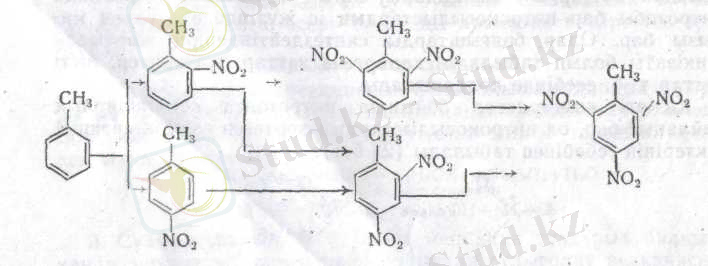
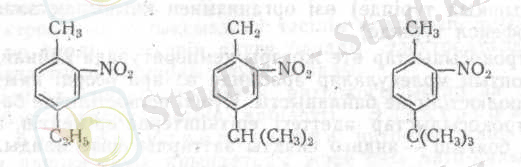
Құрамында екі орынбасары бар бензол гомологтарын нитрлегенде көлемдік эффект әсерін тигізеді. Егер, мысалы, бұл орынбасарлар п -қалыпта орналасқан болса, нитротоп кіші орынбасармен қатар тұрады:
Нитрлеу реакциясының жылдамдығы нитрленетін затқа және ннтрлегіш қосындының құрамына тәуелді; әр қосылыс үшін оптимальдық құрам болады. Мысалы, нитробензолды нитрлегенде оптимальды нәтижеге күкірт қышқылынң концентрациясы 90% болғанда жетеді. Қышқылдың концентрациясы 80%-ке төмнедегенде жылдамдық 3000 есе кемиді.
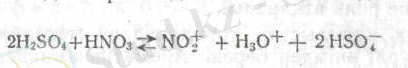
Нитрлеу механизміне арналған жұмыстар саны көп. Қазіргі уақытта азот қышқылының күкірт қышқылындағы ерітіндісінде мынадай тепе-теңдік бар екендігі кәміл тағайындалған:
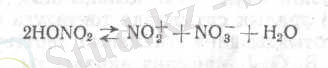
Таза азот қышқылы нитрлеу уақытында мына схема бойынша диссоциацияланады:
Қышқылдық қосындыда нитроний ионы NО 2 + бар екендігі көптеген тәсілдермен дәлелденген. Мысалы, электролиз кезінде азоты бар ионның катодқа қарай қозғалатындығы тағайындалған. Бұл қосындылар үшін комбинациялық шашырау спектрінде айрықша жиілік табылды, оны тек нитроний-ионмен алмастыруға болады. Нитроний мен хлорлы қышқылдың құрамы NO 2 + CIO 4 - тұзы бөлініп алынды.
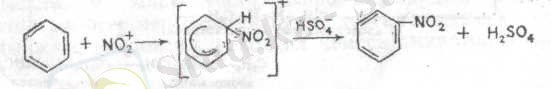
Нитроний-ионның қатысуымен нитрлеу процесі сутектің орын басу есебінде түсіндіріледі, мұнда бөлінген сутек бисульфаттық ионмен байланысады:
2. 1. 2. Физикалық қасиеттері.
Мононитроқосылыстар - сұйық не қатты заттар, түссіз немесе солғын сары түсті. Олар судан ауырырақ. Суда ерімейді. Ащы миндальдың иісі тән. Улы. Әсіресе нитробензол улы, себебі оның гомологтарынан гөрі (аминобензоин қышқыл түрінде) өзі организмнен қиынырақ аласталады (аминофенол түрінде) .
Нитроқосылыстар өте жоғары температурада қайнайды. Бұл нитротоптың молекулалар арасында өз ара әсерді қамтамасыз ететін полюстілігіне байланысты. Күшті полюстілігіне байланысты нитроқосылыстар әдеттегі еріткіштерде ерімейтін, мысалы, табиғи бояғыш - индиго сияқты заттарды еріте алады.
2. 1. 3. Химиялық қасиеттері.
Ароматик қатардың нитроқосылыстарының химиялық қасиеттері молекулалардың құрамындағы нитротоп пен бензол ядросына және олардың бір-біріне өз ара әсеріне байланысты.
1. Нитротоптың ең маңызды қасиеті - оның аминотопқа дейін тотықсыздануы. 1842 жылы Н. Н. Зинин Қазанда күкіртті аммонийдің көмегімен нитробензолды анилинге дейін тотықсыздандырды. Бұл жаңалық әсіресе бояғыштар, медикаменттер және фотохимикаттар саласында химиялық технологияның даму ісінде ерекше роль атқарады.
Ароматик қосылыстар тотықсыздану жағдайларына байланысты әр түрлі өнімдер береді. Ароматик аминдер тотықсызданудың ақырғы өнімдері болып табылады. Әдетте рлар қышқылдық ортада алынады.
Нейтрал негіздік және әлсіз қышқылдық ортада тотықсыздануды әр түрлі аралық сатыларда тоқтатуға болады. Нитроқосылыстардың тотықсыздану схемасын зерттеумен Габер және кейінгі уақытта В. О. Лукашевич айналысты.

Фриц Габер 9 желтоқсан 1868 жылы Бреслауда еврей бояғыштар және химикаттар сатушысы Зигфрид Габер отбасында дүниеге келді.
1886-1887 жылдарда Берлин және Гейдельберг университетінде химияны оқыды. 1891 жылы Габер К. Т. Либерман басшылығында диссертация қорғады.
Университетті бітірген соң, 3 жыл бойы Габер әр түрлі өндіріс орындарында химик-органик болып жұмыс істеді. Бір семестр бойы ол өзінің технология саласындағы білімін жетілдіру үшін Цюрихте Лунге сабақтарына қатысқан.
Сонан соң Л. Кюрр профессорының қолында жұмыс істеді. Осы жұмыстың нәтижесінде олар диацетилянтар қышқылының диэтил эфирі жайлы мақаларысы жариялады.
1894 жылы Габер профессор Бунттық ұсынысын қабылдап Карлсруэдегі Жоғары техникалық мектепте оның көмекшісі болды.
1898 жылы оның «Техникалық электрохимия» кітабы жарыққа шықты. 1898 жылдан Габер- Карлсруэдегі Жоғары Техникалық мектепте профессор.
1904 жылдан ол аммиактың тепе-теңдік күйдегі жағдайын зерттеуді бастайды.
Аммиактың сиетезі саласындағы жұмыстары үшін ол Нобель сыйлығының иегері болды.
1911 жылы Фикалық химия және электрохимия институтының деректоры болды.
Бірінші дүние жүзілік соғыста ол соғыс мақсаттарында уланушы заттар қолдануының бастаушысы болды.
Өмірінің соңғы жылдарын неміс өндірісінің дамуына ат салысты, сан алуан зерттеу жұмыстарын жүргізді.
Ол Швейцарияда, Базел қаласында 29 қаңтарда 1934 жылы қайтыс болды.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz