Тотығу-тотықсыздану процестері: термодинамика, химиялық кинетика, катализ және теңдеулерді құрастыру


Тақырыбы : Тотығу-тотықсыздану процесстер
Мақсаты:
Студенттерге термодинамиканың негізгі түсініктері мен заңдарын таныстырып, химиялық реакциялардың кинетикасы және тірі организмдегі катализдің ролі туралы түсінік беру.
Дәрістің жоспары:
1. Термодинамика. Негізгі түсініктері мен заңдарын
2. Химиялық кинетика және катализ.
Дәріс тезисі: :
Тотығу-тотықсыздану реакциялары
Тотығу және тотықсыздану
Тотығу дәрежесі- молекулалар мен иондардан тұрады деген жорамал бойынша есептеп шығарыған молекулалардағы атомның шартты заряды
Атомның тотығу дәрежесінің мәні оң, теріс немесе нолге тең. Оң тотығу дәрежесінің мәні оң, теріс немесе нолге тең. Оң тотығу дәрежесі осы элементтің берген электрон санымен өлшеніп, соңына оң таңба (+) қойылады. Теріс тотығу дәрежесі осы элементтің қосып алған электрондарының санымен анықталады да, соңына теріс таңба қойылады
(-) қойылады.
Элементтердің тотығу дәрежесін анықтағанда төмендегі жағдайларды ескереді:
1) Жай заттардағы атомдардың тотығу дәрежесі нольге тең;
2) Молекулалардағы атомдардың тотығу дәрежесінің алгебралық қосындысы нолге тең болады;
3) Қосылыстарда сілтілік металдардың тұрақты тотығу дәрежесі (+1), II топтың негізгі топша металлдары, мырыш және кадмий (+2) ;
4) Сутектің тотығу дәрежесі барлық қосылыстарда (+1), тек гидрид металдарында тотығу дәрежесі( -1) тең (NaH, CaH 2 және т. б. ) ;
5) Қосылыстарда оттегінің тотығу дәрежесі (-2) тең, тек пероксидте (-1) және оттек фторидінде OF 2 (+2) .
Мысалы, қосылыстарда NH 3 , N 2 H 4 , NH 2 OH, N 2 O, NO, НNO 2 , NO 2 және HNO 3 азоттың тотығу дәрежелері -3, -2, -1, +1, +2, +3, +4, +5 тең.
Тотығатын зат электронды береді де, тотықсызданатын зат электронды қосып алады. Реакция кезінде электрондарды беретін бөлшекті (атомды, ионды немесе молекуланы) тотықсыздандырғыш дейді, ал электронды қосып алатын бөлшекті тотықтырғыш деп атайды.
Барлық тотығу-тотықсыздану реакцияларын негізгі үш типке бөлуге болады:молекулааралық, молекулаiшiлiк және диспропорция реакциялары.
1. Молекулааралық тотығу-тотықсыздану реакцияларында тотыктырғыш пен тотығсыздандырғыш әр турлi заттардың құрамында болады.
2. Молекулаiшiлiк тотығу-тотығсыздану реакцияларында тотыктырғыш пен тотығсыздандырғыш бiр заттың құрамында болады.
3. Диспропорция реакцияларында бiр атом әрi тотықтырғыш, әрi тотығсыздандырғыш болады.
Тотығу-тотықсыздану реакцияларында электрондарды беретiн заттар тотығсыздандырғыш, ал электрондарды қосып алатын заттар тотықтырғыш деп аталады. Реакция барысында тотығсыздандырғыштың тотығу дәрежесi жоғарылап, тотығады, ал тотығтырғыштың тотығу дәрежесi төмендеп, тотықсызданады.
- Аса маңызды тотықтырғыштар мен тотықсыздандырғыштар
5 кесте- маңызды тотықтырғыштар мен тотықсыздандырғыштар
Маңызды
тотықтырғыштар
Маңызды
тотықсыздандырғыштар
- Теріс тотығу дәрежелі күйге ауысатын бейметалдар (CI2, Br2, I2, F2, S, O3) .
- Бейтарап күйге ауысатын металдар мен сутек катиондары: Ag+, Cu2+, Н+.
- Құрамындағы элементтердің тотығу дәрежесі жоғары немесе аса жоғары болатын күрделі заттар. Мысалы: калий перманганаты KMnO4, К2МпО4, марганец (ІУ) оксиді MnO2калий дихроматы K2Cr2O7, калий хроматы K2CrO4, FeCI3, HNO3, HCIO4, H2SeO4, PbO2, Ag2O, H2O2, CuO, гипохлоридтер, хлораттар мен перхлораттар.
- Концентрлі Н2SO4концентрлі HNO3пен НҒ қоспасы, «патша арағы» (3:1 қатынастағы концентрлі НСІ және HNO3) .
- Электролиз кезіндегі анод.
- Оң тотығу дәрежелі күйге ауысатын барлық металдар.
- Оң тотығу дәрежелі күйге ауысатын барлық бейметалдар (Н2сутек, В бор, С көміртек) .
- Құрамына тотығу дәрежесі төмен немесе өте төмен болатын элементтер енетін күрделі заттар. Мысалы: FeCI2; ҒеSO4; Cr2(SO4) 3; MnSO4; H2S; HCI; HBr; HI; NH3; CO; N2H4; NO; SO2; H3PO3; H2SO3және оныңт ұздары; HNO2; SnCI2; Na2S2O3.
- Органикалық заттар-альдегидтер, спирттер, глюкоза, құмырсқа және қымыздық қышқылдары.
- Электролиз кезіндегі катод.
Тотығу- тiрi организмдерде журетiн дем алу және зат алмасу процестерiнiң, шiру және ашу, сол сиякты жасыл өсiмдiктердегi фотосинтез реакцияларының, адам мен жануарлардың жүйке кызметтерiнiң негiзiн калайды. Тотығу-тотығсыздану реакцияларын шикiз аттар жанғанда, металдардың коррозиясы және электролиз процестерi кезiнде де байкауға болады. Тотығу-тотысыздану реакцияларының аркасында гальваникалық элементтер мен аккумуляторларда химиялық энергия электр энергиясына айналады.
9. 1. 4 Тотығу-
Медицина және фармацияда тотығу-тотықсыздану реакциялары маңызды роль атқарады. Олар көптеген тіршілікке биохимиялық процесстердің негізінде жатыр. Ағзаның тіршілігі үшін энергия қажет. Биологиялық жүйелерде энергия көзі болып күрделі органикалық қосылыстардың оттегі мен тотығу реакциялары болып табылады.
Дәрілер дайындауда жеке компоненттердің тотығу-тотықсыздану қабілеттілігін білу қажет. Мысалы майда еритін витаминдерді дайындау кезінде оның ауадағы оттегі мен жеңіл тотығуын ескеру керек. К-витамині тотығу кезінде белсенділігі өзгермейді, ал өнімдері тотығу кезінде улы. В-дәрумені сілтілі және бейтарап ерітінділерде, қатты дәрілік түрде де жеңіл тотығады, яғни әсіресе сілті ортада тотықтырғыш немесе тотықсыздандырғыш әсерінен ол белсенсіз күйге өтеді.
Тотығу дәрежесі - бұл молекулалар түзілу кезіндегі атомда пайда болатын шартты заряд.
Тотығу-тотықсыздану реакциялары (ТТР) деп реакциялар жүру барысында атомдардағы тотығу дәрежесінің өзгеруін айтамыз. ТТР-ры екі өзара байланысты процесстерден тұрады: тотығу процессінен және тотықсыздану процессінен.
Тотығу процессі - электрондарды беру процессі, осы кезде атомның тотығу дәрежесі артады.
Тотықсыздану процессі - электрондарды қосып алу процессі, осы кезде атомның тотығу дәрежесі төмендейді.
Тотығу-тотықсыздандыру реакцияларының теңдеулерін
құрастыру
Тотығу-тотықсыздану реакцияларының теңдеуін құруда екі әдіс -
- электрондық баланс әдісі
2 . жартылай реакция әдістері
Электрондық баланс әдісі.
Бұл әдіс бастапқы және соңғы заттардағы атомдардың тотығу дәрежесін салыстыруға негізделген. Мұнда негізгі талап бойынша тотықсыздандырғыш берген электрондар саны тотықтырғыш қосып алған электрондар санына тең болу керек. Теңдеуді құру үшін реакцияға қатысатын заттардың және реакция нәтежесінде алынатын өнімдердің формулаларын білу қажет. Соңғылар тәжірибе жүзінде немесеэлементердің белгілі қасиеттері арқылы анықталады. Бұл әдістің қолданылуын нақтылы мысалдар арқылы қарастырайық.
1 мысал . Палладий (ІІ) нитраты ерітіндісінің мыспен әрекеттесу реакциясының теңдеуін құрастыру. Реакцияның бастапқы және соңғы заттарының формулаларын жазып олардың тотығу дәрежелерінің өзгеруін көрсетеміз;
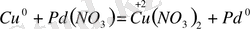
Мыс екі электронды беріп мыс ионын түзеді, оның тотығу дәрежесі 0 - ден +2-ге артады. Мыс -тотықсыздандығыш. Палладий ионы екі электронды қосып алып, тотығу дәрежесін +2-ден 0-ге өзгертеді. Палладий (ІІ) нитраты - тотықтырғыш. Бұл өзгерістерді электрондық теңдеу арқылы бейнелеуге болады.
Мұнда тотықтырғыш пен тотықсыздандырғыш коэффициенті. Реакцияның соңғы теңдеуі;
Cu +Pd(NO 3 ) 2 = Cu(NO 3 ) 2 +Pd болады
Реакцияның жалпы теңдеуінде электрондар көрсетілмейді. дұрыс екендігін тексеру үшін оң және сол жақтағы әрбір элементтің атомының сан мәнін есептейміз. Мәселен, оң жақта оттегінің 6 атомы бар, ал сол жақтада 6 атомы бар, палладийдікі 1 және 1, мыстікіде 1 мен 1. демек, теңдеу дұрыс құрастырылған. Бұл теңдеуді иондық түрде қайта жазамыз;
Бірдей
 иондарды қысқартқаннан кейін
иондарды қысқартқаннан кейін
Cu + Pd 2+ = Cu 2+ + Pd теңдеуін аламыз.
2-мысал.
Концентрленген тұз қышқылының марганец (ІV) оксидімен әрекеттесу реакциясының теңдеуін шығару керек (зертхана жағдайында реакция арқылы хлор
 алынады)
алынады)
Реакцияның бастапқы және соңғы заттарының формулаларын жазамыз
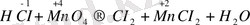
Реакцияға дейінгі және одан кейінгі атомдардың тотығу дәрежесінің өзгеруін көрсетеміз;
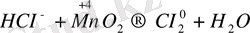
Бұл тотығу - тотықсыздану реакциясы, себебі марганец пен хлор атомдарының тотығу дәрежесі өзгереді. НСІ - тотықсыздандырғыш. МпО 2 - тотықтырғыш. Электрондық теңдеуді жазамыз.
2СІ -1 - 2е= СІ 2 0
Мn +4 + 2е =Мn +2
және тотықтырғыш пен тотықсыздадырғыш коэффициенттерін табамыз.
Олар 2 және 1- гетең. Коэффициент 2 (бір болмайды) қойылады, себебі тотығу дәрежесі 1-ге тең хлордың екі атомы 2 электронды береді. Бұл коэффициент электрондық теңдеуде келтірілген;
Басқа әрекеттесуші заттар үшін коэффициенттерді табамыз. Электрондық теңдеуден НСІ-дың екі молекуласынан МпО 2 -нің бір молекуласы келетіндігі көрініпт ұр. Бірақта, түзілетін екі зарядты марганец ионын қосып алу үшін тағы да қышқылдың екі молекуласы керек екендігін еске ала отырып, тотықсыздандырғыштың алдына 4 деген коэффициент қою керек. Нәтежесінде 2 молекула су алынады. Теңдеудің соңғы түрі;
болады.
Теңдеудің дұрыс жазылғандығын тексеру үшін кез-келген бір элементтің атомының санын есептеуге болады, мысалы хлордың сол жақта 4, ал оң жақта 2+2=4 атомы бар. Электрондық баланс әдісінде реакция теңдеуі молекулалық түрде берілетіндіктен, оларды дұрыс құрастырып және тексеріп барып иондық теңдеуді жазу керек. Құрылған теңдеуді иондық түрде қайта жазамыз.
4Н + + 4СІ - +МпО 2 = СІ 2 +Мп 2+ +2СІ - +2Н 2 О
Теңдеудің екі жағындағы бірдей иондары қысқартқаннан кейін (бұл хлор ионы) теңдеуін аламыз.
4Н + +2СІ - +МпО 2 =СІ 2 +Мп 2+ +2Н 2 О
3-мысал. Қышқыл ортада калий перманганатының ерітіндісімен күкртсутектің әрекеттесу реакциясының теңдеуін құрастыру. Алдымен реакция схемасын - бастапқы және алынған заттардың формулаларын жазамыз;
H 2 S +KМnO 4 + H 2 SO 4 →S +MnSO 4 + K 2 SO 4 +H 2 O
Одан кейін реакцияға дейінгі және одан кейінгі атомдардың тотығу дәрежесінің өзгеруін анықтаймыз:
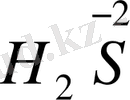 +
+
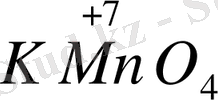 + Н
2
SO
4
→S
0
+
+ Н
2
SO
4
→S
0
+
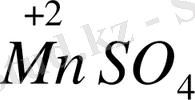 + K
2
SO
4
+ H
2
O
+ K
2
SO
4
+ H
2
O
Марганец пен күкірттің тотығу дәрежесі өзгереді (Н 2 S- тотықсыздандырғыш КMnО 4 - тотықтырғыш) .
Әрқарай электрондық теңдеуді құрамыз, яғни электронды беру немесе қосып алу процесін көрсетеміз,
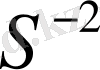 -2e= S
0
-2e= S
0
Тотықтырғыш пен тотықсыздандырғыштың алдындағы коэффиценттерді, ал одан кейін басқа әрекеттесуші заттардың коэффиценттерін табамыз.
Электрондық теңдеуден H 2 S-тің 5молін және КMnО 4 -тің 2 молін алғанда күкірт атомдарының 5 молімен МnSO 4 -тің 2 молін алатындығы көрініп тұр. Теңдеудің оң және сол жағындағы атомдар санын салыстыра отырып, K 2 SO 4 -тің бір молімен судың 8 молі түзілетіндігін табамыз.
Реакция теңдеуінің соңғы түрі;
5H 2 S +2KМпO 4 +3H 2 SO 4 = 5S + 2МпSO 4 +K 2 SO 4 +8Н 2 O
Теңдеудің дұрыс жазылғандығын оттегі атомын санау арқылы тексереді, сол жақта 2 * 4 +3 * 4=20, ал оң жақта 2 * 4+ 4 + 8 = 20
Теңдеуді иондық түрде қайта жазамыз;
5Н 2 S + 2МпО 4 +6Н= 5S +2Мп +8Н 2 О
Дұрыс жазылған реакция теңдеуі, заттың массалық сақталу заңының орындалуын көрсетеді. Сондықтан, бастапқы заттар мен реация өнімдеріндегі бірдей атомдардың саны тең болу керек. Зарядтарыда сақталу керек. Бастапқы заттардың зарядттарының қосындысы реакция өнімдерінің зарядтарының қосындысына тең болу керек.
9. 1. 5 Жартылай реакция әдісі немесе иондық - электрондық әдіс
Бұл әдістің тотықтыру процесімен және тотықсыздандыру процесі үшін иондық теңдеулерді құруға, ал одан кейін оларды жалпы теңдеуге біріктіруге негізделгенін оның аталуы көрсетіп отыр.
Мысалы ретінде электрондық баланс әдісін түсіндіруге пайдаланған реакцияның теңдеуін құрамыз (3-мысалды қара) . Қышқылданған ортада калий перманганат КMnО 4 ерітіндісі арқылы күкіртті сутек газын өткізгенде ерітіндінің малина түсі жойылып, күнгірттенеді. Тәжірибе ерітіндінің күнгірттенуі жай күкірттің түзілуі нәтежесінде, яғни мына процесстің жүретінін көрсетеді;
Бұл схемадағы атомдар саны бірдей. Зарядттарды теңестіру үшін схеманың сол жағынан екі электронды алып, одан кейін стрелканың орнына тепе-теңдік белгісін қою керек;
Н 2 S- 2е =S+ 2Н +
Бұл бірінші жартылыай реакция - тотқсыздандырғыштың Н 2 S тотығу процесі ерітіндінің түссізденуі МnО 4 ионының (малина түсті) Мn ионына (түссіздеуге болады, бірақ концетрациясы көп болғанда қызғылт түсті болады) өтуіне байланысты, оны мына схемамен көрсетуге болады;
Мn 2 +
Қышқылды ерітіндіде МnО 4 - ионының құрамында кіретін оттегі, сутегі онымен су түзеді. Сондықтанда бұл өзгерісті былай көрсетуге болады;
Стрелканы тепе-теңдік белгісіне ауыстыру үшін зарядтарды теңестіру керек.
Бастапқы заттарда жеті (7+) оң заряд, ал соңғы екі оң (2+) заряд бар. Зарядттардың сақталу шартын қамтамасыз ету үшін схеманың сол жағына 5 электронды қосу керек.
МпО 4 - +8Н + +5е - =Мп 2+ +4Н 2 О
Бұл екінші жартылай реакция, тотықтырғыш МпО 4 - перманганат ионының тотықсыздану процесі. Реакцияның жалпы теңдеуін құру үшін, алдымен берілген және алынғанэлектрондар санын теңестіріп алып, одан кейін жартылай реакция теңдеуін жекелеп қосу керек. Бұл жағдайда, ең кіші еселікті табу ережесіне сай, жартылай реакция теңдеуді көбейтетін көбейткіштер табылып, оған көбейтіледі де, қысқаша түрде былай жазылады;
Н 2 S - 2e =S +2H + 5
МnО 4 - +8Н + +5е = Мn 2+ + 4Н 2 О 2
5H
2
S + 2МnО
4
-
+16Н
+
=5S + 2Мn
2+
+10Н
+
 +8Н
2
О
+8Н
2
О

Теңдеуді 10Н + -ке қысқартып, иондық теңдеудің соңғы түрін аламыз
5Н 2 S +2МпО 4 - +6Н + = 5S +2Мп 2+ +8Н 2 О
Құрылған иондық теңдеудің дұрыс екендігін тексереміз; оттегі атомдарының саны сол жақта 8, оң жақта 8, зарядтарының саны; сол жақта (2-) +(6+) =4, оң жақта +2* (2+) = 4, себебі атомдар мен зарядтар теңестірілгендіктен теңдеу дұрыс құрылған.
Жартылай реакция әдісі арқылы реакциялардың теңлеуі иондық түрде құрастырылады. Иондық түрден молекулалық түрдегі теңдеуге өту үшін иондық теңдеудің сол жағындағы әрбір анионға сәйкес катион, ал әрбір катионға сәйкес анион табамыз. Одан кейін анықтаған иондарды сол күйінде теңдеудің оң жағынан бастап жазып, иондарды молекулаға біріктіреміз.
5Н 2 S +2МпО 4 - +6Н + =5S +2Мп 2+ +8Н 2 О
2К + +3SО 4 2- = 2К + + 3SO 2-
H 2 S + 2KMnO 4 + 3H 2 SO 4 = 5S + 2MnSO 4 + K 2 SO 4 +8Н 2 О
Сонымен, жартылай реакция әдісімен құрылған тотығу -тотықсыздану реакциясының теңдеуі, электронды баланс әдісімен құрылған теңдеуге әкеледі.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz