Протолиттік теория және ерітінділер: электролиттер, коллигативтік қасиеттер және буферлік жүйелердің рН-ы


Тақырыбы: Протолиттік теорияның негізгі қағидалары. . Күшті және әлсіз электролиттер ерітінділердің ерекшеліктері.
Мақсаты: Студенттерге. ерітінділердің жіктелуі, заттар ерігіштігіне әртүрлі факторлардың әсері. Ерітінділердің коллигативтік қасиеттері. Студенттердің буферлі жүйелердің ағзадағы маңызы мен олардың әсер ету механизмімен таныстыру.
Дәрістің жоспары:
1. Ерітінділердің негізгі түсініктері, құрамын бейнелеу әдістері.
2. . Ерітінділер туралы ілім.
4. Буферлі ерітінділер, құрамы. және жіктелуі
5. Буферлі ерітінділердің әсер ету механизмі.
6. Буферлік жүйелердің рН-ын есептеу формулалары
7. Организмнің буферлік жүйелері.
8. Буферлік сыйымдылық
Дәріс тезисі:
Ерітінділер туралы түсінік. Олардың жіктелуі.
Құрамы тұрақсыз, біртекті жүйе жүйе ерітінді деп аталады. Кез келген сұйық ерітінді еритін заттан, еріткіштен және солардың әрекеттесуі нәтижесінде пайда болған бөлшектерден тұрады.
Агрегаттық күйіне байланысты ерітінділер: сұйық, қатты және газ тәріздес болып жіктеледі. Сұйық ерітінділерге теңіздер мен мұхиттардың суларын (тіпті құбыр суын), көптеген техникалық ерітінділерді, дәрілік заттар, мұнайдың әртүрлі фракциялары жатады. Қатты ерітінділердің мысалы ретінде металдардың құймасын, табиғи минералдарды қарастыруға болады.
Газ тәріздес ерітінділерге ауаны, карбогенді (медицинада қолданылатын СО2 және О2 қоспасы) жатқызуға болады.
Егер ерітінді екі сұйықтан түзілсе, олардың мөлшері артығы еріткіштің ролін атқарады. Егер ерітінді сұйықта еріген қатты зат пен газдан пайда болса, агрегаттық күйі өзгермейтін компонент еріткіш болады.
Еріген зат және еріткіш деген түсініктер қатты ерітінділер мен газ қоспаларына қолданылмайды.
Еріген зат бөлшектерінің мөлшеріне байланысты ертінділер нақты (бөлшектердің мөлшері <1ммк) және коллойдтық (бөлшектердің мөлшері 1-100 ммк) болып бөлінеді. Егер бөлшнетедің мөлшері 100ммк-нан үлкен болса суспензиялар мен эмульсиялар пайда болады.
Нақты ерітінділер иондық (электролиттердің ертінділері) және молекулалық (электролитеместердің ерітінділері) болып жіктеледі.
Барлық нақты ерітінділер гомогенді болып келеді, олардағы еріген зат пен ерткіштің арасында бөліну беткейі болмайды.
Коллойдтық ертінділер гетерогенді, еріген зат (дисперстік фаза) пен ерткіштің (дисперсиялық орта) арасында фазалық бөліну беткейі болады.
ЖМҚ (жоғары молекулалық қосылыстар), белоктар, полисахаридтердің ерітінділері нақты ертінділердің де, коллойдтық ертінділердің де қасиетін көрсетеді.
Дәрігерлер үшін маңызды болып сұйық ертінділер есептеледі, себебі қан плазмасы, лимфа, несеп және белоктар, липидтер, көмірсулар, тұздардың күрделі қоспасы болып табылатын биологиялық сұйықтар осындай ерітінділерге жатады.
Ертінділердің маңызды сипаттамасына концентрация жатады. Ертіндінің немесе еріткіштің белгілі бір мөлшеріндегі еріген заттың нақты мөлшері концентрация деп аталады.
Концентрацияны бейнелеудің бірнеше нақты түрі бар.
- Массалық үлес, W; % - 100г ерітіндідегі еріген заттың массасын көрсетеді:
- Мольдік концентрация, См, моль/л - 1л ертіндідегі еріген заттың мөлшерін көрсетеді:
- Эквиваленттің мольдік концентрациясы немесе нормальді концентрация, Сн, моль/л - 1л ертіндідегі еріген заттың эквивалент мөлшерін көрсетеді:
- Молальдық концентрация, См, моль/кг - ерткіштегі еріген заттың мөлшерін көрсетеді:
Буферлік жүйелер мен ерітінділер туралы түсініктер,
олардың құрамы және жіктелуі
Сұйылтқанда немесе қышқыл не сілті қосқанда рН-ы өзгермейтін ерітінділер буферлік жүйелер деп аталады. Буферлік жүйенің құрамында протонның доноры және протонның акцепторы болады. Құрамына байланысты буферлік жүйелер қышқылдық, негіздік және амфолиттік болып бөлінеді.
Қышқылдық буферлік жүйе донор болып есептелетін әлсіз қышқылдан және акцепторлардын рөлін атқаратын анионы бар осы қышқылдың тұзынан тұрады. Мысалы, ацетатты, бикорбанатты буферлік жүйелер.
ацетатты :
CH 3 COOH - протонның доноры
CH
3
COONa CH
3
COO
 - протонның акцепторы
- протонның акцепторы
бикарбонатты :
Н 2 СО 3 - протонның доноры
NaHCO
3
HCO
3
 - протонның акцепторы
- протонның акцепторы
Негіздік буферлік жүйе әлсіз негізден (акцептор) және осы негіздің катионы (донор) бар тұздан тұрады. Мысалы:
NH 4 OH - протонның акцепторы
NH 4 CI NH 4 + - протонның доноры
Амфолиттік буферлік жүйе әр донордың, әрі акцептордың рөлін атқаратын амфотерлік қосылыстан тұрады. Мысалы, белок буферлік жүйесі:
СООН COO - -протонның акцепторы
R - CH
 R - CH
R - CH
NH 2 NH 3 + -протонның доноры
Буферлік жүйелердің рН-ын есептеу формулалары
Буферлік ерітінділердің рН-ы Гендерсон-Гассельбах теңдеуі бойынша анықталады. Қышқылдық буферлік ерітінділермен негіздік буферлік ерітінділердің рН-ын есептеу үшін әртүрлі теңдеулер қолданылады.
Қышқылдық буферлік ерітінділер үшін мына теңдеу қолданылады :
[тұз] [қышқыл]
рН = рК к-л + Ig немесе рН = рКқ л Ig
[қышқыл] [тұз]
Негіздік буферлік ерітінділер үшін мына теңдеу қолданылады :
[негіз]
рН = 14 - рКн-з + Ig
[тұз]
Бұл теңдеу бойынша буферлік жүйелердің рН-ы қышқылдық немесе сілтінің диссоциациялану константасына және буферлік жүйенің құрамындағы компоненттердің қатынасына тәуелді. Сондыктан да белгілі бір буферлік жүйені дайындау үшін константалары сәйкес келетін қышқыл немесе негіз алу керек, сол сияқты компоненттердің қатынасы да есепке алынуы қажет.
Сұйытылу кезінде буферлік жүйелердің рН-ын сақтауы аса маңызды құбылыс, себебі биологиялық сұйықтарды пайдалану үшін оларды қатты сұйытылуға тура келеді. Сұйытылудың буферлік жүйелердің рН-ына әсері шамалы екендігі тәжірибе жүзінде анықталған. РН-ы компоненттердің концентрациясы емес, қатынасына тәуелді жүйелерді сұйылтқанда компоненттердің концентрациясы бірдей дәрежеде төмендейді, сондықтан олардың қатынасы және рН-ы өзгермейді. Мысалы:
[Н
+
] = К
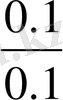 =К
=К
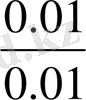 =К
=К
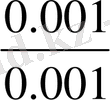
Буферлік ерітінділердің әсер ету механизмі
Күшті қышқыл немесе сілті қосқанда буферлік жүйелердегі сутегі иондары концентрациясының өзгермеуі олардың негізгі қасиеті болып табылады. Күшті қышқыл қосқанда сутегі иондары буферлік жүйедегі протонның акцепторымен әрекеттеседі, соның нәтижесінде сутегі иондарының концентрациясы өзгермейді. Сілті қосқанда гидроксид-иондар буферлік жүйедегі протонның донорымен әрекеттеседі, сол себепті рН өзгермейді. Мысалы, негіздік буферлік жүйедегі бұл процесс былай жүреді :
а) NH 4 OH
NH 4 CI + HCI
NH 4 OH + HCI = NH 4 CI + H 2 O
NH 4 OH + H + + CI - = NH 4 + + CI - + H 2 O
NH 4 OH + H + = NH 4 + + H 2 O
ә) NH 4 OH
NH 4 CI + NaOH
NH 4 CI + NaOH = NH 4 OH + NaCI
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz