Фенол молекуласының электрондық құрылысын MNDO (МПДП) және MINDO/3 (МЧПДП/3) әдістерімен есептеу және эксперименттік мәліметтермен салыстыру


Фенол молекуласының электрондық
құрылысын есептеу
Аннотация
Дипломдық жұмыстың көлемі беттен, кестеден, суреттен, кіріспеден зерттеу жұмыстарыннан, қорытындыдан және 22 пайдаланылған әдебиеттер тізімінен тұрады.
Негізгі терминдер: атомдық орбитал, молекуалық орбитал, төменгі бос молекулалық орбиталь (ТБМО) жоғарғы толған молекулалық орбиталь (ЖТМО), модифицированный метод пренебережения двухатомным дифференциальным перекрыванием (МПДП), модифицированный метод частичного пренебрежения дифференциальным перекрыванием (МЧПДП) .
Жұмыстың мақсаты: жартылай эмпирикалық квантты химиялық МПДП және МЧПДП/3 әдістерімен фенол молекуласының электрондық құрылысын есептеп, алынған нәтижелерді эксперименталдық мәліметтермен салыстыру және талдау.
Зерттеудің әдістері: модификацияланған екі атомды дифференциялдық астасуды ескермеу әдісі ( модифицированный метод пренебережения двухатомным дифференциальным перекрыванием), (МПДП), модификацияланған дифференциалдық астасуды ішінара ескермеу (МЧПДП/3) .
Зерттеудің ғылыми жаңалығы: фенол молекуласының электрондық құрылысы есептелді.
Алынған нәтижелер: фенол молекуласының күйін сипаттайтын квантты химиялық шамалар алынып, нәтижелер мәліметтермен салыстырылды.
МАЗМҰНЫ
Аннотация . . . 2
Кіріспе . . . 3
1. ӘДЕБИЕТТІК ШОЛУ . . . 6
1. 1. Фенолдар және олардың физикалық-химиялық қасиеттері . . . 6
1. 2. Нитрофенол негізіндегі суда еритін полимерлердің молекулалық модельдері . . . 13
1. 3. Нитрофенол негіздегі суда еритін полимерлердің су молекуласымен
өзара әрекеттесуін есептеу . . . 17
1. 4. Квантты химияның есептеу әдістері . . . 19
1. 4. 1. МЧПДП/3 (MINDO/3) әдісі . . . 21
1. 4. 2. МПДП (MNDO) әдісі . . . 24
2. Фенол молекуласының электрондық құрылысын есептеу . . . 25
2. 1. Фенол молекуласының есептелген негізгі нәтижелері . . . 25
2. 2. Фенол молекуласының басқа реагенттермен өзара әрекеттесуін
модельдеу және есептеу . . . 27
2. 3. Фенолды гидрлеу реакциясының өнімдерінің электрондық құрылысын
есептеу . . . 28 Қорытынды . . . 31
Пайдаланылған әдебиеттердің тізімі . . . 38
Қосымша 1. Фенол молекуласының есептеу нәтижелері . . . 32
Қосымша 2. Зерттеу жұмысындағы негізгі қысқартулар . . . 36
К І Р І С П Е
Квантты химия пәнінің негізгі мақсаты - ол әртүрлі жүйелерге Шредингердің стационар күй теңдеуін шешіп, жүйенің күйін сипаттайтын толқындық функциялар жиынын және энергетикалық күйлердің энергия мәндерін алу. Немесе бұл мәселені квантты химия тілінде Гамильтон операторының меншікті мәндері және меншікті функцияларын табу деп те атайды.
Квантты химияның теориялық мәселелерін бекітуде молекулалардың электрондық құрылысын есептеп зерттеудің маңызы зор.
Зерттеу жұмыстарын орындау барысында квантты химиялық әдістерді қолданып, қарастырылатын молекулалардың электрондық құрылыстары есептеледі. Нәтижелерді талдап квантты химиялық есептеу нәтижелерін эксперименттік мәліметтермен салыстырады. Молекулалық орбитальдарға талдаулар жүргізеді.
Есептеулерден молекуланың геометриясы (байланыс ұзындықтары, байланыс аралық бұрыштар, кеңістіктік бұрыштар) молекулалық орбитальдардың энергиялары және молекулалық орбитальдардың атомдық құрамы, молекуланың толық энергиясы, түзілу жылуы, электрлік дипольдық моментінің шамасы, атомдардағы зарядтардың таралу мәндері т. б. алынады.
Молекулалық орбитальдардың энергиялары заттардың молекулалық спектрлерін зерттеуде қолданылады.
Химиялық мәселелерді шешуде шегаралық молекулалық орбитальдардың маңызы өте зор. Қарама - қарсы таңбамен алынған ең жоғарғы молекулалық орбитальдың энергиясы молекуланың иондау энергиясын береді, ал ең төменгі бос молекулалық орбитальдың энергиясы молекуланың электрон тартқыштығымен (сродство к электрону) салыстырылады.
Қосылыстардың физикалық-химиялық қасиеттері олардың электрондық құрылысымен анықталады.
Біз бұл жұмысымызда фенол молекуласының электрондық құрылысын МПДП және МЧПДП/3 әдістерімен есептеп, нәтижелерге талдаулар жүргіздік.
Жұмыс екі бөлімнен тұрады. Бірінші бөлімінде фенолдың физикалық-химиялық қасиеттері, алыну жолдары, қолдану бағыттары және зерттеу жұмыстарының нәтижелері келтірілген ғылыми әдебиеттер мен мақалаларға шолулар жасалған. Осы бөлімде есептеу әдістерінің мүмкіншіліктері және оны қолданып шешілген химиялық мәселелер қарастырылған.
Жұмыстың екінші бөлімінде негізінен фенол молекуласының электрондық құрылысының есептеу нәтижелері келтіріліп, оларға талдаулар жүргізілген. Зерттеу нәтижелерінің қолдану бағыттары көрсетіліп, экспериментальдық мәліметтермен салыстырылған.
Зерттеу жұмысы қорытындыланып, пайдаланылған әдебиеттер тізімі келтіріліп, жұмысқа қосымшалар берілген.
1. Әдебиеттік шолу
1. 1. Фенолдар және олардың физикалық-химиялық қасиеттері
Фенол(бензенол) - кристалдық зат, балқу температурасы 43 0 С, қайнау температурасы 181 0 С, суда ериді (15 0 С-8% шамасы) . Сумен әдетте карбол қышқылы деп аталатын гидрат (балқу темп. 16 0 С) береді. Судың аз мөлшері фенолдың балқу температурасын күшті төмендетеді. Оның өзіндік өткір иісі бар. Фенол денені күйдіреді. Медицинада алғаш қолданылған антисептиктердің бірі болып табылады. Фенол адамдар мен жануарлардың несебінде болады, өйткені құрамында бензол сақинасы бар белоктың аминоқышқылдар организмде ыдырағанда фенол пайда болады.
Техникада фенол тас көмір смоласынан, сондай-ақ синтетикалық тәсілдермен алынады: хлорбензолдан, сілтілік балқыту арқылы бензолсульфоқышқыл тұздарынан, бензол мен пропиленнен кумо алу сатысы арқылы алынады.
Фенол техникада көп мөлшерде пластикалық массалар O(формальдегидпен конденсация), дәрі-дәрмектік препараттар (салицил қышқылы және оның туындылары), қопарғыш заттар (пикрин қышқылы) алу үшін қолданылады.
Физикалық қасиеттері. Фенолдар- әдетте суда қиын еритін кристалдық заттар. Су буымен қоса ұшады. Өзіне тән иісі бар. Антисептиктер болып табылады, улы, теріге тисе куйдіреді. Сумен әуелгі фенолдан гөрі балқу температурасы төменірек кристаллогидраттар құрады.
Гидрокси топтардың санына қарай фенолдар атомдық бойынша бөлінеді: бір атомдық, екі атомдық және т. б. бензол үшін-алты атомдыққа дейін. Фенолдарды не байырғы аттармен, не көмірсутек туындылары есебінде атайды. Мысалы, С 6 Н 5 ОН фенол (немесе бензенол)
Н 3 С ОН
п- крезол (немесе 4-метилбензенол) (тиісті 0-және м изомерлері бар. )
Бір атомды фенолдар
Алу тәсілдері. Ароматик ядроға гидроксил топты енгізудің бірнеше тәсілдері бар. Олардың көпшілігі өндірісте қолданылады.
- Сульфоқышқылдардың тұздарын сілтілермен балқыту.
С
6
Н
5
SO
3
Na + 2NaOH
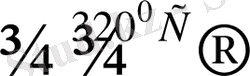 C
6
H
5
ONa + Na
2
SO
3
+ H
2
O
C
6
H
5
ONa + Na
2
SO
3
+ H
2
O
Бұл әдіс өнеркәсіпте кеңінен пайдаланылады. Реакцияны әдетте 320-350 0 С күйдіргіш натриймен жүргізеді, бірақ қымбатырақ күйдіргіш калий одан гөрі жақсы шығым береді. Фенолдың шығымы сульфолау үшін алынған бензолмен салыстырғанда 60-70% шамасында болады. Техникада ашық және автоклавтық процестер пайдаланылады.
Реакциямен қатар қосалқы тотығу процестері өтеді. Бензол сульфоқышқылдардың натрий тұзын күйдіргіш натримен қоса балқытқанда фенолмен қатар резорцин (1), флораглюцин (ІІ) және n-n / - диоксидифенил (ІІІ) алынады.
ОН ОН
OH OH OH ОН ОН
І ІІ ІІІ
Алкилфенолдардың жағдайында алкил топтардың жарым-жартылай тотығуы өтеді. Мысалы, мезитиленнің сульфоқышқылын (ІV) сілтімен қоса балқытқанда мезитолмен (V) қатар келесі заттар алынады:
СН 3 CH 3
SO 3 H OH
H 3 C CH 3 H 3 C CH 3
IV V
COOH OH
OH
H 3 C CH 3 H 3 C CH 3
- Галоген туындылардың гидролизі. Техникада кейінгі кездерде хлорбензолды гидролиздеу жолымен фенолдың жақсы шығымын алуды үйренді.
Сl ОН
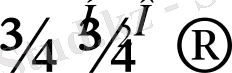
Ядромен байланысқан хлордың қозғалтқыштығы аз, сондықтан да процесті немесе мыс тұздарының қатысуымен 250 0 С автоклавта күйдіргіш натридің 8% тік ерітіндісімен жүргізеді немесе сілтінің ерітіндісі хлорбензолмен бірге 300 0 С және 200атм. Дейін қысымда ұзындығы 1км - ден аса түтіктер системасы арқылы өткізіледі (реакцияның механизмін кіші Н. Н. Ворожцов зерттеген) .
Бұл процестің жүруімен қатар қосалқы өнімдер алынады: дефенилэфирі С 6 Н 5 ОС 6 Н 5 , о-және n оксидифенилдер.
Бірінші заттың елеулі мөлшері түзілуінен құтылу үшін оның өзін системаға арнайы кіргізеді себебі оның алыну процесі мынадай тепе-теңдікпен шектелген:
2С 6 Н 5 ОН ↔︎ С 6 Н 5 ОС 6 Н 5 + Н 2 О
Кейінгі кездерде галогентуындылары гидролизінің бұл фазасында әдеткі қысымда өтетін бірнеше катализдік процестер белгілі болады. (Рашиг)
- Гидроасқынтотықтардың ыдырауы. Фенол кейбір алкилбензолдардың асқын тотықтарының қышқылдық ыдырауы арқылы алынады. Мысалы, қумолдың гидро асқынтотығы ацетонмен фенолға ажырайды.
H О - ОН
Н 3 С C СН 3 СН 3 С СН 3 ОН
С 6 Н 6
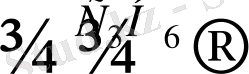
+
АlCl 3 катал
+ СН 3 - СО - СН 3
Екіншілік - бутилбензолдың гидроасқынтотығы да осы сияқты күйге ұшырайды.
- Біріншілік ароматик аминдерге азотты қышқылдың әрекеті. Аралық өнімдер есебінде бұл процесте ароматик диазоқосылыстары алынады.
NH 2 N 2 Cl OH

+ N 2 + HCl
HCl
Диазотоптың гидроксилмен алмасуы. Қышқыл ерітіндіде сақтау арқылы немесе қайнаумен тезірек жүзеге асырылады. Мысалы, тұздарының қатысуы процесті оңайлатады.
5. Осы сияқты реакциялармен фенолдың гомологтарын бензолдың гомолгтарының сульфо-, галоген-, немесе аминотуындыларынан алуға болады. Алайда алкил - топты фенолдың ядросына енгізудің де әдістері бар.
Гидроксил топтың активтеу әрекеті арқасында фенолдарды алкилдеу бензол және оның гомологтарын алкилдеуден гөрі жеңілірек жүреді. Катализатор есебінде бұл арада - хлорлы мырыш, ал алкилдегіш зат есебінде спирттерді пайдалануға болады.
ОН ОН
ZnCl 2 С 2 Н 5
Химиялық қасиеттері. Фенолдардың реакцияға өте қабілетті гидроксил тобы мен ароматик ядросы бар.
Фенолдар спирт немесе судан гөрі едәуір үлкен қышқылдық көрсетеді, алайда қышқыл есебінде олар көмір және карбон қышқылдарынан әлсіздеу. Мысалы, сірке қышқылының диссоциациялану константасы 1, 8·10 -5 ; комір қышқылынікі 4, 8·10 -7 ; көгерткіш қышқылдікі 7, 2·10 -10 ; фенолдікі 1, 3·10 -10 және судікі 1, 8·10 -16 . Сондықтан фенолдар күйдіргіш натрийдің ерітіндісімен әрекеттесіп феноляттар түзеді, бірақ натрий карбонатынан көмір қышқылын СО 2 ығыстырып шығара алмайды. Керісінше, фенолдарды феноляттардың ерітіндісінен көмір қышқылы ығыстырып шығарады:
Ar-OH + NaOH → [ArO] - Na + +H 2 O
[ArO] - Na + +CO 2 +H 2 O→ ArOH + NaHCO 3
Келтірілген реакциялар спирттерден немесе карбон қышқылдарынан фенолдар бөліп алу үшін пайдаланылады.
Бұл ескертулердің ядросында күшті электрофильдік тобы бар фенолдарга қатысы жок. Диссоциация константалары о-нитрофенол үшін 6, 8·10 8 , м-нитрофенол үшін 5, 3·10 -9 , п-нитрофенол үшін 6, 5·10 -8 , 2, 4-динитрофенол үшін 8, 3·10 -5 және 2, 4, 6-үш нитрофенол(пикрин қышқылы) 4, 2·10 -1 тең. Мононитрофенолдардағы нитро топтың әсері орто- және пара- қалыпта - мета - қалыптағыдан гөрі көп. Орто- және пара- қалыптағы екі нитротоп шамамен карбон қышқылдарындай күшті қышқылдық береді. Орто - және пара - қалыптарда үш нитротобы бар пикрин қышқылы күші жағынан минералдық қышқылдарға жақын. Спирттермен салыстырғанда фенолдардың үлкен қышқылдығын атомының бөлінбеген электрондар жұптарының ядроның электрондарымен әрекеттестеру арқылы түсіндіруге болады. Мұндай қосарлану оттегі атомындағы электрондар тығыздығын азайтады және спирттегіден гөрі фенолдарда протонның үлкен қозғалғыштығын туғызады. Фенолда электрондық тығыздықтың таралуы (Б) формуласында көрсетілген.
:
 - Н ОН
- Н ОН
-δ 1, 053
-δ 1, 0
1, 053
-δ
А Б
1. Темір фелоляттарының комплекстік сипаты бар олардың ерітінділері қатық боялған. Фенол ҒеСІ 3 ерітіндісімен күлгі түске, крезолдар - көп түске боялады.
2. Фенолдарға, әсіресе мыс ұнтағының қатысуымен, галогентуындылардың феноляттары әсер еткенде, содай-ақ фенолдарға алкисульфаттар, сульфоқышқылдардың эфирлері немесе диазометан әсер еткенде, фенолдан гидроксил топтағы сутегі атомының арқасында оңай алкилденеді:
С 6 Н 5 ОNa + C 2 H 2 Br → NaBr + C 6 H 5 OC 2 H 5
фенетол
(этилфенилэфирі)
С 6 Н 5 ОН + СН 2 N 2 → C 6 H 5 OCH 3 + N 2
анизол
Фенолдардың эфирлері - тұрақты заттар. Алайда инерттік ерітінділер Na немесе NaNH 2 қыздырғанда оларда, радикалдары майлар қатарынан эфирлер сияқты ыдырайды. Оларда сілтілердің әсері аз.
3. Фенол этилен тотығымен конденцасияланып, полиэтиленгликолдың фенидэфирін құрайды:
O
ОН + n ( CH
2
- CH
2
)
 O - CH
2
- CH
2
→
O - CH
2
- CH
2
→
→[O - CH 2 - CH 2 - ] n-1 OH
Мұндай эфирлерге, әсіресе егер фенол молекуласында алкил тобы бар болса, актив - беттік қасиеттер тән. Бұл жағдайда молекуланың алкилфенил бөлігі - гидрофобтық, ал молекуланың полиэтилендік бөлігі - гидрофилдік бөлік болып табылады. Октифенолдың «ОП-7», «ОП-10» атпен белгілі полиэтилендік эфирлері техникада тоқыма материалдарын тазарту және жуу үшін кеңінен қолданылады, мұнда бұл аттардағы цифр этиленгликольдің қалдық санын көрсетеді:
С 8 Н 17 - С 6 Н 4 - О - СН 2 - СН 2 [O - CH 2 - CH 2 ] x - OH
4.
O
║
ОН OBr C
Br Br Br - C C - Br
→ → ║ ║
HC CH
Br CBr 2
OH OH
NO 2 O 2 N NO 2 OH
OH
O 2 N NO 2
OH OH
NO 2 NO 2
NO 2 NO 2
1. 2. Нитрофенол негіздегі суда еритін полимерлердің молекулалық модельдері
Бөлімде фенол және оның түрлі орын басқан туындылары негізінде суда еритін полимерлер синтезделіп, алынған полимерлер лабораториялық жағдайда судағы кездесетін әртүрлі иондардан, қоспалардан тазарту қабілеттеріне сынақтар жүргізілуде.
Әрине, полимерлердің суды тазарту қабілеті, олардың электрондық құрылысына, активті орталықтардың адсорбциялық қасиеттеріне, сонымен бірге өзара әрекеттесетін молекулалардың (иондардың) табиғатына байланысты болады. Синтезделген полимерлер мен судағы әртүрлі иондардың арасындағы өзара әрекеттесулердің табиғаты мен механизмін тағайындауда квантты химиялық есептеулердің беретін мәліметтері мол екені белгілі.
Квантты химияда қатты дененің электрондық қасиеттерін кластар арқылы модельдеп есептеуде қатты дененің молекулалық модельдері жиі қолданылады. Бұған химиялық өзара әрекеттесудің әсері тізбек бойынша екі-үш байланыстан ары таралмайтыны толық негіз бола алады.
Біздің бұл жұмысымызда синтезделген полимерлердің моделі есебінде орто- нитрофенол және пара- нитрофенол молекулалары алынып, олардың электрондық құрылыстары есептеліп зерттелді.
ППДП/2 тәсілімен /4/ есептелген негізгі квантты химиялық шамалар
1-кестеде келтірілген. Кестеде берілген жуықтаудағы орто- нитрофенол, пара- нитрофенол молекулаларының толық энергиялары (Е т ), дипольдық моменттерінің шамалары (μ), ең жоғарғы толған молекулалық орбиталь (ЖТМО) және ең төменгі бос молекулалық орбиталь (ТБМО) энергия мәндері, сонымен бірге, q 0, q н , q c - гидроксил топтағы атомдар мен онымен байланысқан көміртегі атомындағы q N , q 0 ( N ) - нитротоптағы атомдардың заряд шамалары (электрондық үлеспен) берілген.
1-кесте. Орто-, пара- нитрофенол молекулаларының есептелген негізгі нәтижелері
Ескерту, жақша ішінде дипольдық моменттің эксперименттік мәндері берілген.
Молекулалардың басқа атомдарындағы заряд шамалары елеусіз аз болғандықтан кестеде келтірмедік. Есептелген модельдерде оң зарядтың ең көп шоғырланған атомдары: нитротоптың азот атомы, гидроксил топпен байланысқан көміртегі атомы және гидроксил топтың сутегі атомы. Осы атомдар нуклеофильді реагенттердің шабуыл жасауына активті орталықтар болып табылады. Теріс зарядтар гидроксил және нитротоптың оттегі атомдарында ең көп шоғырланған, сондықтан осы атомдар электрофильді реагенттердің шабуыл жасауына ықпал жасайды.
Есептеудің нәтижесінде алынған мәліметтерді қарастырылған модельдердің әр түрлі молекулаларымен немесе полярлы еріткіштермен әрекеттескен кезде пайдалануға болады.
Кестеден пара-нитрофенол молекуласы орто-нитрофенолдан 0, 41 эВ=39, 4 кДж/моль шамасына орнықты болатыны анықталған. Сонымен бірге, нитротоптың молекула жазықтығында жатқан жағдайы орнықты болатыны белгілі болды, мысалы, пара-нитрофенолда нитротопты молекула жазықтығынан перпендикуляр жазықтыққа бұру үшін 1, 2 кДж/моль энергия қажет екенін есептеулер көрсетті. Бұл мәліметтерде қарастырылған молекулалардың стереоизомерлерінің қасиеттерінің ерекшеліктерін айқындайды.
Кестеде көрсетілген атомдардағы заряд шамаларына қарай, суда кездесетін әртүрлі зарядталған иондардың шабуыл бағытын сапалы түрде анықтауға болады. Сонымен бірге, суда еритін полимерлердің (орто-, пара-интрофенол негіздегі) әртүрлі иондармен өзара әрекеттесуінің электростатикалық табиғаты болатынын ескерсек, реагенттердің электрлік қасиеттерін сипаттайтын маңызды физикалық-химиялық шама дипольдық момент болып табылады.
Қарастырылып отырған молекулалардың есептелген дипольдық моменттерінің шамалары, тәжірибелік мәліметтермен (1-кесте) сәйкестігі жақсы екендігі көрінеді.
Молекулалардың электрлік дипольдық моментінің шамасы молекула аралық өзара әрекеттесудің шамасын анықтауға және олардың табиғатын тағайындауға мүмкіншілік береді. Молекулалардың дипольдық моментін анықтайтын физикалық зерттеу әдістері құралдарының аса қымбат екенін ескерсек, квантты химия әдістерінің бұл жағынан алғанда да тиімді екендігі айқын.
1-кестеде суда еритін полимерлердің модельдері орто- және пара-нитрофенол молекулаларының молекулалық орбитальдар жиыны берілген. Молекулалық орбитальдардың энергетикалық деңгейлерін молекулалық спектрлерді талдауларда пайдалануға болады.
2-кесте
Орто- және пара-нитрофенол молекулаларының молекулалық орбитальдарының (МО) энергиялары
N
MO
N
MO
Квантты химиялық есептеулерде ең жоғарғы толған молекулалық орбитальдың (ЖТМО) қарама-қарсы таңбасымен алынған энергияның мәні, молекуланың иондалу энергиясын беретіні белгілі және иондалу энергиясының шамасы молекуланың тотығу қабілетінің сипаттамасы болады. 1-кестеден пара-нитрофенол молекуласына қарағанда орто-нитрофенолдың тотығу реакциясына қабілеттігі артық екені (0, 30эВ) байқалады. Есептеулердің нәтижелері бойынша, пара-нитрофенол негіздері синтезделген полимерлер туралы да осындай қорытынды жасауға болады. Қарастырып отырған екі молекуланың ЖТМО атомдық құрамдары да бір-бірінен айрықша екенін де айта кеткеніміз жөн. Яғни бұл орто- нитрофенол және пара- нитрофенол негіздегі полимерлердің тотығу механизмдері әртүрлі болады деген тұжырым жасауға алып келеді.
Қарастырылған модельдерде пара- нитрофенол молекуласының ең ТБМО-ы орто-нитрофенол молекуласына қарағанда 1. 11эВ-қа төмен орналасатындығы көрінеді. Ең төменгі бос молекулалық орбитальдың энергиясы молекуланың электрон артқыштығымен салыстырылатындықтан, және тотықсыздану қабілетін көрсететіндіктен келтірілген нәтиже пара- нитрофенол негіздегі полимерлердің орто-нитрофенол негіздегі полимерлермен салыстырғанда тотықсыздану қабілеті жоғары болатындығьн көрсетеді.
Синтезделген полимерлердің модельдері ретінде алынған орто-, пара-нитрофенол молекулаларының негізгі электрондық сипаттамаларын анықтағаннан соң, олардың әртүрлі молекулаларымен әрекеттесу заңдылықтарын зерттеуге көштік. Мұндай есептеулер көптеген мәселелерді шешуге мүмкіндік береді.
1. 3. Нитрофенол негіздегі суда еритін полимерлердің су
молекуласымен өзара әрекеттесуін есептеу
Осы бағытта атқарылатын жұмыстардың алғашқы сатысы ретінде орто-, пара-нитрофенол және су молекулаларының өзара әрекеттесу модельдері есептелді (1-сурет) .
Суретте су молекулаларының орто-, пара- нитрофенол молекулаларының гидроксил тобында протонакцепторлы (I) және протондонорлы (II) механизмдер бойынша әрекеттесулері кескінделген.
Әрекеттесу нәтижесінде оптимизацияланып табылған r OH,, , О арақашықтығы 0, 247-0, 256 нм аралығында болатын есептеулер көрсетті. Су молекуласының орто- нитрофенолмен өзара әрекеттесу энергиялары 64, 9 кДж/моль (I) және 30, 6 кДж/моль (II) екендіктері анықталды. Есептеулердің көрсеткеніндей, су молекуласы мен орынбасқан фенол молекуласының гидроксил тобы протонакцепторлы механизм бойынша өзара әрекеттесуі тиімдірек екені көрінеді.
Орто-, пара-нитрофенол және су молекулаларыньщ өзара әрекеттесу модельдері
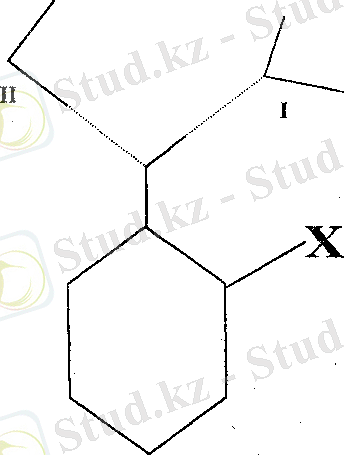
Х X=N0 2
1-сурет
Сонымен, орто-, пара- нитрофенол негізіндегі синтезделген суда еритін полимерлердің модельдері ретінде алынған молекулалық модельдердің электрондық құрылысын есептеулер суда орын алатын әрекеттесулердің табиғатын анықтауда, тәжірибелік мәліметтермен сәйкестігі жақсы нәтижелер берді.
Алдағы зерттеу жұмыстары молекулалық модельдерді кеңейтіп жетілдіру бағытында жүргізілетін болады.
Есептеу нәтижелерін талдай келіп келесі қорытындылар жасадық.
1. Суда еритін нитрофенол негіздегі полимерлер орто- және пара- нитрофенол молекулалары арқылы модельденді.
2. Модельдердің электрондық құрылысы жартылай эмпирикалық квантты химиялық ППДП/2 әдісімен есептелді.
3. Суда еритін полимерлердің модельдерінің су молекуласымен өзара әрекеттесу энергиялары есептеліп табылды.
4. Су молекуласының орто- нитрофенол молекуласының гидроксил тобында протонакцепторлы механизм бойынша әрекеттесуі тиімді екендігі тағайындалды.
1. 4. Квантты химияның есептеу әдістері.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz