Тірі ағзадағы органикалық биополимерлер: белоктар, полисахаридтер және нуклеин қышқылдарының құрылымы мен қасиеттері


Тақырыбы: Тірі ағзадағы органикалық биополимерлер.
Мақсаты: дәріс соңында тіршілік процесіне қатысатын белоктар, полисахаридтер және нуклеин қышқылы маңызды биополимерлердің құрылымы және негізігі химиялық айналулардың қағидаларын білуі керек.
Дәріс жоспары:
- Тірі ағзадағы биополимерлер. Гетерофункционалды қосылыстар.
- Пептидтер. Белоктар. Белоктардың құрылымдық ұйымы.
- Көмірсулар. Полисахаридтер.
- Нуклеин қышқылдарының құрылымы.
Дәріс тезистері.
Академик В. И. Вернадскийдің есебі бойынша жер жүзіндегі тірі организмдердің салмағы 10 17 т. тең екен. Ал осы барлық тірі организмдердің негізгі құрамды бөлігі белок. Тіршілік ету процестерін зерттеу жұмыстары олардың өмірінде нуклейн қышқылдарының, белоктардың жаңаруы, күрделілігі, шексіз әр-түрлілігі, маңыздылығының ерекше екендігін көрсетеді.
Ф. Энгельс өзінің «Табиғат диалектикасы» еңбегінде: «Өмір дегеніміз - белокты денелердің қмір сүру тәсілі, яғни организмдегі зат алмасудың қоршаған ортамен тығыз байланысы», - деп жазды. Басқаша айтқанда белок - барлық тірінің материалдық негізі болса, ал олардың тіршілік ету тәсілі - өмір болып табылады.
Белоктардың «белок» деп аталуы олардың тауық жұмыртқасы белогының қайнап денатурацияланған кез - ақ тығыз массаға айналуынан шыққан. Оның басқаша аты протеин ( protos - бірінші, маңызды латын сөзінен алынған) . Бұл атты Голландия ғалымы Ж. Мульдер берген.
Белоктардың тірі организмдер үшін алатын орны:
- Белок - генетикалық ақпаратты жеткізуге қолданылатын молекулалық құрал. Белоктардың маңызды қызметтерінің бірі олар түзу сызықтық РНҚ - дағы генетикалық хабарды үш өлшемдік, яғни кеңістіктік хабарға айналдыратын химиялық материал болып табылады. Ал бұл үш өлшемдік, яғни кеңістіктік хабар тірі организмдердің макромолекулалық, субклеткалық компоненттеріне тән, Міне, белоктардың бір осы қасиеті ғана, олардың қаншалықты маңызды екендігін көрсетеді.
- Белок - күрделі заттардың жай қарапайым заттарға дейін тотығуына қатысатын және жай заттардан күрделі заттардың түзілуіне қатысатын фермент.
- Белок - адам организмін микробтардан, ауру туғызушы агенттерден сақтайтын антидене.
- Актин, миозин сияқты белоктар бірімен - бірі АТФ - тың қатысуымен әрекеттесіп, бұлшықеттерінің жиырылуы сияқты қызмет атқарады.
- Көптеген белоктар/инсулин, глюкагон, гипофиздің тропты гормондары/сыртқы ортаның әсеріне сәйкес, тірі органимдегі процестерді реттеп отырады.
- Белоктардың бір тобы - гемоглобин, қан плазмасының белоктары альбумин, глобулин тасымалдау қызметін атқарады. Сонымен белоктар тіршілік етудің: ас қорыту, тітіркену, өсу, көбею, қозғалу сияқты барлық құбылыстарына қатысып, тірі организмнің тіршілігінің көзі болып табылады.
Белоктардың элементтік құрамы:
C - 50 - 55%
N - 15 - 18%
О - 21 - 24%
Н - 6 - 7, 50%
S - 0, 3 - 2, 5%
Бұлардан басқа P (2%=ке тең) , Cu, Mn, Fe, Co т. б. элементтер кездеседі. Белоктардың молекулалық салмағы 12 - 13000 - нан / жай белоктарда / бірнеше миллионға дейін / күрделі белоктарда / жетеді.
Сондықтан белоктардың молекулалық салмағын анықтау көптеген қиындықтар туғызады. Жай заттардың молекулалық салмағын анықтауға қолданып жүрген классикалық физикалық - химиялық әдістер, белоктардың ерекше қасиеттеріне сәйкес, олардың молекулалық салмағын анықтау үшін жарамсыз болды. Тек қана ХlХ ғасырда ультрацентртифуганың жасалуына сәйкес, ультрацентрифугалық әдіс дами бастады. Осы әдіс арқылы центрден тепкіш күшке байланысты белоктардың тұнбаға түсу жылдамдығының әртүрлілігімен сәйкес, олардың молекулалық салмағын дәл анықтауға мүмкіндік туды. Қазіргі кезде бұдан басқа гельфильтрация, электрофорез әдістері де қолданылады.
Ақуыздардың химиялық құрылысы
Элементтің құрамының қарапайымдылығына қарамастан белоктар өте күрделі полимерлік қосылыстар. Белок макромолекулалар қарапайым амин қышқылдарынан тұрады, Бұл ең алғаш 1820 ж. А. Браконноның жұмыстарынан көріне бастады. Ол желаминді қышқылдық ортада гидролизденгенде дәмі тәтті аминсірке қышқылы түзгендігін байқады. Бұл гликокол яғни глицин деп атады. Бұл аминқышқылдарының ең қарапайым өкілі:
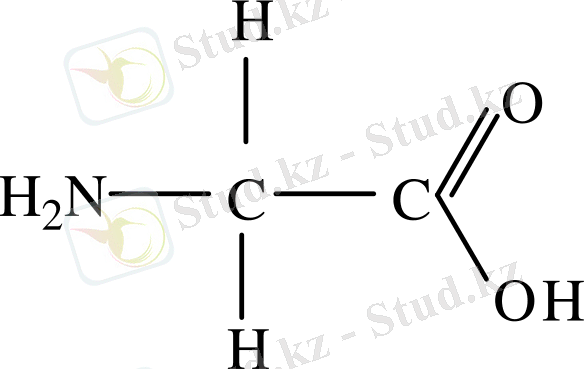
1871 жылы Н. Н. Любавин сүт белогы казейынның ас қорыту сөлінің қатысуымен ферменттік гидролиз амин қышқылдарына ыдырайтындығын ашты.
1901-1902 ж. Э. Фишер белоктардың қышқылдың қатысуымен 10-16 сағат ішінде қыздырңанда гидролизге түсетіндігін ашты, міне, осы уақыттан бастап белоктың химиялық құрамын анықтау барысында жуйелі жұмыстар істеліне бастады.
Қазіргі кезде белок ыдырауының сілтінің немесе ферменттің қатысуымен жүретін жолдар да белгілі, Бұл әдістердің әрқайсысынығ өзінің кемшіліктері мен жетістңктері бар. Сондықтан белок құрамын анықтауда осы үш әдіспен алынған нәтижелерді біріктіріп барып қорытынды жасайды.
Белоктың ыдырауынан түзілген амин қышқылдарын хроматография, элекрофорез әдістерімен әрі қарай зерттейді.
Амин қышқылдар белок молекулаларының құрамды болігі. Олар органикалық қышқылдардың аминді қышқылдардың аминді туындылары болып табылады. Мысалы:
СН 3 - COOH
сірке қышқылы
CH 3 -CH 2 -COOH
пропион қышқылы
CH 3 -(CH 2 ) 2 - COOH
май қышқылы
CH 3 (CH 2 ) 3 -COOH
Валериан қышқылы
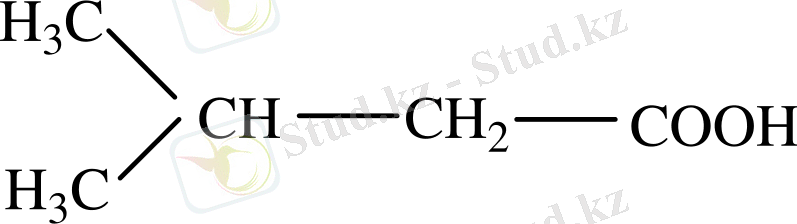
Изовалериан қышқылы
CH 3 - (CH 2 ) 4 - COOH
капрон қышқылы
Бұл қышқылдардың құрамындағы СООН тобымен байланысқан.
Альфа көміртегідегі сутек атомы NH 2 - тобымен байланысқан.
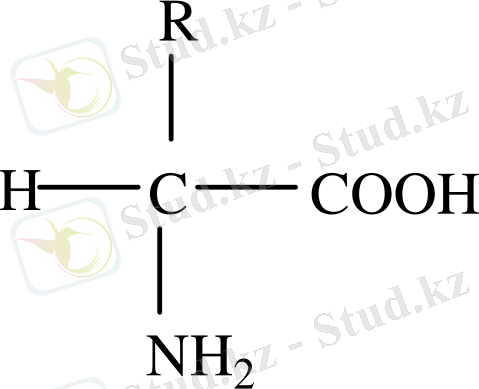
Сонымен, барлық белок құрамындағы амин қышқылы альфа амин қышқылы болып табылады. Белок құрамындағы 20-ға жуық амин қышқылдары кездеседі.
α-Аминқышқылдар
2. CH 3 −
3. (CH 3 ) 2 CH −
аланин
валин
Ала -
Вал -
18.
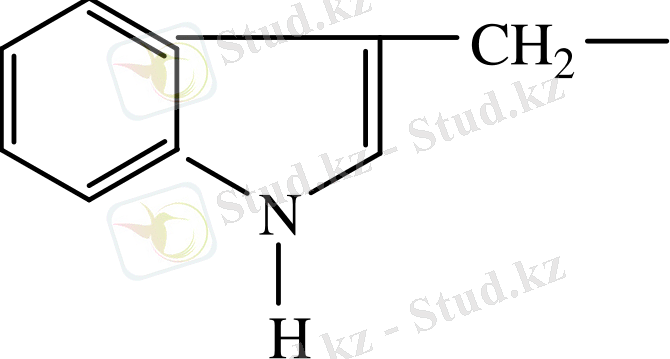
19.
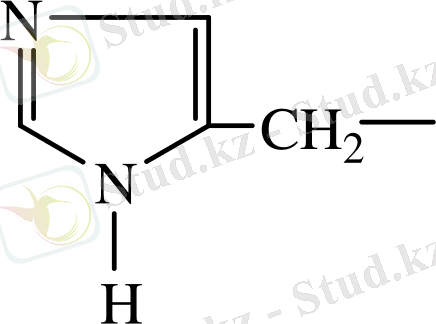
20.
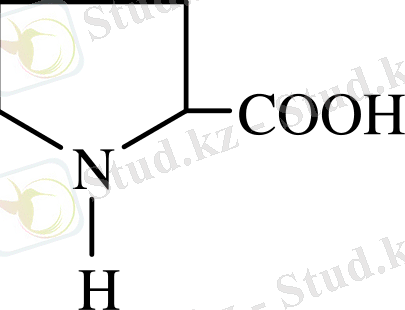
Олар төмендегідей болады:
- Ациклді, яғни циклді емес амин қышқылдары (14 амин қышқылы) . Бұл амин қышқылдарының өзі: а) моноаминді монокарбон қышқылдары (8 амин қышқылы) лей, иле, вал, т. б. ) диаминді монокарбон қышқылдары (4 амин қышқылы - орнитин, лизин, аргинин, гидроксилизин) ; в) моноаминді дикарбон қышқылдары (2 амин қышқылы) аспарагин, глютамин қышқылдары болып бөлінеді.
- Циклді амин қышқылдарына 4 амин қышқылы жатады, бұлар да екі топтан тұрады: а) гомоциклді - 2 амин қышқылы (фенилаланин, тирозин; б) гетероцилді - 2 амин қышқылы (триптофан, гистидин) .
- Иминоқышқылдар - 2 (оксипролин, пролин) .

Физикалық қасиеттері
Барлық табиғи ақ түссіз кристалды заттар, көбінесе дәмсіз, кейбір амин қышқылдарының ащы дәмі бар, тек қана глициннің дәмі тәтті. Амин қышқылдарының судағы ерітінділері нейтралды, әлсіз қышқылдық және әлсіз сілтілік қасиет көрсетеді. Белок құрамындағы барлық α-амин қышқылдары оптикалық активті заттар (глициннен басқасы) және L-қатарына жатады.
Мысалы: L (+) аланин
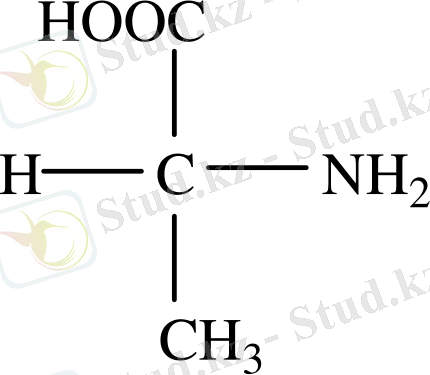
Ал Д - қатарына жататын амин қышқылдары дәмі тәтті, бірақ ферменнтер стереоталғамдық қасиет көрсететін болғандықтан тірі ағзада да сіңірілмейді.
Мысалы: Д (−) аланин
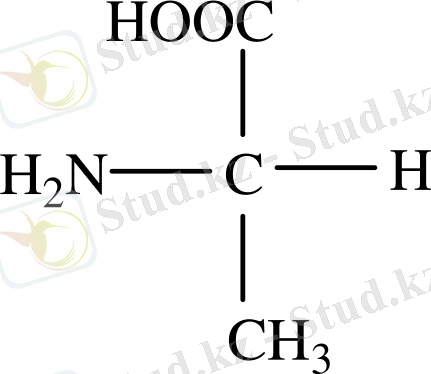
Химиялық қасиеттері
- Амин қышқылдары амфотерлік қасиет көрсетеді.
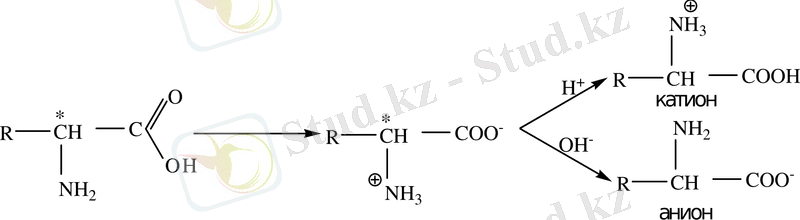
Амин қышқылдарының бұл қасиеттері белоктарға да тән. Әрбір амин қышқылының амфион түзетін рН-ы болады.
- Амин қышқылдары, бір амин қышқылының СООН тобының және екінші амин қышқылының NH2тобының есебінен су молекуласын бөліп шығарып, пептидтік байланыс арқылы өзара байланысып, пептид түзеді.
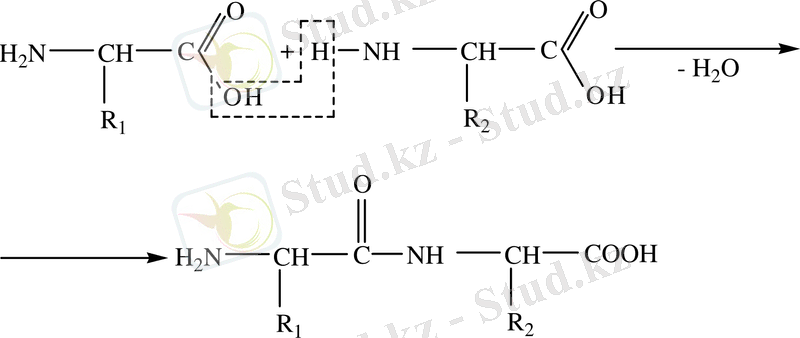
дипептид
Пептидтік байланыстың бар екендігін биурет реакциясы арқылы дәлелдеуге болады.
(CuSO 4 + NaOH + белок) күлгін көк түсті ерітінді. Пептидтік байланыс арқылы бірнеше амин қышқылдары бірімен-бірі байланысып трипептид, тетра-, пента-, . . . полипептид түзеді. Белоктың полипептид тізбегі жалпы түрде:
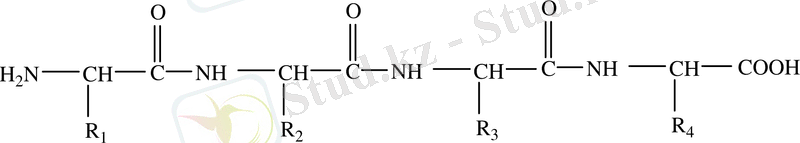
деп көрсетуге болады.
Сонымен белок дегеніміз өзара пептидтік байланыспен байланысқан L-, α- амин қышқылдарынан тұратынан полимер.
Ақуыздардың кеңістіктегі орналасуы
Белоктардың І-ші реттік құрылысы (түзу сызықтық) . Белоктардың І-ші реттік құрылысы деп амин қышқылдарының өзара пептидтік байланыс арқылы тізбек құруын айтады.
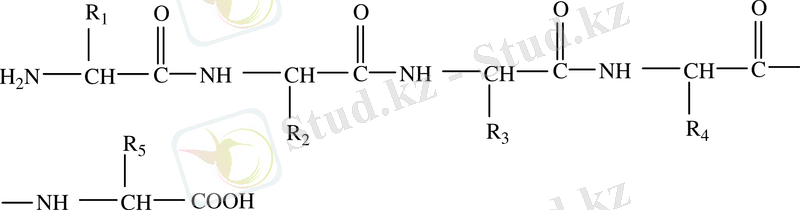
Әртүрлі белок құрамындағы амин қышқылдарының түрі де, саны да түрліше болып келуі мүмкін.
Мыс: гемоглобин - 574 ақ, оның 3-цис, 22-лиз
РНК - аза фермент-124 оның 8-цис, 9-лиз
Инсулин (гормон) - 51ақ, оның 6-цис, 1-лиз.
Ал кейбір белоктар құрамындағы амин қышқылдарының саны мен түрі бірдей болуы мүмкін. Бірақ белоктың қасиетін, қызметін, оның ерекшелігін анықтайтын - амин қышқылдарының полипептидтік тізбектегі алатын орны болып есептелінеді, міне белоктардың осы құрылысы, олардың І-ші реттік құрылымы деп аталынады.
Бірдей әріптерден, мазмұны әртүрлі сөздерді құрауға болатыны сияқты, 20-ға жуық амин қышқылдарынан әртүрлі белоктар түзіледі. Белоктардың бірінші реттік құрылымы берік коваленттік байланыс - пептидтік байланыс құрайды.
Белоктардың бірінші реттік құрылысының өзгеруі (амин қышқылдардың орнын өзгертуі) олардың қасиетінің күрт өзгеруіне әкеп соқтырады.
Ақуыздардың амфотерлігі
Белоктардың қышқылдық-негіздік қасиет көрсетуі олардың құрамындағы амин қышқылдары қалдықтарының құрамындағы ион түзуші радикалдарының санына тәуелді, шеткейлік NH 2 − тобымен, −COOH топтарының белок амфотерлік қасиетіне қосатын үлесі аз.
Белоктардың ионизациялануына қатысатын негізгі топтар:
- Қышқылдық қасиет беретін топтар (сілтілік ортада теріс заряд береді)
−COOH (шеткейлік топ, аспарагин және глутамин қышқылдарының радикалдары)
- Негіздік қасиет беретін топтар (қышқылдық ортада оң заряд береді)
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz