Mn2+, Fe3+, Co2+, Ni2+ иондарының полиакриламид пен төменмолекулалы лигандтармен комплекстелуінің физика-химиялық зерттелуі


ӘЛ-ФАРАБИ АТЫНДАҒЫ ҚАЗАҚ ҰЛТТЫҚ УНИВЕРСИТЕТІ
ХИМИЯ ФАКУЛЬТЕТІ
МАГИСТРАТУРА
Физикалық химия және электрохимия кафедрасы
ДИССЕРТАЦИЯЛЫҚ ЖҰМЫС
Mn 2+ , Fe 3+ , Co 2+ , Ni 2+ ИОНДАРЫНЫҢ КЕЙБІР ПОЛИМЕРЛІ ЖӘНЕ ТӨМЕН МОЛЕКУЛАЛЫ ЛИГАНДТАРМЕН КОМПЛЕКСТҮЗІЛУІ
Орындаушы: Үсіпбекова Е. Ж. 2009ж.
Ғылыми жетекшілер:
х. ғ. д., профессор Оспанова Ә. Қ.
х. ғ. к., доцент Сейлханова Г. А.
2009ж.
Қорғауға жіберілді:
Кафедра меңгерушісі,
х. ғ. д., профессор Алдабергенов М. Қ.
2009ж.
Алматы, 2009
МАЗМҰНЫ
ҚЫСҚАРТУЛАР, БЕЛГІЛЕУЛЕР, СИМВОЛДАР
ПАА - полиакриламид;
ПЭИ - полиэтиленимин;
Na 2 edta 2- - қышқылының екі натрий тұзы (комплексон III) ;
ЭДТА - қышқылы;
Sal - салицил қышқылы;
Ssal - сульфосалицил қышқылы;
ПМК - полимерметалды комплекс;
ТМЛ - төменмолекулалы лиганд;
lg β - тұрақтылық константасы;
lg β о - стандартты термодинамикалық тұрақтылық константасы;
k - металл концентрациясының ПАА концентрациясына қатынасы;
η - тұтқырлық;
n - Бьеррумның түзілу функциясы.
РЕФЕРАТ
Диссертация изложена на 47 с., содержит 16 рис., 14 табл., 78 источников литературы.
ПОЛИАКРИЛАМИД, ПОЛИЭТИЛЕНИМИН, СИСТЕМА, КОМПЛЕКСОБРАЗОВАНИЯ, РН СРЕДЫ, ВЯЗКОСТЬ, ИОННАЯ СИЛА, ТЕМПЕРАТУРА, ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ, СУЛЬФОСАЛИЦИЛОВАЯ, САЛИЦИЛОВАЯ КИСЛОТА, ДВОЙНАЯ И ТРОЙНАЯ СИСТЕМА, ТИТРЛЕУ.
Объектами исследования являются полимерметаллические комплексы полиакриламида с ионами Mn 2+, Fe 3+ , Co 2+ , Ni 2+ в двойных системах, а также с некоторыми низкомолекулярными лигандами, как сульфосалициловая, салициловая кислоты и трилон Б в тройных системах.
Цель диссертаций - установление закономерности комплексообразования в двойных и тройных системах, содержащих ионы Mn 2+, Fe 3+ , Co 2+ , Ni 2+ , полиакриламид и низкомолекулярные лиганды (сульфосалициловая, салициловая кислоты, трилон Б), определение составов, устойчивости двойных и тройных полимерметаллических комплексов, а также термодинамических параметров процессов их формирования.
В процессе работы использованы потенциометрический, вискозиметрический, методы исследования.
На основании результатов физико-химического исследования определен состав образующихся комплексов. Впервые рассчитаны термодинамические характеристики (∆ r G ○ , ∆ r H ○ , ∆ r S ○ ) исследуемых процессов.
Установлены закономерности взаимодействия между компонентами тройных систем, содержащих ионы Mn 2+ , Co 2+ , Ni 2+ , Fe 3+ , полиакриламид и низкомолекулярные лиганды (H 2 edta 2- , Sal, Ssal) .
На основании экспериментальных данных предложены схемы образования полимерметаллических комплексов двойных, тройных системах.
КІРІСПЕ
Соңғы онжылдықта физика-химиялық сипаттамалары белгілі жаңа полимерметалды комплекстерді синтездеуді жоспарлауда суда еритін полиэлектролиттердің, сонымен қатар металл иондарының тиімді сорбенттерін алу мақсатында төменмолекулалы лигандтардың металл иондарымен әрекеттесу процесін зерттеуге ерекше назар аударылған. Арнайы әрекеттесуге қабілеті бар, әр түрлі функционалдық топтың полимерлі тізбектің құрамына кіретін “полимердің функционализациясы” деген ұғым пайда болды. Полимерлі комплекстер технологиялық ерітінділерден, табиғи және ағын сулардан әр түрлі металл иондарын селективті бөліп алу үшін, катализатор ретінде, мембранды технологияда, медицинада кең қолданылады /1-6/. Ресей, Америка, Жапония, Германия, Қазақстан және басқа да елдерде көптеген ғылыми мектептер полимерлі комплекстерді зерттеу бойынша жұмыс жасайды.
Жұмыста полимерлі лиганд ретінде көптеген ауыспалы металл иондарымен комплекстүзу қабілеті бар полиакриламид (ПАА) қолданылды /7-9/. Берілген макромолекулалы лигандтың комплекстүзу процесінің физика-химиялық зерттеу нәтижелерінің теориялық және практикалық маңызы зор. Полимерлі комплекстің құрамын, құрылысын, сонымен қатар олардың түзілу процесінің термодинамикасын анықтау ғылыми қызығушылық тудырады.
Тиімді әрі салыстырмалы түрде арзан суда еритін полимерге жататын полиакриламидті қолдану оның негізінде қолданбалы қабілеті бар, тиімді полимерлі композиция алуға мүмкіндік береді. Олар қажетті қазбаларды байыту және бөліп алу, тағамдық және өндірістік ағын суларды тазалау үшін жоғары тиімді флокулянттар болып табылады.
Ауыл шаруашылық және жол құрылысында топырақтың құрылымтүзгіші ретінде, мұнай және газ өндірісінде, сұйықтықтың гидравликалық кедергісін төмендететін агенттер, дигидратанттар ретінде кеңінен қолданылады. Қабықтүзгіш ретінде олар минералды тыңайтқыштар өндірісінде мен дәрілік аппараттар жасау үшін, радиоэлектронды өндірістің микросхемасын және фоторезисторлы композицияларды алу үшін қолданылады. Полиакриламид және оның комплекстерін қолдану аймағы осымен шектелмейді.
Осыған байланысты берілген диссертациялық жұмыстың мақсаты құрамында Mn 2+ , Fe 3+ , Co 2+ , Ni 2+ иондары, полиакриламид және төмен молекулалы лигандтар (H2edta 2- , Sal, Ssal) бар қос және үштік жүйелерде комплекстүзудің оптималды жағдайларын, түзілген комплекстерінің құрамын, сонымен қатар олардың түзілуінің термодинамикалық параметрлерінің өзгерістерін анықтау болып табылады.
1 ӘДЕБИ ШОЛУ
1. 1 Бастапқы зерттеу объектілерінің реакцияға түсу қабілеті
Берілген курстық жұмыстың мақсаты кейбір полимерлі лигандтармен Mn 2+ , Fe 3+ , Co 2+ , Ni 2+ иондарының комплекстүзу процесінің термодинамикалық сипаттамасын анықтау болып табылады. Соған байланысты, аталған металл иондарымен бірге жұмыста қолданылған макромолекулалардың да реакциялық қабілеттерін білу маңызды.
Марганец, темір, кобальт және никель Д. И. Менделеев периодтық жүйесінің VII және VIII топтың қосымша топшасының металдары.
Марганец - күмістей ақ металл. Марганец полиморфты және төрт модификациясы бар: α, β, γ, δ. Реттік номері 25, атомдық массасы 54, 9380. Марганец атомының электрондық конфигурациясы 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 . Марганецке тән тотығу дәрежесі +2, бірақ +3, +4, +6, +7 тотығу дәреже көрсететін қосылыстары да кездеседі, мысалы Mn 2 O 3 , MnO 2 , MnO 4 2- , Mn 2 O 7 , MnO 4 - , MnO 3 F т. б.
Марганец ауада, әсіресе дымқыл, жұқа оксид қабықшасымен қапталады. Ұнтақ күйінде тез тотығып және полиморфты болады. Жұқа ұнтақталған марганец аммоний хлориді ерітіндісінде сумен әрекеттеседі, нәтижесінде ерімейтін Mn(OН 2 ) түзіледі. Марганец сұйытылған қышқылдарда, тіпті сірке қышқылында да Mn(II) тұзын және сутек түзе жақсы ериді:
Mn + 2Н + → Mn 2+ + Н 2
Mn(II) тұздары қызғылт түсті және суда жақсы ериді. Марганец галогендермен, азотпен, бор және кремниймен әрекеттесіп, сәйкес қосылыстар - галогенидтер, нитридтер, боридтер және силицидтер түзеді.
Темір - қиын балқитын, жарқыраған күмістей ақ активті металл. Физикалық қасиеті жағынан темір жұмсақ, қақтауға төзімді және күшті магнитті қасиеті бар, полиморфты кристалдар түзгіш. Реттік номері 26, атомдық массасы 55, 47. Темір атомының электрондық конфигурациясы 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 . Темірдің тотығу дәрәжесі +2, +3 және +6 болатын қосылыстары кездеседі, мысалы Ғе 2+ , Ғе 3+ және ҒеО 4 2- қосылыстары. Темір оттегіде аралас Ғе 3 О 4 оксидін түзе жанады. Ылғалды ауа әсерінен темір тотығып, оның беті темірдің (ІІІ) гидраттанған тотығынан тұратын тат қабатымен қапталады.
Темір (ІІІ) гидраттанған ионы Fe(Н 2 О) 6 3+ ерітіндіге сұр-күлгін түс береді. Бірақ бұл ион протонын оңай беретіндіктен темірдің (ІІІ) тұздары ерітіндіде сары және қоңыр түсті болады, ол гидрокси комплекстің түзілуімен түсіндіріледі. Fe 3+ және Fe 3+ ионы бар ерітіндіге цианид-ионын қосқанда тұнба түзіледі, бірақ цианидтің артық мөлшерінде еріп кетеді. Калий (ІІ) гексацианоферратының K 4 Fe(CN) 6 ⋅3H 2 O сары кристалдары органикалық заттарды қыздырғанда түзіледі. Затты қыздырғаннан кейін ыстық сумен экстракциялайды, нәтижесінде калий (ІІ) гексацианоферратының кристалдары түзіледі. Калий (ІІІ) гексацианоферраты K 3 Fe(CN) 6 қызыл кристалл ретінде K 4 Fe(CN) 6 -тың тотығуы нәтижесінде түзіледі.
Кобальт - әлсіз қызыл түсі бар күмістей ақ металл. Темірге қарағанда активтігі аз. Реттік номері 27, атомдық массасы 58, 93. Кобальт атомының электрондық конфигурациясы 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4s 2 . Кобальтқа тән тотығу дәрежесі +2 +3.
Кобальт (ІІ) ионы Со(Н 2 О) 6 2+ ерітіндіде және гидраттанған тұзында қызыл немесе ашық қызғылт түсте болады. Кобальт (ІІ) хлориді СоСl 2 ⋅6H 2 O қызыл кристалдар түзеді, дегидратация нәтижесінде қара-көк ұнтаққа айналады. Кобальттың (ІІІ) иондары тұрақсыз; кобальт (ІІ) иондарын тотықтырғанда кобальт (ІІІ) гидроксиді Со(ОН) 3 тұнады. Кобальттың (ІІІ) ковалентті қосылыстары тұрақтылығымен сипатталады. Олардың ішінде ең маңыздылары- калий (ІІІ) гексанитрокобальтаты К 3 Со(NО 2 ) 6 және калий (ІІІ) гексацианоферраты К 3 Со(СN) 6 .
Никель - күмістей ақ металл, өте созылғыш, қақтауға төзімді, ферромагнитті металл. Реттік номері 28, атомдық массасы 58, 71. Никель атомының электрондық конфигурациясы 1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 4s 2 . Көптеген қосылыстарда никель екі валентті, бірақ +3, +4 тотығу дәрежесін көрсететін қосылыстары бар. Металды никель бөлме температурасында ылғалсыз жерде оттегі мен галиод әсеріне тұрақты. Никель активтігі аз металл, бөлме температурасында су оған әсер етпейді. Сұйытылған минералды қышқылдарда (НСl, Н 2 SО 4 ) аздап ериді, НNО 3 -те жақсы ериді. Сулы ерітіндіде және құймаларда концентрлі Н 2 SО 4 металды пассивтейді, сілтілер, сода никельге әсер етпейді. Никельдің гидраттанған тұздары, мысалы NiSO 4 ⋅6H 2 O және NiСl 2 ⋅6H 2 O жасыл түсті. Ni(ІІ) ионы бар ерітндіге сілті қосқанда ашық жасыл түсті никель (ІІ) гидроксиді Ni(ОН) 2 түзіледі. Егер никель (ІІ) гидроксидін қыздырса, ерімейтін жасыл түсті қосылыс - NiО түзіледі. Никель (ІІ) гидроксиді аммоний гидроксидінде еріп, мынадай аммиакты комплекс түзеді: Ni(NН 3 ) 4 (Н 2 О) 2 2+ және Ni(NН 3 ) 6 2+ .
Металдардың химиялық қасиеттері жағынан рет номері өскен сайын химиялық белсенділігі төмендейді, себебі d-қатпарында электрон саны өскенде олардың тұрақтылығы артады. Темір топшасы металдары галогендер, көміртек, фосфор, күкірт және кремниймен әрекеттесіп, сәйкес галогенидтер (МГ 2 , МГ 3 ), карбид (М 2 С, М 3 С), фосфид (М 3 Р, МР 2 , М 2 Р, МР), сульфид(МS, М 2 S 3 , МS 2 , М 3 S 4 ) және силицидтер (М 3 S ) түзеді. Сутекпен темір, никель және кобальт тікелей қосылыспайды, бірақ қатты және балқыған күйде оны өзінде еріте алады. Азотпен де тікелей қосылыспайды, құрамы Ғе 4 N, Ғе 2 N, Со 3 N, Ni 3 N болатын нитридтерді жанама жолмен алады.
Марганец, темір, кобальт және никель металл иондарының кейбір негізгі физикалық шамалары 1-кестеде берілген.
Кесте 1- Марганец, темір, кобальт және никель элементтерінің негізгі физикалық константалары /10/
Полиакриламид [-CH 2 -CH-] - ақ түсті иіссіз полимер, суда,
׀
OCNH
2
формамидте, мұзды сірке және сүт қышқылында, глицеринде ериді, прапион қышқылында, пропиленгликольде, диэтилсульфоксидте ісінеді, метаноль, этаноль, ацетон, гександа ерімейді. Шынылану температурасы ~200°С, мольдік массасы ~1⋅106; [η] =3. 73⋅10-4
 0. 66 (1н. NaNO
3
ерітіндісінде, 30 оС-де орташа массалы) ; [η] =6, 8⋅10-4
0. 66 (1н. NaNO
3
ерітіндісінде, 30 оС-де орташа массалы) ; [η] =6, 8⋅10-4
 0. 66 ( 25 оС H
2
O, орташа санды) ; [η] =6, 31⋅10-5
0. 66 ( 25 оС H
2
O, орташа санды) ; [η] =6, 31⋅10-5
 0. 80 ( 25
о
С H
2
O седиментация бойынша) .
0. 80 ( 25
о
С H
2
O седиментация бойынша) .
Полиакриламидтің химиялық қасиеті амид тобының жағдайына байланысты анықталады. ПАА сулы ерітіндісінде бөлме температурасында гидролизге тұрақты, бірақ жоғары температурада (≥93ºС) гидролиздеуші агенттердің қатысуынсыз белгілі жылдамдықпен гидролиз жүреді. Қышқылдық ортада ПАА-ның гидролиз реакциясы келесі түрде:
-(-СН 2 -СН-) n- +mH 2 O → -(-СН 2 -СН-) n-m- (-CH 2 -CH-) m+mNH 3
CONH 2 CONH 2 COOH
Гидролиздеуші реагент ретінде көптеген төменмолекулалы (Н 2 SО 4 , НCl, Н 3 РО 4 және т. б) және полисульфон қышқылы қолданады. ПАА-ның қышқыл қатысында гидролиз дәрежесі жоғары мән көрсетеді. ПАА-ның қышқылды гидролизінің кинетикасын 0, 05 М ацетонды буферде 18ºС-де Сметс пен Хасбейн зерттеген. Гидролиздің бастапқы жылдамдығы жоғары емес (жылдамдық константасы 2, 6⋅10-2 с-1) және буферлі ерітіндідегі сірке қышқылының концентрациясына тәуелді. Айналу дәрежесі 3-5% болғанда гидролиз автокаталитикалық түрде жылдамдайды. Полимердің қышқылды гидролизі реакциясының жылдамдығының тиімділігі оң зарядталған азот атомы мен гидролиз жүргізетін гидроксоний ионы Н 3 О + арасында электрастатикалық тебілудің баяу эффектісімен компенсирленеді:
~СН 2 -СН~ + НСl → ~ СН 2 -СН ~
СОNH 2 CONH 3 + Cl -
ПАА-ның қышқылды гидролизінің негізгі ерекшелігі имидизация жүруінен аз және толық суда ерімейтін реакцияның өнімдерінің түзілуі болып табылады, ол үшөлшемді құрылымның түзілуіне әкеледі.
Әр түрлі амидтердің (Е Н + ) және сілтілік (Е ОН - ) гидролиздің активтену энергиясын қарастырғанда ПАА үшін ΔЕ= Е Н + - Е ОН - айырмасы аз болады (ΔЕ= 28, 8 кДж/моль) . Басқа зерттелген полимерлер мен төменмолекулалы амидтер үшін ΔЕ 8-18 кДж/моль аралығында болады, ПАА үшін имидизация процесінің активтену энергиясы гидролизінің активтену энергиясынан жоғары.
ПАА-ның сілтілік гидролизінде АА сополимерінің АК тұздарымен тізбегінде буынының статикалық таралуы бар макромолекулалар түзіледі. ПАА-ның сілтілік гидролизінің реакциясы келесі түрде:
-(-СН 2 -СН-) n-+mNaOH→-(-СН 2 -СН-) n-m-(-СН 2 -СН-) m-+NH 3
CONH 2 CONH 2 COO - Na +
ПАА-ның гидролизін қарастырғанда ПАА үшін төменмолекулалы амидтермен салыстырғанда (изобутирамид және глутарамид) негізгі гидролиздің екі сатысын бөліп қарастыруға болады. Жылдам жүретін бірінші саты карбоксилатты амид тобының 40%-ті амид тобына айналғанда аяқталады. Осы сатыда гидролиз жылдамдығы бірінші дәрежедегі полимердің концентрациясына және бірінші дәрежедегі гидролиздейтін реагенттердің концентрациясына тәуелді, яғни ПАА-ның сілтілік гидролизі екінші ретті реакция болып табылады. Ал екінші сатысы сілтінің артық мөлшеріне қарамастан біріншіге қарағанда он есе аз жүреді және гидролиз дәрежесі 70 % болғанда аяқталады /9/.
Полиакриламидті 100
о
С -тан жоғары қыздырғанда имидизация әсерінен және тігілген құрылымның пайда болуынан азоттың мөлшері азаяды. Сулы (20
о
С, рН 8-10) ерітіндіде немесе сусыз ортада полиакриламид әсерінен метилдену жүреді: -CONH
2
+CH
2
O
 CONHCH
2
OH
CONHCH
2
OH
Полиметилметакриламид немесе оның ерітінділерін қыздырғанда немесе тотықтырғанда эфирлі көпірлі (-CONHCH 2 -O-CH 2 NHCO-) және метиленді көпірлі (-CONH-CH 2 -NHCO-) үшөлшемді құрылым түзіледі. Полиакриламидке этилен тотығы қосылады:
-CONH
2
+ CH
2
- CH
2
-О
 CONHCH
2
- CH
2
- OH
CONHCH
2
- CH
2
- OH
Полиакриламид және оның бейтарап ерітінділері кәдімгі жағдайда сақтауға тұрақты. Полиакриламид және оның туындылары таулы жыныстарды шығару және химиялық өндірісте, түсті металлургияда коагулянт (флокулянт) ретінде, сонымен қатар қағаздардың қаттылығын жоғарылату үшін, тканьдерды апператтау үшін қолданылады. Таза акриламидтің метилендиакриламидпен аз мөлшерімен сополимеризациясын мұнай скважиналарын бекіту үшін қолданылады. Полиакриламид және оның акрил қышқылымен сополимерлерін грунттарды қаттылату үшін құрылымтүзгіш ретінде қолданады. Полиакриламид салыстырмалы арзан, суда жақсы еритін, қолданбалы маңызы бар комплекстүзгіш полимерлер қатарына жатады. Бүгінде техника мен технологияның барлық салаларында полиакриламидті реагенттер қолданылады. Атап айтсақ, полиакриламид пайдалы қазбаларды бөлу және байытуда, ағынды және ауыз суды тазартуда жоғары эффективті флокулянт болып табылады. Олар бұрғылау ерітінділерін, дегидраттарды қоюлатуда, мұнай және газ өндірісінде сұйықтықтың гидравликалық кедергісін төмендетуде, ауылшаруашылық және жол құрылысында топырақтың құрылым түзілуінде кең қолданыс тапты. Жұқа қабықша ретінде минералды тыңайтқыштар және дәрі жасау өндірісінде, фоторезистрлі композициялар және микросызбалар жасауда радио-электронды өндірісінде пайдаланылады. Мұның бәрі полиакриламид және оның поликомплекстерінің қолданылуының толық мәліметі емес/9/
1. 2 Mn 2+ , Fe 3+ , Co 2+ , Ni 2+ металл иондарының құрамында S-, N-, О- бар төмен және жоғарымолекулалы лигандалармен комплекстүзуі
Mn 2+ , Fe 3+ , Co 2+ , Ni 2+ иондарының жоғары молекулалы лигандтармен қосылыстары - комплексті қосылыстардың кең тараған класы, ол тек химиялық байланыс теориясы, координациялық химияда ғана маңызды емес, сонымен қатар қолданбалы мәні бар.
Марганецтің көптеген координациялық қосылыстары биологиялық активті және антимикробты препарат ретінде табылған. /11/ автор жұмысында Mn(II) -тің гидантоинмен комплексті қосылыстары синтезделген және зерттелген:
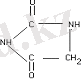
Алынған қосылыстың құрамы мына формулаға сәйкес келеді: MnL 2 Cl 2 ⋅H 2 O, MnL 2 (NCS) ⋅C 2 H 5 OH, MnL 2 SO 4 ⋅2H 2 O және MnL 2 (CH 3 COO) 2 , мұндағы L-гидантоин молекуласы. Бұл қосылыс гидантоинмен Mn(II) -тің ацетаты, сульфаты, роданиді, хлориді әрекеттескенде түзіледі. Алынған қосылыстың кристалдық құрылысы бар, ауада тұрақты, суда ериді және кәдімгі органикалық еріткіштерде қиын немесе мүлде ерімейді. Гидантоиннің молекуласы синтезделген қосылыстарда бидентатты-көпірлі лигандтың ролін атқарады және карбонил тобындағы оттегінің екі атомы арқылы марганецтің екі атомымен байланысқан. Мn(II) атомының айналасындағы координациялық полиэдр - бұрыс октаэдр және ацидотоп пен гидантоинның төрт көпірлі молекуласындағы төрт оттегі атомынан түзілген. Мn(II) -тің тиокарбамидпен көптеген комплексті қосылыстары белгілі, бірақ соңғы соңғы кезге дейін Мn(II) -тің ацетатотиокарбамидті комплекстерін алу мүмкін болмады. /12/ автордың жұмысында екі жаңа ацетатотиокарбамидті комплекс қарастырылған, комплекстің құрамы МnL 2 (CH3COO) 2 ⋅2H 2 O, мұнда L - SC(NH 2 ) 2 тиокарбамид молекуласы, олардың кейбір қасиеттері МnL 2 (CH 3 COO) 2 ⋅H 2 O және термиялық айрылу процестері зерттелген. Тәжірибе нәтижелері Мn(II) -тің ацетатотиокарбамидті комплексін алғанда құрамында гидантоиннің екі немесе төрт молекуласы Мn(II) -тің атомына келетін бастапқы компоненттер - Мn(II) ацетаты мен тиокарбамидтің қатынастарына тәуелді әр түрлі құрамда қосылыстарды бөлуге болатынын көрсетті. /13-14/ жұмыстарда рентгенқұрылымды анализбен [Mn(OHK) 2 (H 2 O) 4] (NO 3 ) 2 (ОНК - N-оксиметиламид никотин қышқылы) комплексі зерттелген. Комплекс дискретті иондардан құрылған, мұнда марганец атомы инверсия центрінде орналасқан және октаэдрлік координацияда болады. ОНК лигандтары пиридинді N атомы арқылы монодентатты координацияланған. Екі пиридинді N атомы екі монодентатты координацияланған ОНК молекуласы және төрт молекулалы судың оттегі атомдары арқылы түзілген КО[Mn(OHK) 2 (H 2 O) 4 ] (NO 3 ) 2 комплексінде марганец атомы әлсіз бұрыс транс - октаэдрлі координацияда болады.
Сульфосалицил (НО-С 6 Н 3 -(SО 3 Н) (СООН) ) және салицил (НО -С 6 Н 4 -СООН) қышқылдарының құрамында электрон донорлы атомдары бар, сондықтан жақсы комплекстүзуші қабілеті бар. Бұл қышқылдардың жеке сипаттамалық ерекшеліктері болғанымен, комплекстүзу кезінде ұқсас қасиет көрсетеді. /15/ автор жұмысында сульфосалицилат анионы үш протон қосып алатыны және осыған байланысты рН-метрлік титрлеу қисығында үш протондау константасы есептелген.
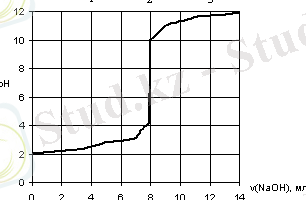
Сурет 1 - Сульфосалицил қышқылының рН-метрлік титрлеу қисығы
Суреттен көрініп тұрғандай титрлеу қисығында бірінші және екінші кесіндісі арасындағы титрлеу қисығында иілу нүктесі жоқ, бұл үшінші және екінші протондау константасының (сульфосалицил қышқылының бірінші және екінші диссоциациялану константасы) мәндері жақын деген сөз. Константалар Шварценбах әдісімен есептелген. Төменде алынған протондау константаларының мәндері келтірілген: lgK 3 <1; lgK 2 =2, 64; lgK 1 =11, 62 (I= 0, 1)
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz