Золь-гель әдісімен синтезделген аморфты кальций және кальций-магний фосфаттарының қыздырған кездегі табиғаты, фазалық трансформациялары және тесікті керамикаға өтуі


Қазақ Мемлекеттік Қыздар Педагогикалық Институты
Жаратылыстану факультеті
Химия кафедрасы
Тақырыбы; Кальций фосфатын қыздырған кездегі табиғаты мен құбылысы
Орындаған;
“ “ маусым 2008 Аққоянова Ш
Ғылыми жетекшісі
х. ғ. к доц қ. а Алдабергенова М
Ғылыми кеңесші Асанова Г
Қорғауға жіберілді
химия кафедрасының Матаев М. М
меңгерушісі х. ғ. к. доц
“ “ маусым 2008
Кіріспе.
Тақырыптың өзектілігі : Жағымсыз әрі күннен-күнге ластанып бара жатқан қоршаған орта, дұрыс тамақтанбау, стрестер мен басқа да факторлар адамның тіс, жақ сүйек ауруларының таралуына себеп болады. Бұл дүние жүзілік және отандық медицина саласында адамның сүйек ұлпаларының ауруларын емдеу үшін жаңа дәрілік препараттар алудың қажеттілігінің негізгі себебі.
Негізінен тістің минералдық қаңқасын құрайтын кальцийдің фосфор қышқылды тұзы- гидроксиапатит, яғни қазіргі заманғы зерттеулердің нәтижесі бойынша осы қосылыс сүйек аурулары үшін негізгі препарат және ол қазірдің өзінде ортопедияда, стомотология, хирургияда кең қолданысқа ие.
Медицинадағы гидроксиапатитті қолданудың дәстүрлі формасы- биокерамика өзіне тән қасиеттері бар тығыз және бос тесікті болып екі топқа бөлінеді.
Егер тығыз керамика өзінің қаттылығымен сипатталса онда тесіктерінің болуы остеоинтеграцияға бейімдейді. Мықтылығы едәуір жоғары керамикалық материалдар атомдық қатынасы Са /Р=1, 67тең болып келетін стехиометриялық гидроксиапатиттен алынады. Стехиометриялық емес апатиттің термиялық тұрақтылығы төмен, қыздырғанда жартылай ыдырайды. Осы себептерге байланысты одан механикалық қасиеттері нашар керамика түзіледі. Өкінішке орай өте жоғары 1300-1400 0 С температурада алынатындықтан, апатитті биокерамикалық материалдар өндіру технологиясы қиын. Керамикалық қалыптасу температурасын түсіру үшін, гидроксиапатитті бу мен қысымда үшкальцийфосфат және т. б. бейорганикалық қоспалар, мысалы оксидтер қатысында шикізат ретінде пісіреді. Гидроксиапатитке химиялық құрамы жағынан жақын аморфты фосфаттарды алу тиімдірек әдістердің бірі болып табылады. Әдетте тесікті керамиканы өндірудегі қолданылатын әдістер өте қиын Сонымен қатар аморфты фосфаттағы фосфат аниондары Р-О байланысы ұзындығының бірталай шашырау себебіне байланысты жүйесіз деформацияланған.
Осы айтылған синтезі де тиімдірек жағдайда алынғантын және түзілетін өнімдер гидроксиапатитпен салыстырғанда не ғұрлым жақсы қасиеттерге ие бола алатыны сонымен қатар тесікті кальций фосфатты керамикада адсорбент ретінде сұйық, бу газдарды тазалау және бөлу үшін сүзуші зат ретінде назар аудартады. Бұл топтың маңызды қасиеті биокерамикадағы сияқты тесіктігі және оның өлшемі әдетте, тесікті бос керамиканы өндіру әдістері тым қиын және тесік түзушілер қолдану ұсынылады, бірақ олардың көпшілігі термиялық өңдеу кезінде зиянды қалдықтар түзеді. Сонымен қатар, оларда әрқашан материалдың бостығы, тесіктігі қадағаланбайды.
Жұмыста қойылған мақсатқа сәйкес мынандай міндеттер шешілді:
- золь- гель әдісінің технологиясы бойынша кальцийдің және кальций магний монофосфатының негізінде аморфты материалдардың екі сериясы синтезделді;
- алынған аморфты заттардың табиғаты және оларды қыздырғанда түзілетін өнімдері зерттелді.
Ғылыми жаңалық:
Жұмыста алғаш рет тұндырылған кальцийдің, және калций магнийдің аморфты фосфаттарының заттың тұзды бөлігімен байланысқан 80% судан тұратыны анықталды. Олардың молекулалық негізі кристалды орто және пирофосфаттардағы аниондарға қарағанда көлемі үлкен РО 4 3- және Р 2 О 7 4- моно және дифосфатты Р 2 О 7 4- тобынан түзілген.
Р-О химиялық байланысының ұзындығы шашырау себебіне байланысты жүйесіз деформацияланған.
Қыздырғанда гидратталған фосфаттар 20-150
0
С және 350-400
0
С температура диапозонындағыда алғашқы екі статияда ылғалдылығын жоғалта тұра өзінің аморфты табиғатын сақтаса 580-700
0
С шамасында экзотермиялық кристалданады, ал 1000-1200
0
С температурада
 керамикаға айналады.
керамикаға айналады.
Кальцийфосфатты керамика мен аморфты заттардың құрамы арасындағы микроқұрылымдық өзара байланысы сондай-ақ оларды температуралық режиммен өңдеу анықталды. Алғаш рет аморфты заттардың құрамын
түрлендіре отырып және термоөңдеу режимі негізінде тесіктігі және оның
өлшеміне сәйкестендіре айтқанда 0-50% және 0-2 мкм арасында өзгеретін керамика алуға болатынын көрсеттік.
Жұмыстың практикалық маңызы.
Жұмыста алынған нәтижелер фосфорқышқылды тұздарды және осы тұздар арқылы алынған материалдарды қыздырғандағы табиғаты мен құбылысы туралы мағлұматтарды ұлғайтып, фосфор және фосфаттар химиясын теориялық мәліметтер ұсынылды. Жаңа сүйекті имплантаттар мен ауаны тазалайтын сұйықтарды, булар мен газдарды бөлу үшін қолданылатын адсорбент түрінде практика жүзінде қолдануға болады.
1. Әдеби шолу
2. 1. Фосфаттардың молекулалық құрылымы.
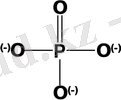
Фосфаттар молекуласының негізі тетраэдрлі РО 4 - топшасы құрайды, оның ортасында фосфор атомдары ал шыңында - оттегі атомдары болады. Фосфор оттегі лигандалары төрт σ- байланыспен және бір π - байланыспен химиялық байланыста болады. sp 3- гибридтелуге байланысты барлық 4σ- байланыстар тепе- тең, ал π - байланысты орналасуы мүмкін.
Мысалы, монофосфатта (ортофосфатта) барлық төрт байланыс Р- О бірдей және қатысқан аниондарының құрылымы келесідей болады.
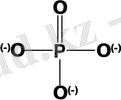 Монофосфат анионындағы РО
3-
4
π- байланыстың делокамезациясы РО
4
3-
тетраэдрлі тек қана дискретті түрде ғана емес, сонымен қатар бір- бірімен бір, екі және үш шыңмен де байланысады. Байланысудың әдістеріне байланысты әртүрлі тізбекті, сақиналы жіне тармақталған полимерлердің түрлері түзілуі Ван - Вазерге (Van Wazer) [1, 2] сәйкес төрт негізгі құрылым дық блок бар, олардың комбинациялануынан барлық белгілі фосфаттардың типтері бірінші топ типінен түзіледі.
Монофосфат анионындағы РО
3-
4
π- байланыстың делокамезациясы РО
4
3-
тетраэдрлі тек қана дискретті түрде ғана емес, сонымен қатар бір- бірімен бір, екі және үш шыңмен де байланысады. Байланысудың әдістеріне байланысты әртүрлі тізбекті, сақиналы жіне тармақталған полимерлердің түрлері түзілуі Ван - Вазерге (Van Wazer) [1, 2] сәйкес төрт негізгі құрылым дық блок бар, олардың комбинациялануынан барлық белгілі фосфаттардың типтері бірінші топ типінен түзіледі.
Бірінші топ типінен түзілген малекулалық қосылыс, орта немесе монофосфат деп аталады.
Екінші топ типінің қосылыстарынан пиро немесе дифосфат түзіледі. Екі соңғы типтің бір немесе бірнеше орталықтардың комбинациялануынан 10-нан 20- ға дейін орташа полимеризациялану дәрежесінен трифосфаттан олигофосфатқа дейін олигомерлер түзіледі. Орталықтанған тобы ғана бар қосылыстар жалпы таныс жоғары полимерлі фосфат түрінде сонымен қатар циклді немесе сақиналы полимерлер[3] тармақталу нүктесі әрекеттескенде түзілген молекулалы заттарды ультрафосфаттар деп аталады да, кей жағдайда фосфаттар ангидриді деп есептейді. Жоғарыда аталғандардан басқа фосфат молекуласының құрамдары да бар[4]
 Оның түзілуінің негізіне келесі элементарлы компоненттердің табиғаты байланысты.
Оның түзілуінің негізіне келесі элементарлы компоненттердің табиғаты байланысты.
Бірінші топ құрылымды типтерденмонофосфатты (ортофосфат) заттар түзіледі. Егер бір және бірнеше топтағы типтер дифосфат түзіледі . Бірінші топ тип қосылса екінші топ типтерімен әрекеттесуінен трифосфат және т. б түзіледі. Екінші топтағы типтерден түзілген бір молекулалы зат жоғары полимерлі фосфат немесе циклофосфатқа жатады.
Фосфаттардың аталуының екі типі бар - дәстүрлі сонымен қатар өткен ғасырдың 50- 70 жж пайда болған жаңа наменклатура IUPAC бойынша дәлелденбеген (нақтыланбаған) , қазір тривиальды атауының қасиеті жоғары болса да қолданбайды. Соған қарамастан жаңа атаулар ғылыми әдебиеттер жиі кездеседі.
1-кесте. Фосфаттардың аталуы.
Барлық фосфаттарды жалпы x M 2 O *у Р 2 О 5 универсалды формула түрінде сипатталады. Фосфаттар құрамын анықтағанда R=М/ Р атомды қатынасты қолдану тиімді, мұндағы М-қосылыстағы металдардың эквивалентті саны ; Р- қосылыстағы фосфор атомының саны, сонымен қатар мольдік қатынаста R= M x O/ P 2 O 5 мұндағы М х О және Р 2 О 5 - қосылыстағы бір немесе екі валентті металл оксидтері мен фосфор пентаоксидінің г/моль саны. Монофосфатта R=3, дифосфатта R=2 жоғары молекулалық полифосфатта R=1, фосфор ангидридте R=0 O<R<1 ультрофосфаттардың әр түрлі типтері, ал 1<R<2 - де сызықты поли- және олиго фосфаттар түзіледі.
Жоғарыда айтылғандай, фосфор атомының оттегі атомының РО 4 тетраэдрлі қосылысы төрт σ- байланыс пен бір π- байланыс арқылы түзіледі, сонымен қатар соңғысы R- О (М) арқылы сызықтарсыз - ақ байланыспен таралады. [2] . Осыған байланысты Р- О сипаты мен байланыс қаттылығы РО 4 тетраэдрлі әртүрлі фосфаттардан ерекшеленеді. Ортофосфат молекуласының қысқалығы әрбір төрт байланысының мәні 1, 25- ке тең олардың барлығы теңтізбекті, сонымен бірге олардың әрбірін төрт бағытта теңдей таралған тетраэдр РО 4 ретінде бір σ - байланыстың π - байланысы
деп қарастыруға болады.
-байланыстар тек қана Р- О (М) байланысы арқылы орналасса, Р-О (М) байланысының қысқалығы соңғы және орталықты топтарда 1, 33 және 1, 50 қатынасқа тең болады.
Бір оттегі атомы мен фосфордың ортасында тармақталу нүктесінде π -
байланыс орналасады содан кейін қалған 3- сызықты Р- О байланыста π- сипат
мүлдем кездеспейді, болмайды. Осы себептен байланыстардың біреуінің қысқалығының тармақталу нүктесі екіге, ал қалған үшеуінде - бірге тең.
Екі немесе шексіз үлкен саны бар РО 4 тетраэдрінің тармақтары полифасфат деп аталады . Полифостардың жалпы формуласының түрі М n+2 P n O 3n+1 , мұндағы n- полимер тармағындағы р- атомының саны . Кейбір жағдайда, егер полифосфаттардың үлкен мән берсе, онда формула мына түрде болады.
lim M n+2 O 3n+1 = MPO 3 n
n →
 (4)
(4)
және циклді фосфаттарға арналған формулаға ұқсайды әсіресе шынылар жайлы сөз болғанда, R- дің орнына полимеризациясын орташа өсу дәреже қолданылады және ол атомдарымен R қарапайым R=1+2/ n қатысында болады.
1. 1. 2. Әртүрлі фосфаттардың өзара реакцияласуы.
Соңғы уақыттар фосфордың бір - бірімен реакцияласуы стомотолегиялық цемент алуда негізгі обьект ретінде көңіл аудартып жүр, олардың есебінде қарапайым шикізат болып гидроксиапатит [5] октакальций фосфат Са 8 Н 2 (РО 4 ) 6 немесе дигидрат дикальций монофосфат - СаНРО 4 *2 Н 2 О болып табылады. Жұмыстың авторлары [6] хабарлағандай дикальцийфосфат СаНРО 4 *2Н 2 О дигидрид реакциясы немесе оның сусыз СаНРО 4
формасындағы тетракальцийфосфат Са 4 (РО 4 ) 2 пен су немесе сумен сұйытылған фосфор қышқылынан цемент алынады, қату нәтижесінде гидроксиапатит түзіледі.
Басқа типтегі цемент алу, оның түзілуінің негізіне монокальцийфосфат - Са (Н 2 РО 4 ) 2 * 2Н 2 О, трикальцийфосфат β- Са 3 (РО 4 ) 2 пен судың реакцияласуы жатыр, оны АА Mirtchi және т. б қасиеттері анықтады.
Сонымен қатар фосфаттардың өзара реакцияласуын әртүрлі полифосфат балқымаларының сілтілік металдармен әрекеттесуінен көруге болады. Бұл жағдайда матрицалар деполимеризациясы есепке алынбады, R- өйткені қоспалар 1-ге тең болады. Бинарлы полифосфат компоненттерінің жүйесінде өзара комплексті типті қосылыстар түзуге ықтимал (бағыт) бар. Сілтілік жүйе Li (PO 3 ) n - (KPO 3 ) n мен (Li PO 3 ) n - (Cs PO 3 ) n конгруэнтті балқитын 1; 1 қатысты қосылыс түзетіні белгілі (NaPO 3 ) n -(KPO 3 ) n жүйеде инконгруэнтті (3Na PO 3 * 3 PO 3 ) n балқитын қосылыс түзіледі, ал қазіргі жұмыстан (2Na PO 3 * KPO 3 ) n [8]
Егер жүйеде екінші компонент ретінде көп валентті металл полифосфаты болса, онда оған сәйкес түзілетін бинарлы комплексті фосфат циклді, сонымен қатар сызықты сипатта болады . Мына жұмыста [9] ( М(РО 3 ) n - [М(РО 3 ) x ] n , (n = 2. 3) бинарлы жүйелер типі түзілу тізбегінің қосылыстарының анализі көрсетілген . Бинарлы Са(РО 3 ) 2 * КРО 3 қосылыстары болады, 849, 5 0 С балқитын [10] авторларының еңбегінде көрсетілген және (КРО 3 ) n - (Са(РО 3 ) 2 ) n жүйесінде құрамы үлкен диапозонда зерттелген.
2. 3. Кальций фосфаттары.
2. 3. 1 Құрылысы, табиғатта таралуы, алынуы және
қолданылуы.
Фосфорқышқылды кальций тұздары үлкендеу топтар түрінде өмір сүреді, оларға сан алуан полимерлер мен полимерлі емес әртүрлер кіреді.
Табиғи кальций - және фосфоры бар минералдар апатиттер болып табылады, оларға үлкен бір типті қосылыстардың саны қатысты болуы мүмкін . Оның
негізіне гидроксиапатитті құрылым кіреді, онда металл ионы немесе қышқыл қалдығы әр түрлі араласу дәрежесінде кальций ионы немесе гидроксил апатиттер арасында гидроксиапатит Са 10 (РО 4 ) 6 (ОН) 2 , фторапатит Са 10 (РО 4 ) 6 Р 2 , карбонапатит Са 10 (РО 4 ) 6 СО 3 және магнийапатит Mg 2 (PO 4 ) OH таралған.
Ғалымдар апатит құрылысы мен құрамын сипаттайтын жартылай нұсқалы формула ұсынды Ме 10 (РО 4 ) 6 Х 2 , мұндағы М- Ca, Mg, Ba, Sr, Na изоморфты сығылатын Cd, Pb, Be, Ra, Y 4%-ға дейін, ал х- F-, Cl-, OH - -, CO 3 -
Бұл барлық заттар бірдей гексагональды кристалды тор типінде болады. Апатиттер табиғатта кең таралған фосфаттар түрі, тыңайтқыш өндірісіндегі фосфор көзі ортофосфор қышқылы және оның өнімдері.
Кальций фосфаттының ішінде монофосфаттар кең тараған соның ішінде Сa 3 (РО 4 ) 2 (трикальцийфосфат), Сa 4 (РО 4 ) 2 О, Сa(Н 2 РО 4 ) 2 Н 2 О ( брумит),
Сa 8 Н 2 (РО 4 ) 6* Н 2 О (октакальций фосфат(ОКФ) ) және Сa 3 (РО 4 ) 2 *3-4, 5н (аморфты кальций фосфаты(АКФ) сонымен қатар апатит тәрізді басқа тұздар. Олар қысқаша 2-кестеде көрсетілген.
2-кесте. Көп таралған фосфорқышқылды кальций тұздары.
Бірінші тұрған кальций фосфаты апатит минералы арасында кең таралған, ол- гидроксиапатит Са 10 (РО 4 ) 6 (ОН) 2 . Гидроксиапатитті кальций фосфатының түріне айнала алады . Бұл тұз адам мен жануарлардың сүйек ұлпасының негізгі минералды компоненті.
Гидроксиапатит- апатиттер тобының бірі М 10 (ZO 4 ) 6 X 2 формуласының көмегімен оның құрамын сипаттауға болады . Элементтің үлкен сандарын мына қатынаста көрсету мүмкін; М, Z және Х:M= Ca, Sr, Ba, Pb және т. б Z=P, As, Si, S, Ge және т. б Аталған элементтермен гидроксиапатит құрылымын өзгерткенде құрамы әр түрлі апатитті қосылыстар алуға болады . Біріншіден гидроксиапатит қосылысына ұқсас[11] жұмыста анықталған, гидроксиапатит, фторапатит және хлорапатиттерді рентген құрылымды зерттеулердің классикалық нәтижесі болып табылады. Гидроксиапатит құрамы гексоганальды сингонияға жатады, элементтер ұяшығы Р6 3/m кеңістік группасын және екі формулалы бірлікті құрайды, оның идеалды формуласы- Са 10 (РО 4 ) 6 (ОН) 2 гидроксиапатиттің кристалың кеңістіктегі ұяшығы Р6 3m симитрия тобты гексагональді типті және гексаганальді винтті осі параллельді С осімен иондық торды түзеді ал х-ионы қатысында каналды құрылымға ие болады.
Екі валентті иондардың бөлігі винтті ості қоршай үш бұрышты құрылым түзеді . Осыған орай екілік ОН - топтар гексоганальды осьтің ортасында құрылымды оттегі ОН - топтар 0, 3 Р жоғары немесе төмен жазықтық жақын жатқан кальцийдің үш атомымен байланысады. ОН - тобымен араласқан кальций үшбұрышының орталығында үш өлшемді құрылымды болады. Бұл бағытсыздық әртүрлі топтар немесе бос орындарға орналасқан болуы мүмкін. Басқа кристалдар структурасы- үшбұрыш түрінде алты РО 4 3- топ және пирамида осінде бұрыштанбаған төрт кальций атомдар жұбы - әртүрлі байланыс табиғатын көрсетеді. Сонымен РО 4 3- байланыс кальций ионды сипатта, ал Са- х меншіктейтін кавалентті байланыс сипатта болады.
Сондықтан гидроксиапатит торлары өзінің барлық анизатропиясының гитерополярлы байланысына қарамастан кристалдары жоғары қалыптылық көрсетеді. Сондықтан гидроксиапатит өзінің кристалдық торынан ОН - 1000 0 С- ға дейін қыздырғанда қиыншылықпен береді [9] 1500 0 С-дан жоғарғы термолизде гидроксиапатит α- тұзға диссоцацияланады
Са 10 (РО 4 ) 6 (ОН) 2 → 2Са 3 РО 4 +Са 4 Р 2 О 7 + Н 2 О (12)
Карбридж дәл осындай құрылым кристалдық тордағы орынның орнын басуға болады деп есептейді.
Са 10 (РО 4 ) 6 СО 3 О- далмет Са 10 (РО х СО 3 ) 6 (ОН) 2
Са 10 (РО 4 ) 6 (ОН) 2
Са 8 С 2 (РО 4 ) 4 (СО 3 ) 2 С С-(ваканция ) бос орын
Содықтан нанакристалды ұнтақ гидроксиапатитті тығыздалған немесе ірі кеуекті керамика алуда қиыншылықтар бар. Гидроксиапатиттің құрылымы карбонатты өз ұяшығына қосудың екі мүмкіндігін көрсетеді.
1) СО 3 2- тобымен РО 4 3- алмастырамыз және заряд байланысын сақтап қалуға катион бос орындарын құру.
2) Каналды құрылымда ОН - ионын алмастыру.
Каналды құрылымға СО 2- 3 қосу синтезді 200 0 С -та әдіс арқылы өткізуде мүмкіндігі көп ылғалды әдіс арқылы апатиттерде бірінші типті орын ауыстыру болады.
Са/Р атомды қатынас гидроксиапатитті стехиометриялық емес құрылымды индекс ретінде қолданылуда оның өте жетілген қосылыс екенін көрсетеді. Көпшілік гидроксиапатит шикізаттарын ылғалды әдіспен синтездеу стехиометриялық емес заттар алу негізгі болып табылады. Қазіргі уақытта стехиометриялық негізін келесі формуламен түсіндіруге болады;
Са 10 -х (НРО 4 ) х (РО 4 ) 6-х (ОН) 2-хn H 2 O, 0<X, 1 n=0; 2. 5 (14)
Неорганикалық бөліміне адамның сүйек ұлпаларының химиялық ұқсастығы үшін, сонымен қатар кристалографиялық ұқсастық әртүрлі қатты омыртқа ұлпаларымен қатынас және биобірлестікпен остеокондуктивтілігі үшін гидроксиапатит Са 10 (РО 4 ) 6 (ОН) 2 дәрігерлердің бүлінген тіс пен сүйектерді алмастырғыш ретінде үлкен көңіл аударады. Гидроксиапатитті облыста қолдану келесі жұмыстар бөлімінде қарастырылады. Сонымен қатар бұл материалға қызығушылық электроникада және беттік қозғалу ғылымында туып отыр, онда ұнтақ тәріздес гидроксиапатит газды сенсор ретінде катализатор және хромотографияға адсорбент ретінде қолданылады және де гидроксиапатитті керамикалық материалдар рентгенді және ультрадыбысты медициналық диагностикалық апараттар мен әртүрлі өлшегіш құралдарда қолданыс табуда.
Кальций фосфаты үлкен қолданысқа тамақ өнеркәсібінде алды тест көтергіш, сонымен қатар, олар торт қоспасымен тестаның негізгі компоненті болып табылады.
Тыңайтқыштың маңызды тұзды компоненті- суда еритіні үшін дигидрофосфат болып табылады. Кристаллография мен биалогиялық аспектлердің сапасына қарай гидроксиапатиттің түзілуі ОКФ мен АФК үлкен қызығушылық тудыруда. Басқа кальций фосфаттары негізінен өнеркәсіпте кальций фосфаты бар әртүрлі материалдардың химиялық реагенті есебінде қолданысқа ие болуда.
Монатит - негізгі ауылшаруашылық тыңайтқышының компоненті. Суда еритін брумит өнеркәсіпте голофосфатты люминофосфор өндірісінде, гидроксиапатит ұнтағын алуда, тіс жуғыш пасталардың абразды материалы есебінде жануарлар қорегі ретінде және т. б қолданылады.
2. 3. 2. Кальций дифосфаты.
Бүгінгі күнге дейін кальций дифосфатының үш модификациясы белгілі: α-, β- және γ- Са 2 Р 2 О 7 . Алғашқы екі типтің кристалдық құрылымы табылған γ-β- өту температурасы 700- 750 0 С, ал басқа мәліметте - 680-740 0 С
Β-α өту өз кезегінде 1140 0 С температурада, ал мәліметте бұл температура 1171- 1179 0 С - ты береді.
Астында көрсетілген минералдардан пиролиздеу арқылы практика жүзінде барлық сусыз кальций дифосфаты алынған. Осындай минералдарға монетит СаНРО 4 немесе брумит СаНРО 4 * 2Н 2 О жатады. Оларды вакуумда ұзақ уақыт 8 тәулік 275 0 С - та қыздырғанда немесе 4- сағат бойы 500 0 С - та күйдіргенде γ-Са 2 Р 2 О 7 алынады. β- Са 2 Р 2 О 7 1- сағат бойы 1050 0 С - та күйдіргенде немесе гидротермиялық синтезде ( 4- сағат бойы 450 0 С пен 210 МПа) , ал α - Са 2 Р 2 О 7 1250 0 С -та 1 сағат бойы қыздырғанда алынады.
... жалғасы2. 3. 3Медицинадағы кальцийфосфатты материалдар.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz