Газ молекулаларының еркіндік дәрежелері, энергияның біркелкі таралуы және Максвелл таралуы


Еркіндік дәреженің саны.
Еркіндік дәреженің саны - кеңістікте жүйенің орнын толық анықтайтын тәуелсіз айнымалылар саны.
Қатаң молекулалы идеал газ үшін еркіндік дәрежесінің саны.
Ілгерілемелі
Айнымалы
Барлығы
3
-
3
3
2
5
3
3
6
Нақты молекулаларда молекуладағы атомдар арасында қатаң байланыс жоқ, сондықтан молекула ішіндегі атомдардың тербелмелі қозғалысының еркіндік дәрежесінде ескеру қажет.
Молекуланың еркіндік дәрежесінің жалпы санына тәуелсіз, үш еркіндік дәрежесі барлық уақытта ілгерілемелі қозғалысқа тән. Оның әрқайсысына молекулалардың ілгерілемелі қозғалысының
 кинетикалық энергиясының
кинетикалық энергиясының
 келеді.
келеді.
.
Энергияның еркіндік дәрежесі бойынша бірқалыпты таралуы туралы
Больцман заңы ( теңдей таралу заңы) .
Термодинамикалық тепе-теңдікте тұрған жүйе үшін әрбір ілгерілемелі және айналмалы еркіндік дәрежесіне
 тең орташа кинетикалық энергия, ал әрбір тербелмелі еркіндік дәрежесіне
тең орташа кинетикалық энергия, ал әрбір тербелмелі еркіндік дәрежесіне
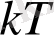 тең орташа кинетикалық энергия келеді.
тең орташа кинетикалық энергия келеді.
Тербелмелі жүйе шама жағынан орташа мәні тең кинетикалық және потенциалдық энергияға ие болғандықтан, тербелмелі еркіндік дәрежесінің энергиясы екі есе үлкен.
Сонымен, молекуланың орташа энергиясы :
 .
.
Мұндағы
 - молекулалардың ілгерілемелі, айнымалы және екі еселенген тербелмелі еркіндік дәрежесінің қосынды саны.
- молекулалардың ілгерілемелі, айнымалы және екі еселенген тербелмелі еркіндік дәрежесінің қосынды саны.
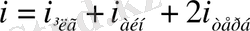 .
.
Классикалық теорияда атомдарының арасы қатаң байланысқан молекулалар қарастырылады; олар үшін
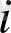 молекулалардың екіндік дәрежесімен дәл келеді.
молекулалардың екіндік дәрежесімен дәл келеді.
Идеал газда молекулалар бір - бірімен өзара әсерлеспейді, олардың потенциалдық энергиясы нольге тең.
Сондықтан идеал газдың бір молінің ішкі энергиясы
 және кез келген массалы
және кез келген массалы
 газ үшін
газ үшін
 сәйкес :
сәйкес :
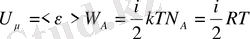 .
.
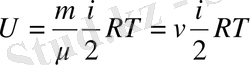 .
.
Термодинамиканың бірінші бастамасы бұл термодинамикалық процестердегі энергияның сақталу және айналу заңы болып табылады.
Дененің ішкі энергиясын екі жолмен өзгертуге болады: жүйемен жұмыс істеу (мысалы поршень көмегімен газды сығу) немесе жүйеге жылу беру арқылы (мысалы жылу өтпейтін ыдыстағы газды қыздырғанда) .
Сыртқы өріс әсер етпейтін, тұйық, макроскопиялық қозғалмайтын жүйені қарастырайық және энергетикалық тұрғыдан жүйенің кез келген бастапқы 1 күйден екінші күйге тепе-теңдік өту процесін талқылайық.
Дененің ішкі энергиясының өзгерісі
мұндай процесте жүйенің алған жылу мөлшері
 мен сыртқы күшке қарсы жүйенің жасайтын
мен сыртқы күшке қарсы жүйенің жасайтын
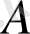 жұмысының айырымына тең.
жұмысының айырымына тең.
немесе
.
Молекуланың тек ілгерілемелі қозғалысының энергиясын ғана көрсетеді. Алайда молекулалардың ілгерілемелі қозғалысымен қатар, молекулалардың айналуы және молекуланың қозғалыс құрамына кіретін атомдардың тербелуі де мүмкін. Қозғалыстың бұл екі түрі қандай да бір энергия қорымен байланысты болады, ал бұл энергияны анықтауға статистикалық физика тағайындайтын энергияның молекуланың еркіндік дәрежелері бойынша біркелкі таралуы жөніндегі қағида мүмкіндік береді. Еркіндік дәрежесі бойынша энергияның біркелкі таралу заңы - классикалық жүйелерге қолданатын статистиканың негізгі заңдарының бірі. Механикалық жүйенің еркіндік дәрежелері саны деп жүйенің орнын анықтауда мүмкіндік беретін тәуелсіз координаталардың жиынтығын айтады. Материалдық нүктенің кеңістіктегі орны оның үш координаттарының мәндерімен анықталады. Газдардың жылу сыйымдылығын өлшегенде атомдарды материалдық нүктелер деп есептеуге болады. Олай болса, бір атомды молекулалар үш ілгерілемелі еркіндік дәрежеге, екі атомды молекулалар - үш ілгерілемелі, және екі айналмалы, көп атомды молекулалар және абсолютті қатты дене - үш ілгерілемелі және үш айналмалы еркіндік дәрежесіне ие болады. Жылулық тепе-теңдік жағдайында молекуланың әр еркіндік дәрежесіне тең орташа бірдей кинетикалық энергиядан келеді. Мұндағы, - Больцман тұрақтысы. Екі немесе көп атомды молекулалар айналмалы және тербелмелі қозғалыстар жасайды. Тербелмелі қозғалыстың болуы кинетикалық энергияның потенциалдық энергияға ауысуынан және керісінше болуымен байланысты. Молекуладағы атомның тербеліс энергиясын ескерсек, орташа кинетикалық және орташа потенциалдық энергиясын қарастыруымыз қажет. Молекуланың толық энергиясы. Еркіндік дәрежесі бойынша энергияның біркелкі таралу заңы - классикалық жүйелерге қолданатын статистиканың негізгі заңдарының бірі. Механикалық жүйенің еркіндік дәрежелері саны деп жүйенің орнын анықтауда мүмкіндік беретін тәуелсіз координаталардың жиынтығын айтады. Материалдық нүктенің кеңістіктегі орны оның үш координаттарының мәндерімен анықталады. Газдардың жылу сыйымдылығын өлшегенде атомдарды материалдық нүктелер деп есептеуге болады. Олай болса, бір атомды молекулалар үш ілгерілемелі еркіндік дәрежеге, екі атомды молекулалар - үш ілгерілемелі, және екі айналмалы, көп атомды молекулалар және абсолютті қатты дене - үш ілгерілемелі және үш айналмалы еркіндік дәрежесіне ие болады. Жылулық тепе-теңдік жағдайында молекуланың әр еркіндік дәрежесіне тең орташа бірдей кинетикалық энергиядан келеді. Мұндағы, - Больцман тұрақтысы. Екі немесе көп атомды молекулалар айналмалы және тербелмелі қозғалыстар жасайды. Тербелмелі қозғалыстың болуы кинетикалық энергияның потенциалдық энергияға ауысуынан және керісінше болуымен байланысты. Молекуладағы атомның тербеліс энергиясын ескерсек, орташа кинетикалық және орташа потенциалдық энергиясын қарастыруымыз қажет. Молекуланың толық энергиясы .
Газ молекуласының еркіндік дәрежесі
Газ молекуласының еркіндік дәрежесі деп молекуланың кеңістіктегі орнын анықтайтын тәуелсіз параметрлердің жиынтығын айтамыз. Егер кез-келген дене кеңістікте қозғалатын болса, онда осы қозғалысты тәуелсіз алты қозғалыстың жиынтығы түрінде қарастыруға болады: үш ілгерілемелі қозғалыстың (тікбұрышты координаталар жүйесінің осьтері бойымен), үш айналмалы қозғалыстың (дененің массалар центрі арқылы өтетін өзара перпендикуляр үш осьтің айналасында) жиынтығы.
Қалыпты жағдайда газ молекулаларының еркіндік дәрежесі:
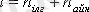
Жоғары температураларда бұл еркіндік дәрежесіне тербелмелі қозғалыстың бұл еркіндік дәрежесі қосылады.
Бір атомды газ үш бағытта ілгерілемелі қозғала алады. Сондықтан бір атомды газдың еркіндік дәрежесі
 -ке тең.
-ке тең.
Екі атомды газ үш бағытта ілгерілемелі және екі бағытта айналмалы қозғала алады (сурет) . Сондықтан екі атомды газдың еркіндік дәрежесі
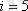 -ке тең болады.
-ке тең болады.
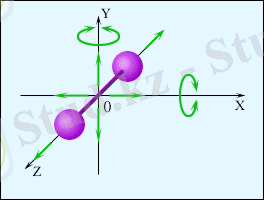
2-атомды газ үшін 3-атомды газ үшін
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz