Физикалық материалтану және металдартану: құрылым, фазалық құрамы және өңдеу әдістері


Мазмұны
1. Металдардың электрондық теориясы. Физикалық материалтанудың негізгі түсініктері. Фазалық құрамның, материалдардың құрылысы және қасиеттері, физикалық материалтануда қолдану әдістерін зерттеу.
2. Материалдар қасиеттері. Металдардың атом-кристалдық құрылысы.
Анизотропия.
3. Материалдардың құрылысы. Атомның электрондық құрамы.
Қарапайым және өтетін металдар. Байланыстардың және энергиялық
шекаралардың пайда болуы.
4. Қатты денедегі электрондық күй. Энергиялық сызықтар.
Электрондардың қозғалуы.
5. Кристалдағы байланыстардың түрлері.
6. Кристалданудың басты теориялары. Қатты фазалардың пайда болуы.
Гомогендік және гетерогендік механизмдер. Суыту жылдамдығының
әсері.
7. Қорытпаның басты теориялары. Қатты күйдегі компоненттердің еруі.
Қатты ерітінділердің түрлері. Юм-Розери ережесі. Аралық фазалар.
Интерметалдық қосылыстар.
8. Металдағы және қорытпадағы ақаулар. Диффузиялық механизмдердің
түрлері. Диффузиялық және диффузиялық емес фазалық ауысымдар.
9. Қорытпалардың термиялық өңдеуі. Болаттың ТӨ кезіндегі басты
ауысымдар.
10. Қорытпалардың химия-термиялық өңдеуі. Цементтеу. Азоттау.
11. Фазалық құрам, түсті металдар негізіндегі қорытпаның құрамы және
қасиеті.
12. Ұнтақталған материалдар.
13. Композициялық материалдардың құрамы мен қасиеттері.
14. Металл емес материалдар және пластикалық салмақтар. Шыны. Ағаш
материалдар.
15. Синтетикалық эластомерлер. Резеңкелер. Боялған лак және көмекші
материалдар.
Пайдаланған әдебиеттер тізімі
1. Физическое металловедение / Под ред. Кан Р. У., Хаазена П. 3-е изд. I-II том. М. : Металлургия, 1987.
2. Арзамасов Б. Н., Макарова В. И., Мухин Г. Г. и др Материаловедение / Под общ. ред. Б. Н. Арзамасова. М. : МГТУ им. Баумана, 2001.
3. Исин Д. К., Исагулов А. З. Физика твердого тела. Учебное пособие. Караганда: изд. КарГТУ, 2005.
4. Лахтин Ю. М., Леонтьева В. П. Материаловедение М. : Машиностроение, 1990.
5. Захаров А. М. Диаграммы состояния двойных и тройных систем. М. : Металлургия, 1978.
6. Лившиц Б. Г. Металлография. М. : Металлургия, 1990.
7. Методические указания к практическим занятиям по курсу «Технологические процессы машиностроительного производства: Мате-риаловедение». Шарая О. А., Балбекова Б. К. Караганда: изд. КарГТУ, 2005г.
8. Методические указания «Материаловедение. Лабораторный практикум». Смолькин А. А., Исагулов А. З., Шарая О. А. Караганда: изд. КарГТУ, 1997г.
Қосымша әдебиеттер тізімі
9 Ахиезер А. И. Атомная физика. Справочное пособие. Киев: Наукова
думка, 1988.
10 Мозберг Р. К. Материаловедение. М. : Высшая школа, 1991.
11 Металлургия / Под ред. Коротича В. И. Свердловск: Уральск. гос.
техн. ун-т, 2001.
12 Кипарисов С. С., Либенсон Г. А. Порошковая металлургия. М. : Метал-
лургия, 1991.
13 Материаловедение и конструкционные материалы. Пинчук Л. С., Мышкин Н. К., Свириденок А. И. Минск, Высшая школа, 1989.
14. Методические указания к лабораторным работам по дисциплине «Металловедение цветных металлов». Балбекова Б. К., Тулегенова Ш. Н., Малашкевичуте Е. О., Медведева И. Е. Караганда: изд. КарГТУ, 2005.
Тақырып 1 Металдардың электрондық теориясы
Дәріс жоспары:
1. Физикалық материалтанудың кіріспесі.
2. Фазалық құрылысының, материалдардың құрамы мен қасиеттерін, физикалық материалтануда қолдануын зерттеу әдістері.
3. Металдың электрондық теориясы. Шекараның пайда болуы. Қарапайым және өтетін металдың энергиялық шекарасы.
Физикалық материалтану - фазалық өзгеріс және құрылымның өзгерісі, өңдеу режиміне және материалдың химиялық тәуелділігінің, фазалық құрам құрылуының ғылымы болып табылады, сонымен қатар халық шаруашылығында кеңінен қолданылады.
Физикалық материалтануда металлографиядағы сияқты эксперименттік және фазалық құрамның теориялық (есептік) зерттеу әдістері, құрылымдар және физика-химиялық және материалдардың механикалық қасиеттері қолданылады. Эксперименттік әдістерге мыналар жатады:
- оптикалық және электрондық микроскопия;
- рентгенография;
- химиялық және рентген спектрлік нәтижелер.
Металдың эксперименттік зерттеу әдістері тік (құрылымдық) және қисық болып екіге бөлінеді. Олардың барлығы құрылым аралыққа және фазалық күйге тәуелді, бір жағынан, және көрсеткіштің басқа қасиеті жағынан да тәуелді болады.
Тік әдіске микроқұрылымды зерттеу және микроқұрылымдарды оптикалық және электрондық микроскоп арқылы жатады.
Қисық әдістік зерттеуге термиялық нәтиженің әдісі, тұрақты температурадағы электркедергі құрамына тәуелділік нәтижесі (бұл әдіс физика-химиялық нәтиженің мысалы реті болып табылады) және т. б. жатады.
Жиналған эксперименттік материалдар, құрылым затты сипаттайтын, электрондардың құрамын және басқа микрообъектілері классикалық механика негізінде басқаша түрінде жазылуы мүмкін. Микробөлшектер кванттық механикаға бағынады, ол қазіргі заманға сәйкес атом моделі негізінде.
Кванттық механиканың негізгі жағдайларын қарастырайық.
1. Энергия кванттармен шығады және бөлек порция ретінде жұтып алады. Сондықтан, микробөлшек энергиясы секіргіш ретінде өзгертіледі.
2. Электрондар және басқа микробөлшектер еселенген табиғатты иемденеді: бір жағынан, олар бөлшектің қасиетін көрсетеді (мысалы, салмақты және зарядты иемденеді), ал екінші жағынан, қозғалыс кезінде олар электрмагнит толқын қасиеттерін көрсетеді.
3. Кванттық механика микробөлшекте анықталған орбитаны көрсетпейді. Олар атомдық ядроның жанында орналасқан. Тек қана әртүрлі жерлердегі электрондардың орналасу ықтималдылығын қайда екенін анықтауға болады.
Энергиялық күй және қатты денедегі электрондардың қозғалысы. Мысалы: N атомын ойша кристалдық торда орналастырайық, бірақ олардың аралары алыс болу керек. Мұндай жүйедегі атомдар тәжірибелік жағдайда әсерлеспейді және әр электрон атомдық деңгейдегі энергияға - боровкалық орбитаға сәйкес келеді. Енді бұл бөлінген атомдар реалды атомаралық деңгейге дейін қысылады. Бұл келісім, атом арасында әсерлесуге тәуелділікті және сәйкесінше электрондар күйін өзгертеді, изолирленген атомдар қасиеті қатты дене қасиетіне ауысады.
Мысалға құйманы қарастырайық. Бұл таңдау өте қолайлы, өйткені құйма - қарапайым элемент, қарапайым қатты күйде болады, толықтырылған қабықшада екі электрон құралған және бір валенттік электрон. Төменгі сатыда екі электрон бар, ал үстінгіде - біреу. Атомдар жақындаған сайын бірнеше эффект пайда болады. Оның біреуі электростатика заңы бойынша түсіндіріледі, ал басқалары типтік кванттар болып табылады. Әр электронға енді тек қана атом ядросы ғана әсер етпейді, сонымен қатар көршілес атом ядросы да әсер етеді. Тартылған электрон, бұл атомдағы ядро байланысын әлсіретеді, потенциалдық барьердің биіктігі, бөлінген атомдар, ал келесі, кішірейтіледі және валенттік электрондар байланыс энергиясы да кішірейтіледі. Валенттілік электрондардың көрші атомдарға әсері және ішкі толтырылған қабықшадағы электрондар әртүрлі болады. Ішкі қабықшалардың электрондары, қатты денедегі атомдар араларының күйлерінің өлшемі, көршілес атомдар әрқалай әсер етеді, ол атом ядросына қарағанда алыста орналасқан. Соған қарамастан қатты денедегі нәтижесінде туннельдік эффект пайда болатын қозғалыс электрондар атомдары атомдарға әсер етеді, сонымен қатар ол бір деңгейдегі атом күйдегі барлық электрондарға да әсер етеді. Анықталмаған ∆ετ ~ ħ сәйкес, өмір уақытын байланыстыратын электрондар τ кейбір күйдегі анықталмаған оның энергиясы ∆ε - деңгей ені, туннельдік өткізгіш электрондар атомдағы электрондар энергиясының кеңеюіне әсер етеді және кристалда пайда болатын энергиялық сызық (шекараны ) ені ∆ε ~ ħ/τ. Сондықтан туннельдік ықтималдылық 1/τ атом арасындағы потенциалдық барьер U биіктігі экспоненциальды әсер етпейді, 1/τ ~ exp(-α√U), мұндағы α - тұрақты, тереңдегі ішкі дәрежеге арналған энергиялық шекараның ені өте аз және электрондардың мұндай деңгейін тордағы түйіндегі локализделінген болып табылады. Сондықтан атомдық ядро барлық ішкі электрондармен қатты денеге бір атомдық құрам ретінде - берілген йод элементі кіреді.
СӨЖ-ге арналған бақылау сұрақтары 1-тақырып [1, 3, 6, 9]
1. Кванттық механиканың негізгі жағдайлары.
2. Бос электрондардың пошталық моделдері.
3. Бинарлық қорытпалар.
4. Жылулықтың пайда болуы.
5. Магнетизм.
Тақырып 2 Таза металдардың құрылысы
Дәріс жоспары:
1. Атомдардың электрондық құрылысы. Элементтің периодтық жүйесі. В тобындағы кристалдық құрылымдар. Екі қысқа период IA және IIА топтар. Өтетін металдардың топтары IB және IIВ. В тобындағы металдар. Қасиеттің қысқаша жазбасы. Анизотропия.
2. Кристалдағы байланыс күші. Иондық байланыс. Коваленттік байланыс. Ван-дер-Ваальс байланысы. Металдық байланыс. Резонанстық байланыс. Полиморфтық ауысу.
3. Металдағы фазалық ауысымдар және құрылым өзгерістері. Металдардың кристалдануы.
4. Металдық беріктілік және пластикалық деформациясы.
Химиялық элементтің электрондық қабықша атомы. Атомдардың құрылу теориясы заңға сәйкес, ол микробөлшек қозғалысын (электрондар, атомдар, молекулалар) және олардың жүйелерін (мысалға, кристалдар) суреттейді. Микробөлшектердің салмақтары мен бөлшектері микроскопиялық денемен салыстырғанда оның салмағы мен өлшемі аз. Сондықтан бөлек микробөлшектің қасиеті микроскопиялық денемен салыстырғанда сапалы қасиетімен және заң түріндегі қозғалысымен айырылады, ол классикалық физикамен оқытылады. Қозғалыс және микробөлшектердің әсерлесуі (немесе толқындық) кванттық механика суреттеледі. Ол кванттық энергияға, микробөлшек қозғалысындағы толқындық сипаттамаға және микрокөлемдердің ықтималдылық әдісіне (статистикалық) негізделеді.
Кеңістіктегі ядро жанындағы облыс, электрондардың пайда болу ықтималдылығын орбиталды деп атайды. Шекаралас жазықтықтың пішіні мен өлшемін орбиталдың (электрондық қабықша) шекарасы мен жазықтығы ретінде де санауға болады. Пішін орбиталды және электрондық қабықша пішін сипаттамасына орбиталды кванттық санды l енгізуге болады. Өткізілетін l белгіленген сан басты кванттық санымен n анықталады. Кванттық сан l мына мағынаны береді: 0, 1, 2, 3, …( n - 1) . Орбиталды кванттық санды әріптер арқылы белгілеу керек:
Орбиталды кванттық l 1 2 3 4 5
Белгіленуі s p d f h
Әрбір кванттық санның белгіленуі орбиталдық сан мына белгілерді қабылдайды, 0 и ( n - 1) аралығында болуы тиіс:
Орбиталдың белгіленуі
(электрондық бұлттар)
1
2
3
4
0
0, 1
0, 1, 2
0, 1, 2, 3
1 s
2 s, 2 p
3 s, 3 p, 3 d
4 s, 4 p, 4 d, 4 f
Осылайша, бірінші энергиялық электрондық деңгейі ( n =1) тек қана бір пішінді орбитал, ал екінші энергиялық электрондық деңгейіне ( n =2) екі пішінді орбитал, ал үшіншіге үш және т. с. с. сәйкес.
Кванттық-механикалық есептеуге сәйкес s -орбиталдар шар тәріздес пішінді, p -орбиталдар - гантел пішінін, d - және f - орбиталдар - көбірек қиын пішінді иемденеді.
Басты кванттық сан электрондық күй белгілеу кезінде орбиталды кванттық санының алдында белгіленеді. Мысалы, 4s электрон, мұндағы n = 4 және l = 0 (қабықша санды иемденеді) ; 2p электронды белгілейді, мұндағы n =2 және l =1( қабықша гантел пішінін иемденеді) және т. с. с.
Кеңістіктегі сипатталған орбиталды орналасу үшін магниттік кванттық сан m l қолданылады.
Магниттік кванттық санның белгіленуі орбиталды кванттық санға тәуелді және (2 l + 1) тең.
s -бір орбиталды күйге жауап береді, p -күйге - үш, d -күйге - бес, f -күйге жеті және т. с. с. Бірдей энергиялы орбиталдар азғындар. Осылайша, p -үш қысқартылған күй кішірейеді, d -күйі - бес қысқартылған, f -күйі - жеті қысқартылған және т. с. с.
Атомдық спектрлердің жіңішке құрылымын оқытуы, қабықша өлшемінің айырылуының айырмашылығын көрсетеді, олардың пішіндері және бір-біріне сәйкес келетін электрондар спинмен айырылады (Спин ағылшынша - «қозғау», «айналдыру») . Спинді өз осіндегі электрондар айналысындағы ұршық айналыс тәрізді ұсынуға болады. Электронның спиндік сипаттамасы үшін төртінші кванттық сан m s енгізіледі, оны спиндік деп атайды. Ол +1/2 және -1/2 бір немесе белгілерді магниттік дала егістікке тәуелді.
1925 жылы В. Паули принципі бойынша: атомдарда екі электрон болу мүмкін емес, өйткені барлық төрт кванттық сандар бір жиынтықты иемденеді. Паули принципінен, бір орбиталда тек қана екі электрон ғана болуы мүмкін.
Сондықтан, s -күйде (бір орбитал) екі электрон болуы мүмкін, p -күйде (үш орбитал) - алты, d -күйде (бес орбитал) - он және т. с. с.
Берілген энергиялық дәреженің сан орбиталы n 2 тең, энергиялық дәреженің құрамының сыйымдылығы 2 n 2 электрондарды құрады.
Электрондық қабықшаның конфигурациясы қоздырылмаған атом оның зарядтық ядросымен анықталады. Бір белгілі басты кванттық санның n электрондары аспан өлшемі бойынша жақын кванттық қабат пайда болады. n + 1, 2, 3, 4 … қабаттарымен мына әріптерге сәйкес K, L, M, N , … белгілейді. Ядро белгілі бір өлшемде жойылса, онда қабаттардың сыйымдылығы жоғарылайды және сәйкесінше 2 n 2 белгісі құрады: 2 ( n =1, қабат K), 8 ( n =2, қабат L), 18 ( n =3, қабат M), 32 ( n =4, қабат N) электрондар.
Кванттық қабаттар қабат астылармен құралған, бірдей белгілі орбиталды кванттық санымен l қосылады. Қабат асты орбиталдардан тұрады.
Атомдардың күйлері көбірек берік, олардың электрондары ең төмен энергияны иемденеді, яғни ядро қабаттарынан табылады. Энергиялық күйдің жүйелігі көп электронды атомның орбитал осі бойынша энергиялық
орбиталдың өсу қатары келесі атомдар түрінде көрсетілген: 1s < 2s < 2p < 3s <3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4f және т. б.
Берілген қабықша асты орбиталды толтыру жөнімен Хунда ережесіне бағынады: берілген қабықша астының электрондарының жиынтық спиндік саны максималды болуы тиіс.
Орбиталда бір электрон болса, онда бұл ереже энергиялық түрде пайдалы. Басқа сөзбен айтқанда, берілген орбитал қабықша астын ең бірінші бір-бірден толтырады, сосын екі-екіден. Қарама-қарсы электрондар спиндері бір және басқа орбиталда екі электронды аспан пайда болады және олардың жиынтық спиндері нөлге тең.
Барлық заттар атомдардан тұрады. Атом зарядталған жағымды ядродағы жүйені құрады, оның жанында жағымсыз электрондар айналады. Электрондар ядроға жақындайды және бір-бірімен тебіледі (итеріседі) . Ядроға жақын орналасқан электрондар үлкен тартылысқа ұшырайды, олар ішкі электрондарды тартылысты әлсіретеді және олар ядродан алыс қашықтықта орналасқан. Ішкі электрондар бір атомнан екінші атомға енеді және олардың ішкі электрондар саны өзгереді, басқа атомға қосылады. Мұндай электрондар валенттілік деп атайды. Әртүрлі заттың атомдары әртүрлі валенттілік сандарды құрады. Бір немесе бірнеше жоғалтқан атомдар жағымды зарядталған ион болып табылады. Өзіне бос электрондарды қосқан атомдар, жағымсыз зарядталған ион болып табылады.
Атомдардан молекулалар құрады. Молекулардағы атомдардың қосылу байланысы химиялық деп аталады. Басқа заттармен қосылған атомдардың қабілеттілігі және пайда болған молекулалар химиялық қасиет затымен анықталады. Молекула заттың ең төменгі бөлшегі болып табылады, ол оның химиялық қасиетін сақтап қалады. Заттың атомдар арсындағы химиялық байланысы коваленттілікке (атомдық), иондық, металлдық және молекулярлық деп бөлуге болады.
Түр байланысының құрылымға және қасиетке әсері. Кристалда пайда болатын элементарлық бөлшектер атомдардың түр байланысы өзара әсерлесуге тұратын электрондық құрылуымен анықталады. Кристалдағы элементарлық бөлшектер анықталған ара қашықтыққа жақындайды, ол кристалға көп термодинамикалық тұрақтылықты қамтамасыз етеді. Бөлшектер жақындауының арақышықтығы кристалда қозғалатын өзара әсерлесу күшімен анықталады. Жақындау күші өз атомының жағымды зарядталған ядросымен өзара әсерлесу электрондар көмегі арқылы, сонымен қатар көрші атомдардың зарядталған ядросы да пайда болады.
Тебу күші жақындау кезіндегі көрші атомдардың зарядталған ядролардың өзара әсерлесуі жағымды нәтижесі кезінде пайда болады.
Тебу күші күшті жақындау нәтижесінде болады және жақындау күшіне қарағанда интенсивті түрде өседі (2. 1-сурет) . d о ара қашықтығындағы элементарлық бөлшек жақындау кезінде тегістеу өлшем күші пайда болады. Бұл жақындауға Е байл минимум энергиялық байланыс сәйкес келеді, сондықтан кристалды термодинамикалық тұрақты болады. Ол балқыту температурсын, булану, серпімділік модулі, сызықтық кеңеюінің температуралық коэффициенті және басқа қасиеттерді анықтайды.
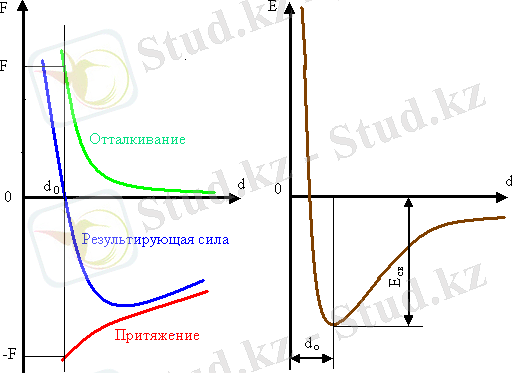
2. 1-cурет. Әсерлесу күшінің өзгерісі (а) және кристалдағы атомдардың жақындау кезіндегі энергиялық байланысы (б)
Барлық кристалдар байланысқа басым сипаттама бойынша молекулярлыққа, коваленттілікке, металдылыққа және иондыққа бөлінеді. Көбінесе, бұл күштер коваленттілік байланыспен кристалдарда анағұрлым болады. Иондық байланыспен ол бірнеше кіші және металдық байланыспен одан да кішірек болады. Молекулярлық кристалда бұл күштер байланысы минимум ретінде қарастырылады. Бірақ мұндай бөлу шартты түрде болады, кейбір жағдайда тек қана бір түрлі байланысқа ғана емес бірнеше байланысқа да әсер етеді.
Молекулярлық кристалдар . Бұл кристалдар Ван-дер-Ваальс байланысында басымдылық көрсетеді. Мұндай байланыс кез-келген элементарлық бөлшектермен пайда болады (иондар, атомдар, молекулалар), бірақ көп кристалдар үшін басқа белгілі күштерге қарағанда азырақ.
Кристалдарда инерттік газдар байланысы Ван-дер-Ваальс тек қана жалғыз, сондықтан ол кристалдың қасиетін және құрылымын анықтайды.
Аргон басқа инерттік газдар тәрізді үлкен қысымда және өте төмен температурада сұйық және қатты күйге ауысады.
Инертті газдардың атомдары толық құрылған энергиялық дәрежені иемденеді, сондықтан атомдардың жақындауы кезінде электрондармен ауысу мүмкін емес. Атомдар арасындағы жақындау күштің пайда болуы жақындау кезінде атомдардың тез арада поляризациялануымен түсіндіріледі (сурет 2. 2) .
Аналогиялық күштер молекула арасында H 2 , N 2 , Cl 2 екі атомдар газдардың кристалдары қаныққан байланыспен әсерлеседі, үлкен қысымда және өте төмен температура кезінде пайда болу мүмкіндігі бар; кристалдарда J 2 , CO 2 , сонымен қатар СН 4 және қалыпты шарт кезіндегі - басқа органикалық заттарда да (полиэтиленде, фторопласта) әсерлеседі.
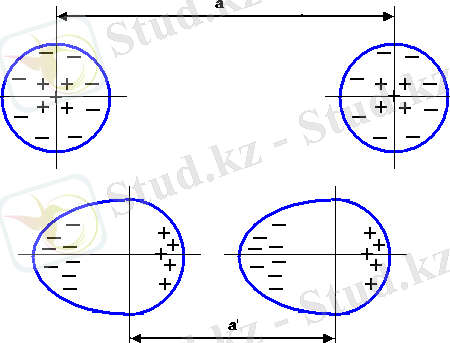
2. 2- сурет. Аргон атомының жақындауы кезінде диполдің пайда болуы
Ван-дер-Ваальс күші бағытталған сипаттаманы иемденбейді, сондықтан көрші әр атомдармен бірге тез арада диполь пайда болады. Нәтижесінде атомдар кристалдық торда көрші санын үлкейтеді, көбіне компактілік бейнеде жатқызылады. Инерттік газдарға арналған торлардың түрлері ЖОТ (ГЦК) торы болып табылады, түйінде атомдар орналастырылады.
Йод кристалы ромбалы шекара орталықтандырылған торды иемденеді (2. 3-сурет), түйінде молекулалар орналасқан.
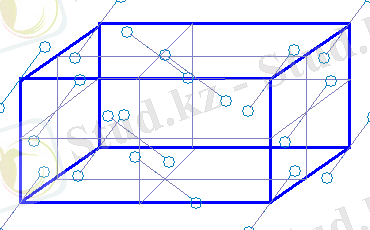
2. 3-cурет. Йодтың кристалдық торы
Ван-дер-Ваальс күшінің байланыс энергиясы үлкен емес, сондықтан молекулярлық кристалдар балқытудың төмен температурасын және булануын қамтамасыз етеді. Қарапайым шарт кезіндегі арасындағы көбісі - газдар. Молекулярлық кристалдар - диэлектрлер, нейтралды электрлік атомдардан құралған кристалл (молкуладан), мұндағы энергиялық шекаралар толығымен құрылған.
Полимерлер үшін аз энергиялық байланыс сызықтық кеңеюдің үлкен температуралық коэфициентті анықтайды.
Молекулярлық байланыстың басты түрі болып су байланысы табылады, ол екі иондар арасында орналасқан ион сутек арқылы пайда болады (протон) . Сутектік байланыс сутек молекулаларымен және кейбір органикалық қосылыстармен бірігеді.
Коваленттік кристалдар . Бұл кристалдар коваленттік байланыс түрін қамтамасыз етеді. Олардан элементтер IV, V, VI топтар пайда болады. Олар электр жағымсыз, сондықтан ол үлкен потенциал ионизациясын иемденеді және басқа топтағы элементтердің әсерлесуімен енеді, өзінің валенттілік шекарасымен салып бітіреді (әртүрлі атомдардың беріктік валенттілік электрондары пайда болады) ; бір-бірімен әсерлесу кезінде атомдар көрші атомдармен бірге ортақтасады, сонымен бірге валенттілік шекараны салып бітіреді.
Коваленттік кристалдар атомдарды, көміртектерді, кремний, германий, сүрмк, висмут және т. б. - ды пайдаға әкеледі.
Олармен электрондар жалпыланатын атомдар саны, элементтің валенттілігіне байланысты болады және (8 - N) ережесіне сәйкес анықталуы мүмкін, мұнда N - элементтің валенттілігі. Мысалы, көміртегінде бұл сан 4-ке тең, яғни көміртегі атомының төрт валенттілік электроны бар, ол олардың көмегімен төрт бағытталған байланысты құрайды және төрт көршілес атоммен алмасулық өзара әрекеттеседі.
Мұндай жалпылама түсінікті қарапайым жүйеден яғни - сутек молекуласынан бастаған жөн. Бұл жағдай коваленттік байланыстың типтік мысалын ұсынады, антибағыттағы қабырғалардың екі электрондармен жүзеге асады. Екі протонды электрлік шекарада екі электрон болады. Екі электронды сутек молекулалары екі атомға жатады, және валенттік шекараның соңынан, барлық уақыт бойы бір атомнан екінші атомға «көшеді», сосын коваленттік ауысым күші пайда болады.
Кристалдық тордың өзегіндегі коваленттік кристалдарда атомдар орналасқан, олардың арасында сол баяғы күштер әсер етеді.
Мысалы, көміртек атомы төрт валенттік электронды иемденеді, сосын төрт бағыттық байланысты иеленеді және төрт көрші атомдарымен аусымдық өзара әсерлесуге кіріседі. Әр сыңар атомдар арасында валенттік электрондармен ауысым пайда болады, молекуладағы атом сутек тәрізді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz