Химиялық термодинамиканың негізгі қағидалары және жасушалық биотермодинамика


Термодинамиканың негізгі бастамалары және заңдары
Кез-келген химиялық өзгеріс барысында жылу белініп не сіңіріледі, немесе химиялық реакция нәтижесінде өзге бip жұмыстар атқарылады. Мысалы, өзіміз білетін бензиннің жануы барысында жылу белініп, двигатель жұмыс істейді, машина қозғалысқа ие болады.
Міне, осы жылу және жұмыс шамалары бойынша химиялық реакцияның жүруін санды түрде сипаттауға мүмкіндік туындайды екен және осы мәселемен айналысатын ілімді химиялық термодинамика деп атайды.
Жүйе (система) - өзімізді қоршаған ортаның кеңістіктегі бөлігі, дене тобы, зат немесе заттар жиыны.
Термодинамикалық жүйе - сыртқы қоршаған ортадан ойша белініп
қарастырылатын, өзара жылу және механикалық әсерлесуде болатын дене не заттар жиыны, тобы.
Термодинамикалық жүйені жабық, ашық және оқшауланған деп үшке бөледі.
Жүйе - өзін қоршаған ортамен зат алмаспай тек энергиясымен ғана алмасса - жабық, ал зат алмасуы да орын алса - ашық жүйе деп аталады.
Оқшауланған (изолированный) жүйеде - қ оршаған ортамен зат және энергия алмасуы орын алмайды.
Жүйені құрайтын дене бөліктері белгілі бip кеңістік бөлігінде бетпен шектеліп, және де сол бөліктің өн бойында химиялық құрамы, құрылымы, термодинамикалық қасиеттері бірдей болса, онда осы бөлікті - фаза - деп атайды.
Жүйе құрайтын фазалар бірдей агрегаттық күйде болса - біртекті (гомогенді), ал әртүрлі күйде болса - әртекті (гетерогенді) деп бөлінеді.
Жалпы термодинамикалық жүйе тыңғылықты сипаттау үшін, оның физикалық - химиялық қасиеттерінен, яғни көлемі, қысымы, температурасы, химиялық құрамы және т. б. хабардар болуымыз керек. Осы орайда өзімізге таныс күй теңдеулерінің тәуелділігінен өзара байланыста болатын шамалар туралы дәйекті ұғым алуымызға мүмкіндік туындайды.
Аталған күй теңдеулерінде кездесетін айналмалылар күй шамалары (параметрі) деп аталынады.
Кез-келген күй шамаларыныц өзгepici термодинамикалық құбылыс (процесс) деп аталынады да күй шамасының тұрақтылығына қарай төмеңдегіше жіктелінеді:
р = const - изобарлы,
V = const - изохорлы,
Т = const - изотермиялы,
Сыртқы қоршаған ортамен жылу және зат алмаспай жүретін құбылыс - адиабатты деп аталып pV γ = const теңдеуімен өрнектеледі. Мұндағы γ - адиабата көрсеткіші және бұл құбылыс оқшауланған жүйелерде орын алады.
Термодинамиканың бірінші заңы
Термодинамиканың бірінші тануының негізгі түрі былай айтылады:
- Түрлі энергиялар бір-біріне тең эквиваленттілік қатынаста айналады.
- Оңашаланған күйде энергияның әр түрінің қысымы өзгермейді.
- Бір түрден екінші түрге айналғанда энергия жоғалмайды да, жаңадан пайда болмайды.
- Жұмысты жоқтан шығаратын машина жасау мүмкін емес.
Термодинамикалық жүйемен энергия алмасуы - жылу мен жұмыс түрінде орын алатындықтан аталған шамалар ішкі энергия өзгерісімен тәуелді байланыста болады.
Жүйеге, жылу түрінде берілген энергия, жүйе ішкі энергиясын өзгертіп, белгілі бip жұмыс атқаруға жұмсалады.
Күнделікті өмірде, тұрмыста орын алатын жылу, жұмыс және ішкі энергия шамаларының өзара байланыстығы термодинамика ілімінің бірінші бастамасы деген атпен төмендегінше тұжырымдалады.
Оқшауланған жүйенің энергиясы тұрақты шама: U ~ const.
Жүйеге қоршаған ортадан жылу түрінде берілген энергия - оның ішкі энергиясын өзгертіп, белгілі бip жұмыс атқарады және бұл математикалық тілде төмендегідей өрнектеледі:
Q = ∆U + A,
мұндағы:
 - жылу мөлшері;
- жылу мөлшері;
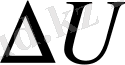 - ішкі энергия өзгерісі;
- ішкі энергия өзгерісі;
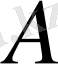 - жұмыс шамасы;
- жұмыс шамасы;
T, p=const
A=p∆V
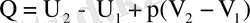
осыдан шығатыны
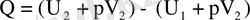

Міне осыдан,
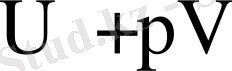 - қосындысы Н - энтальпия деп атайды. Демек, энтальпия термодинамикалық жүйені толықтау сипаттайтын энергетикалық шама.
- қосындысы Н - энтальпия деп атайды. Демек, энтальпия термодинамикалық жүйені толықтау сипаттайтын энергетикалық шама.
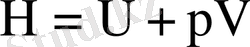 - болғандықтан, энтальпия шамасы да күй функциясы болып табылады, оған ішкі энергия қасиеттерінің бәрі де тән.
- болғандықтан, энтальпия шамасы да күй функциясы болып табылады, оған ішкі энергия қасиеттерінің бәрі де тән.
- АТФ химиялық энергияның жасушадағы негізгі тасымалдаушысы.
Қажетті химиялық қосылыстардың жасушада түзілуі үшін керекті энергия АТФ молекулаларынан макроэргтік байланыстардың гидролизі нәтижесінде пайда болады. Бұл реакция тікелей немесе жанама түрде энергетикалық тиімсіз синтездеу реакциялары үшін қолданылады. АТФ тың гидролизі 2 бағытта жүруі мүмкін.
- Энергияның бөлінуі фосфаттың жоғары тұрақтылығына және көршілес екі фосфат топтарының арасындағы энергетикалық тиімсіз электрлістатикалық тебілістің жойылуына байланысты болады.
АТФ → АДФ + Р ( фосфат )
- Пирофосфат бөлінгенде 2 есе артық энергия бөлінеді, бұл жағдайда АТФ АМФ ке дейін гидролизденеді :
АТФ → АМФ + Р~ Р ( пирофосфат )
Р ~ Р → Р + Р
АТФ тың ыдырау жолы еркін энергияның өзгеру шамасы бойынша анықталады.
Энергияның жылу түрінде бөлінуі, бір жағынан, жүйедегі ретсіздікті жоғарылатады, ал ол молекулалардың ыдырауына және олардың қозғалысының жоюшы әсерінің күшеюіне байланысты болады. Екінші жағынан, экзотермиялық реакцияларда жылудың бөлінуі теңсіз процестердің міндетті шарты болып есептеледі, сол себепті оның әрі қарай тіршілік жасауының жағдайы болып табылады.
- Катаболиттік және анаболиттік реакциялардың өзара байланысы.
Жасушаларда мыңдаған әртүрлі реакциялар жүреді. Олар өзара байланысқан және тіркескен өзгерістер тізбегін құрайды, олардың барысында бір реакциялардың өнімі екінші реакциялардың субстраты болып табылады. Мұндай тіркестер метаболиттік тізбектер деп аталады.
Метаболиттердің тасымалдануы жасушаның ішіне немесе сыртына қарай бағытталуы мүмкін :
- Жасушаның ішіне қарай бағытталған тасымалдау катаболиттік реакциялармен сипатталады, олар бойынша сіңірілген қоректік заттар ұсақталады (қанттарға және қантты фосфаттарға айналады) .
- Сыртқа бағытталған тасымалдау деген гликолиздің аралық өнімдерінен, лимон қышқылының тұйық тізбегінен және т. б. басталатын, сөйтіп күрделі жасуша құрылымдарының пайда болуына әкелетін биосинтез реакциялары немесе анаболиттік реакциялар.
- Катаболиттік және анаболиттік реакциялардың арасындағы өзара байланыс биотермодинамикалық сипаттағы мәселелерді шешу деңгейінде іске асады. Оның қағидасы бойынша, үзілген химиялық байланыстардың энергиясы АТФ молекулаларында жинақталып, содан соң ағза үшін қажетті жаңа, арнайы қосылыстарды түзу үшін пайдаланылады.
ТЕРМОДИНАМИКАНЫҢ 2 ЗАҢЫ.
1. Өз бетінше жүретін процестердің бағыты. Энтропия.
Термодинамиканың 1 заңы бойынша, кез келген процестің барысында, оның ішінде, жанды ағзаларда жүретін процестерде де энергия өшпейді және жоқтан пайда болмайды. Энергияның әртүрлі формалары бір-біріне эквивалентті мөлшерде айналады. Бірақ термодинамиканың 1 заңы энергияның тасымалдануына негізделген процестің бағыты, энергияның ауысуы қаншалықты толық жүретіндігі және химиялық процестің орындалу шегі туралы ақпарат бермейді. Сондықтан бұл мәселелерді шешу үшін басқа термодинамикалық факторларды пайдалану керек.
Неге реакция кері бағытта жүрмейді . Бұл процесті түсіндіру үшін Ю. Томсен және М. Бертло ұсынған максимал жұмыс қағидасын пайдалануға болады. Ол бойынша, жылуды бөле жүретін реакциялар ғана өз бетінше жүруі мүмкін. Бірақ, орыс ғалымдары Д. И. Менделеев және А. Л. Потылицин бұл қағидаға бағынбайтын көптеген фактлерді келтіріп, өз бетінше жүретін эндотермиялық реакциялардың да болатындығын дәлелдеді.
Химиялық және физикалы-химиялық процестердің өз бетінше жүруі жүйенің өз ішкі энергиясын минимумға жеткізіп, энергияның артық мөлшерін барынша сыртқы ортаға бөлуге ұмтылуына байланысты болатындығы айқын. Табиғи процестердің өз бетінше орындалуының екінші себебіне жүйенің максимум ретсіздікке ұмтылуы жатады.
Осыдан, барлық өз бетінше жүретін процестер мынадай екі негізгі факторға байланысты орындалады :
- жүйенің минимум энергияға ұмтылуы ;
- жүйенің максимум ретсіздікке, мүмкіншілігі жоғары күйге ұмтылуы.
Жүйенің мүмкіншілігі жоғары күйінің немесе ретсіздік шамасының сипаттамасына энтропия S, Дж/ моль К жатады. Энтропия да температура, қысым, ішкі знергия және энтальпия сияқты жүйенің немесе заттың табиғатына және күйіне байланысты болады. Термодинамикалық жүйенің белгілі бір күйіне энтропияның белгілі бір мәні сәйкес келеді және жүйенің аталған күйінің мүмкіншілігі неғұрлым жоғары болса, энтропия да соғұрлым жоғары болады.
Көптеген микробөлшектерден құралған жүйенің макрокүйінің мүмкіншілігі микробөлшектердің ( атомдар, молекулалар, т. б. ) орналасу амалдарының және әдістерінің санына байланысты болады. Неғұрлым микробөлшектер көп болса, соғұрлым олардың макрожағдайды туындататын орналасу әдістері көп, соғұрлым энтропия жоғары және соғұрлым жүйенің ішкі энергиясының құны төмен. Осыдан, энтропия жүйенің ішкі энергиясының салыстырмалы құндылығын сипаттайтын фактор болып табылады. Егер реакция барысында энтропия жоғарылайтын болса, жүйенің жалпы энергия қоры өзгермесе де, оны пайдалану және жұмысты орындау мүмкіншілігі азаяды.
Энтропияға мынадай факторлар әсер етеді :
- Температура жоғарылағанда, энтропия жоғарылайды, себебі температура артқанда, ретсіздік артады.
- Заттар кристалданған күйден аморфты күйге немесе сұйыққа, сұйықтан газға айналғанда, энтропия күрт жоғарылайды, себебі ретсіздік артады.
- Қысымның жоғарылауы энтропияға температураның төмендеуі сияқты әсер етеді.
Химиялық реакцияның энтропия өзгерісі энтальпияның өзгерісі сияқты есептеледі:
ΔS = ∑ΔS т. з ∑ΔS б. з.- Гиббс энергиясы. Гельмгольц энергиясы.
Химиялық жүйелердегі энтальпиялық және энтропиялық факторлардың арасындағы айырма ∆G = ∆Н Т∆S химиялық процестердің белгілі бір бағытта жүру қабылетін анықтауға мүмкіндік береді. Егер ∆G < О болса, процесс өз бетінше жүреді, ал ∆G > О болса, реакцияның жүруі мүмкін емес.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz