Ерітінділер теориясы: қасиеттері, ерігіштігі, осмос және судың молекулалық құрылымы


Жоспар
Кіріспе
Ерітінділер теориясы
Негізгі бөлім
- Ерітінділердің қасиеттері, құрылымы
- Ерігіштік қасиеттің табиғаты және заңдылықтары
- Сұйық күйде жүретін үрдістер және олардың қасиеттері
Қорытынды
Пайдаланылған әдебиеттер
1 Бір затта екінші зат еріген еріткіштің де, еріген заттың да қасиеттерінде өзгеріс болады. Еріткіштің қасиеті өзгеруден туатын жаңа қасиеттер барлық ертінділерге ортақ қасиетке айналады. Өйткені еріген заттың бөлшектері көбейген сайын, ерітіндінің кесімді көлеміндегі еріткіштің молекулаларының концентрациясы кемиді; осының салдарынан ерітіндіде еріткішпен салыстырғанда жаңа қасиеттер пайда болады және еріген зат мөлшері неғұрлым көбейе берсе, ол қасиеттер күшейе түседі. Мұндай жаңа қасиеттерден біздің оқитынымыз: осмос, ерітінділер буының қысымы, ерітінділердің қату және қайнау температуралары.
Осмос. Ерітінділердің, оның ішінде сұйық ерітінділердін қасиеттерін зерттегенде, ол ерітіндідегі заттың күйі газ күйіне өте ұқсас екендігі анықталды. Газдардың негізгі қасиеті - диффузия арқылы мейлінше кең көлем алуға тырысуы. Міне, осы қасиет еріген затта да болады, оны былайша дәлелдеуге болады: бір ыдысқа қанттың концентрленген ерітіндісі құйылады және оның үстние араласып кетпейтіндей етіп, ептеп сол қанттың ұсйық ерітіндісін ұқяды. Бұл жағдайда екі жақты диффузия басталады, яғни қанттың молекулалары концентрленген ерітіндіден сұйық ерітіндіге, ал судың молекулалары, керісінше, сұйық ерітіндіден концентрленген ерітіндіге диффузияланады. Біраз уақыт өткен соң қанттың да, судың да молекулалары әбден араласып біркелкі орналасып, ерітіндіміз біртектіге айналады.
Жануарлар, әсіресе, өсімдік организмдерінің тіршілік әрекетінде осмос құбылысы маңызды орын алады. Осмос салдарынан сыртқы ыдыстан ішкі ыдысқа көшкен су ондағы сұйықты түтіктің бойымен жоғары көтереді. Ішкі түтікте туған гидростатикалық қысым белгілі шамаға жеткен кезде осмос тоқтайды. Осмос туғызатын күшті ерітіндінің осмосқысымы дейді.
Осмос қысымын өлшеу үшін, осмос тоқтаған кездегі ерітіндіні сырттан басып тұрған қысым күшін анықтайды.
Айтылып өткен осмос заңы тек сұйық ерітінділері бұл заңға бағынбайды.
Осмостық қысым
Өсімдік клеткасына су негізінен осмос жолымен өтеді. Жартылай өткізгіш мембрана арқылы еріткіштің өтуі осмос деп аталатындығы алдыңғы тақырыптарда айтылған болатын. Жартылай өткізгіш мембрана арқылы бөлінген еріткіш пен ерітінді, немесе екі ерітінді осмос системасы деп аталады. Осмостың физикалық құбылысын алғаш рет ботаниктер өсімдік клеткасынан анықтап, зерттеген. Физик Пфеффер 1877 жылы осмос системасын (осмометрді) құрастырды. Осмос системасында еріткіш оның концентрациясы аз жаққа қарай басым өтеді. Бұл бағытты диффузия екі жақтағы заттардың концентрациясы теңескенше жалғаса береді. Өсімдіктер клеткаларында осыған ұқсас диффузия және осмос құбылыстары өтеді, өйткені олардың бәрі бірігіп осмос системасын құрайды. Вакуолялар ерітінді ролін атқарады, ал плазмалемма мен тонопласт жартылай өткізгіш мембрана болып саналады. Вакуоляның шырыны мен сыртқы ерітінді концентрациясының айырмашылығы нәтижесінде клетка аралығында судың осмостық ағыны пайда болады. Егер бұл жағдайда клетканы концентрациясы жоғары ерітіндіге орналастырса, онда судың клеткадан сыртқы ортаға шығуы арта түседі. Клеткадан судың шығуын экзоосмос, ал клеткаға енуін эндоосмос деп атайды. Экзоосмос нәтижесінде вакуоляның көлемі кішірейіп, цитоплазма мен қабықшаға түсетін қысым әлсірейді де, цитоплазма қабықшадан қашықтайды. Бүкіл протопласт қабықшадан ажырап, шар тәрізді пішінге ие болады, протопласт пен қабықша арасындағы кеңістікке сыртқы ерітінді толады, бұл ерітінді қабықшаның поралары арқылы клеткаға еркін өтеді. Клетканың мұндай күйі плазмолиз деп аталады. Плаз-молиз оңай жойылады. Егер сыртқы ерітіндінің концентрациясын төмендетсе протопласт бастапқы қалпына келеді. Бұл кезде эндо-осмос процесі орындалады. Плазмолизге кері құбылысты деплаз-молиз деп атайды.
Пфеффер осмос системасының ерітінділерінде осмос қысымы бар екендігін алғаш рет анықтап, бұл қысымды өлшеді.
Осмос қысымы деп еріген зат бөлшектерінің жартылай өткізгіш мембранаға түсіретін қысымын түсінеді. Осмос қысымы еріген заттардың концентрациясына тура пропорционал екендігін Пфеффердің жұмыстары көрсетіп берді. Физик-химик Вант-Гофф Пфеффер жұмыстарының нәтижесін газдарды зерттеуге пайдалана отырып, газ қысымы мен осмос қысымы ұқсас деген қорытындыға келді. Сонымен қатар басқа да газдар заңы сұйылтылған ерітінділерге қолдануға жарамды болып шықты. Осмос қысымын анықтау үшін Вант-Гофф мынадай формула ұсынды:
Р = RТіС
мұндағы Р - осмос қысымы, атм;
С - ерітіндінің концентрациясы;
Т - абсолюттік нульден бастап есептегендегі ерітіндінің,
температурасы;
і - еріген зат молекуласынын, диссоциацнялану дәреже-
сің көрсететін изотоникалық коэффициенті;
R - Планктың газ тұрақтысы.
Осмос системасындағы ерітіндінің ғана осмос қысымы болады, ал бұл системадан тыс жағдайда ерітінді тек потенциалдық осмос қысымына ие болады.
Өсімдіктердегі потенциалдық осмос қысымын плазмолиз жолымен немесе сығып алынған клетка шырынының концентрациясыя анықтау арқылы өлшеуге болады.
Клетка суға қаныққан кезде, оның ішіндегі протопласт клетка қабықшасына қысым жасайды. Бұл қысымды тургор (Т) қысымы деп атайды. Клеткаға ағып келетін судың мелшері тургор қысымына байланысты, Т неғұрлым төмен болса, клетканың сору күші 3 соғұрлым жоғары болады. Клетка суға толық қаныққан жағдайда осмос қысымы тургор қысымына тең болады: Р = Т, бұл жағдайда сору күші нульге тең (S = 0) . Бұл көрсеткіштердің арақатынасы мынадай тендеу бойынша анықталады: S = Р-Т.
Бұл теңдеуден клетканың тургор қысымының шамасы неғұрлым аз болса, оның сору қабілеті соғұрлым жоғары болатындығы көрінеді. Т нулые тең болғанда сору күші ең жоғары шамаға жетеді, онда клетканың сору күші осмостық потенциалдын, бүкіл шамасына тең. Алайда сору күші жоғарыда келтірілген теңдеудегі шамадан артып кетуі де мүмкін.
Егер өсімдік клеткасы экзоосмос нәтижесінде суды атмосфераға бөліп шығаратын болса, онда тургор толық жойылған сон, протопластың қабықшадан ажырамайтындығын. В. С. Ильин анықтады. Ішкі жақтан қысымның түсуі тоқталған соң, қабықша сығылатын протопластқа ілесе жиырылады және деформацияланады (пішіні өзгереді) . Клетка қабықшасының бұлайша деформациялануы циторриз деп аталады және ол іштен сыртқа қарай емес, сырттан ішке қарай бағытталған теріс тургор қысымының нәтижесі болып табылады. Сондықтан сору күшінің теңдеуін кері таңбамен жазуға-болады:
S = Р-(-Т) ; S = Р+Т
осының нәтижесінде клетканың сору күші тургор және осмос қысымының қосындысына тең болады.
Теріс тургор қысымы құбылысын папоротник спорангиясының сақиналарындағы осмос қысымын зерттеу арқылы Уршпрунг дәлелдеп берді. Уршпрунг бұл қысымды өлшеп, оның 350 атм екендігін анықтады.
Түрлі өсімдіктердегі, түрлі клетка мен органдардағы осмос қысымы шамасының үлкен айырмашылығы бар. Ен, жоғары осмос кысымы сортаң жерде өсетін галофиттерде кездеседі, құрғақ далада есетін ксерофиттерде оның шамасы біраз төмен, ылғалды ша-бындық жерде есетін мезофиттерде аз, ал су есімдіктері - гидрофиттерде өте аз болады.
Ерітінділер буының қысымы. Ерітінділердің бетіндегі буының қысымы сумен (еріткішпен) салыстырғанда едәуір төмен болуы ерітінділердің қасиеттерінің бірі.
Әрбір сұйық белгілі температурада бетіндегі буымен тепе-теңдікте болады, яғни оның бетінен үзіліп шығып буға айналатын молекулалар саны будан қайтып сұйыққа қонатын молекулалар санына тең болады.
Электролит емес заттардың сұйық ерітінділерінің буының қысымының кемуі, еріткіштің еріткіш мөлшерінде еріген заттың мөлшеріне пропорционал.
Егер таза еріткіштің бу қысымы Р деп, ерітіндінінің Р
1
деп белгілесек, Р - Р
1
бу қысымының кемуін көрсетеді, оны әдетте
 Р деп белгілейді. Енді еріген заттың моль санын
Р деп белгілейді. Енді еріген заттың моль санын
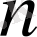 деп, еріткіштін, моль санын N деп белгілесек, Рауль заңы математика тілімен былай жазылады:
деп, еріткіштін, моль санын N деп белгілесек, Рауль заңы математика тілімен былай жазылады:
Рауль заңына сұйық ерітінділер ғана бағынады.
Қышқыл, гидроксид және тұздардың ерітінделері Рауль заңына бағынбайды.
2. Әр заттың өзіне лайықты ерігіштігі болады, сондықтан әр түрлі заттың суда ерігіштігі әр түрлі.
Қатты заттардың көпшілігінің ерігіштігі қыздырылғаннан өсетін болғандықтан, олардың қанық ерітінділерін салқындатса, артық зат кристалданып бөлініп шығады. Бірақ, кейбір заттарда ерекше қасиет болады, мысалы Na 2 SО 4 қанық ерітіндісін еппен өте баяу салқындатса, ондағы еріген заттың артығы бөлініп шықпайды. Мұндайда аса қанық ерітінді, яғни сол температурадағы ерігіштігіне сәйкес еруге тиісті мөлшерден арты затты еріген күйде ұстайтын ерітінді түзіледі; аса қанық ерітінділер тұрақсыздау болады, мысалы оның ішінде еріген заттың, немесе кристалдық түрі ұқсас заттың, кішкене кристалын салса, артық еріген зат түгел, тез кристалданады; аса қанық ерітінді қанық ерітіндіге айналады.
Бұл аса қанық ерітінділерді алғаш ашып зерттеген біздің еліміздің академигі Т. Е. Ловиц (199 т. ) .
Сұйықтардың да көпшіліп суда ериді. Кейбіреулері мысалы, глицерин, спирт т. б. сумен кез келген көлемде араласып, бірінің ішінде бірі шексіз ериді, басқа біреулері, мысалы эфир, белгілі мөлшерде ериді, бірақ температура көтерілсе, бір-біріне еруі күшейіп, ақырында белгілі температурада бір-бірінде шексіз ериді.
Егер бір зат бірімен-бірі араласпайтын, бірінде бірі ерімейтін екі сұйықтықта бірдей ерісе, онда оның әрбір еріткіштегі концентрацияларының қатынасы тұрақты шама болып шығады.
Газдардың суда еруі тіпті әр түрлі. Кейбір газдар, мысалы, азот, сутек, суда өте аз ериді, ал аммиак пен хлорсутек жақсы ериді. Жабық ыдыстың ішінде суда газ еріткенде мынадай динамикалық тепе-тендік туады:
газ+еріткіш еріген газ + Q
энтальпиялық фактор газдардың еруіне қолайлы әсер етеді. Неғұрлым газ еріткішпен күштірек әрекеттесіп, мол жылу бөліп шығарса, соғұрлым оның ерігіштігі жоғары болады. Хлорсутек пен аммиактың суда көп еруінің себебі осында.
Газдардың ерігіштігіне қысымның да әсері бар. Айтылған тепе-теңдікке келіп тұрған газдың үстіндегі қысымды екі есе өсірсек, газдың суға сінген (еріген) молекулалар саны (ерігіштігі) екі есе өседі екен. Мұны Генри заңы дейді: еріткіштің кесімді көлеміндегі газдың еруі, мына тура пропорционал.
Егер сұйықтың бетінде бір емес, бірнеше газдың қоспасы болса, онда ол газдардың ерігіштігі қоспаның жалпы қысымымен емес, қоспадағы әрбір газдың порциал (сыбағалы) қысымымен анықталады (Дальтон заңы) : газдар қоспасы ерігенде, әрбір газ өзі туғызатын проциал қысымына пропорционал ериді.
3. Мембараналық бөлінуге ұшыратылатын сұйық қоспалардың көпшілігі-бұл әртүрлі табиғаттағы заттардың сулы ерітінділері.
Сондықтан мембрана үстіндегі байланысқан қабаттың құрылымы мен қасиеттері негізінен еріткіш-судың молекулаларының құрылысы және қасиеттерімен анықталады.
Судың жеке дара молекулалары көптеген әдістермен жеткілікті түрде егжей-тегжейлі зерттелген. Судың молекуласын құрайтын үш атом төбесінде 109° валенттік бұрыш түзетін тең-бүйірлі үшбұрышты түзеді. Попл жасаған молекуларлық орбитальдар теориясы негізінде су молекулаларының электрондық құрылысын әрқайсысында екі электроннан болатын төрт эллипстік орбитальдар бойынша қозғалатын сегіз сыртқы электрондар түрде көрсетуге болады. Осы орбитальдардың екуінің осьтері О-Н байланыстарының бағытымен сәйкес келеді және олардың арасындағы бұрыш 109°-ты құрайды. Басқа екі орбитальдардың осьтері Н-О-Н жазықтығына перпендикуляр болатын және оттегі атомының ядросы арқылы өтетін жазықтықта жатыр. Бірінші екі орбитальдардың ішінде орналасқан екі протон молекула перифериясында оң заряд орталығын түзеді. Басқа екі орбитальдің электрондары электрондардың бос жұбын түзеді, олардың қозғалысы протондарға қарама-қарсы молекула жанында артық орташа электрондық тығыздықтың пайда болуына, яғни теріс зарядтың екі орталығының пайда болуына әкеледі. Осылайша, судың молекуласының екі оң және екі теріс полюсі болады және сондықтан да ол диполомдық моменті 1, 07 Д тең болатын диполь сияқты болады. Электрондардың сыртқы жұбы судың екі молекуласы арасында сутектік байланыстарды түзуге қатысады. Бұл кезде бір молекуланың сутегі атомдары басқа молекуланың электрондарының бос жұбымен байланысады. Мұндай жүйелерде су молекулаларының біреуі протондоноры ретінде, екіншісі - протон акцепторы ретінде болады. Сонымен бірге, сутек байланысын түзген кезде су молекуласының екі протоны да донор ретінде де, акцептор ретінде де бола алады. Осының салдарынан, судың әрбір молекуласына байланыстаратын кеңістік жүйесін түзетін әртүрлі бағыттарда төрт сутектік байланысқа қатысуы мүмкін. Мұндай сутектік байланыстардың; маңызды ерекшелігі - олардың кооперативті сипаты болып табылады. Егер судың кейбір молекуласы басқа молекуламен донор ретінде байланысқан болса, онда ол мономерлік молекулаға қарағанда акцептор ретінде жаңа байланыс түзеді және керісінше. Яғни аутокотализге ұқсас құбылыс байқалады: донорлық және акцепторлық эффектілердің өзара күшеюі. Осылайша, су молекулаларының әрбір сутектік байланысына осы молекулалар түзген басқа сутектік байланьютар әсер етеді.
Соңғы жылдардың зерттеулері сұйық және қатты күйлік судың ішкі қрылысы өзара тығыз байланысты екенін көрсетеді. Сондықтан мұздың құрылысы туралы мәліметтерсіз судың құрылысын көрсету қиын. Осыған байланысты 1892 жылы Рентген сұйық судың байланысқан молекулаларын мұз молекулалары ретінде қарастыруға болатынын байқады.
Судың құрылымы мен қасиеттерін зерттеу саласында қазіргі уақытта елеулі нәтижелерге қол жетті. Судың құрылымдық модельдері мен
көптеген теориялары ұсынылған. Алайда, бұлардың бір-біріне қарама-қайшы болатын кемшілігі бар. Қазіргі таңда бар эксперименталдық мәліметтер осы0 қарама - қайшылықтарды шешу үшін жеткіліксіз. Сондықтан су ортасында жүретін нақты процестерді қарастырған кезде бірнеше теорияларды пайдалануға мәжбүр болады, олардың сәйкес аспектілері мәселенің шынайы жағдайын дәл көрсетеді. Су аномальді сұйықтықтар класына жататындығы ертеден мәлім. Оның қасиеттері қалыпты (нормалды) сұйықтықтардың қасиеттерін елеулі ерекше болады. Судың тағы бір аномальды қасиеті оның айнымалы қалпының болуы. Бұл жағдай 4, 15, 30, 45, 80, 140, 165, 205, 270°С температура аймақтарында байқалатындығы жұмыстарында нақты көрсетілген. Судың осы аномальді қасиеттерінің көріну себептерін құрылымдық айналудың болуымен және судың құрылымдық элементтеріндегі жоғары ретті фазалық өтумен түсіндіретін болжамдар айтылды. Алайда мұндай пікірлер ғылыми-ілімдік негізде нақтыланбады.
Қазіргі кездегі ғылыми ізденістер нәтижелері судың аномальды емес жалпы қасиеттеріне де нақты түсініктеме бере алмайды.
Сұйық судың кейбір қасиеттерін алғашқы рет Берналл және Фаулердің
моделі негізінде түсіндіруге мүмкін болды, бұл модельге сәйкес сұйық суда оның молекулалары бір-біріне тығыз жанаспайды. Сұйық судағы сутектік байланыстардың кеңістік бағытталуы салдарынан судың молекулалары молекула аралық қуыстарды түзіп, елеулі арақашықтарда ұсталады. Бұл судың шын тығыздығы 1, 0 т/см 3 болып, су молекулаларының тығыз жанасуы кезіндетығыздығы 1, 8 т/см 3 болатындығымен расталады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz