Идеал газ күйінің теңдеуі және газ заңдары


Идеал газ күйінің теңдеуі
Газ заңдары.
Сендер бұл тарауда газдар туралы соншалықты жаңа мағлұматтар кездестірмейсіңдер. Мұнда негізінен температура және басқа макроскопиялық параметрлер ұғымдарынан туындайтын салдарлар туралы сөз болмақ. Молекулла-кинетикалық теорияның негізгі теңдеуі бізді сол пораметрлер арасындағы байланысты тағайындауға келіп саяды.
Идеал газ күйінің теңдеуі.
Газдың берілген массасының күйі үш макроскопиялық параметрмен сипатталады: қысым р, көлем V - көлем және температура Т Қазір біл олардың арасында қандай байланыс барлығын табамыз, ал содан соң ол байланыс не үшін керектігін көреміз.
Күй теңдеуі. Біз идеал газдың жайын молекула-кинетикалық теория тұрғысынан жүйелі қарастырдық. Газ қысымының молекулаларының шоғырына және температурасына тәуелді болатыны анықталды. Осы тәуелділік негізінде жеткілікті сиретілген газдың берілген массасының күйін сипаттайтын барлық үш макроскопиялық параметр р, V және Т-ні байланыстыратын теңдеуді алуға болады .
Бұл теңдеу идеал газ күйінің теңдеуі деп аталады.
Мына р = nkT теңдеуіне газ молекулалары шоғырына арналған өрнекті қоямыз, формуланы ескере отырып, газ шоғырын мына түрде жазуға болады:
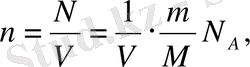
мұндағы N А - Авогадро тұрақтысы, т - газдын массасы, М-оның мольдік массасы,
(3. 1) теңдеуін (2. 10) - теңдеуіне қойғанан кейін мынаны аламыз:
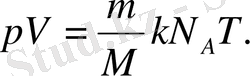
Больцман тұрақтысы k мен Авогадро тұрақтысы N А -ның көбейтіндісін универсал (мольдік) газ тұрақтысы деп атайды және оны R әріпімен белгілейді:
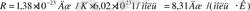
(3, 2) теңдеудегі kN А көбейтіндісінің орнына универсал газ тұрақтысы R-ді қойып, массасы қалауымша алынған идеал газ күйінің теңдеуін аламыз:
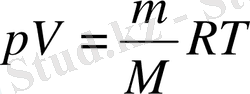
Бұл теңдеуде газдың тегіне тәуелді болатын бір ғана шама бар, ол - оның мольдік массасы.
(3. 4) -күй теңдеуінен кез келген екі күйдегі идеал газдың қысымы, көлемі және температурасы арасындағы байланыс келіп шығады.
Егер индекс 1-мен - бірінші күйге қатысты параметрлерді белгілесек, ал индекс 2-мен-екінші күйге қатысты параметрлерді белгілесек, онда (3. 4) -теңдеуге сәйкес газдың берілген массасы үшін
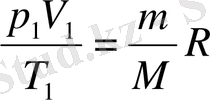 және
және
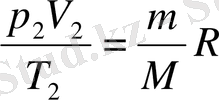
теңдеулерін аламыз.
Бұл теңдеулердің оң бөліктері бірдей. Демек, олардың сол бөліктері де тең болуға тиіс:
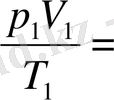
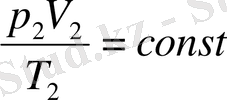
(3. 5) -түріндегі күй теңдеуі Клапейрон ' теңдеуі делінеді жәнс бұл күй теңдеуін жазудың бір түрі болып табылады.
(3. 4) -түріндсгі күй теңдсуін бірінші рет ұлы орыс ғылымы Д. И. Менделеев алған. Сондықтан оны Менделеев - Клапейрон теңдеуі деп атайды.
Күй теңдеуі ие үшін керек? Тек идеал газ ғана емес, тіпті кез келген тақты жүйеде - газ, сұйық немесе қатты дене - өзінің күй теңдеуімен сипатталады. Бірақ ол теңдеулер идеал (жеткілікті сиретілген) газ үшін Менделеев - Клапейрон теңдеуінен әлдеқайда күрделі.
Күй теңдеуін білу жылулық құбылыстарды зерттеуге қажет. Ол түрлі мәселелердің үш тобына бірден толық немесе жарым-жартылай жауап беруге мүмкіндік береді.
Күй теңдеуі күйді сипаттайтын екі шама белгілі болса, онда басқа бір шаманы, мысалы температураны, аныктауға мүмкіндік береді. Термометрлерде дәл осы қасиет пайдаланылады.
Күй теңдеуіне сүйене отырып, белгілі бір сыртқы жағдайларда жүйедегі түрлі процестердін калай жүріп жатқанын, мысалы температураны өзгертпей, газдың көлемін арттырсақ, оның қысымы қалай өзгеретінін т. б. айтуға болады. Келесі такырып осыған арналған.
Ақырында, күй теңдеуін біле отырып, егер жүйе жұмыс істеп тұрса немесе қоршаған денелерден жылу алса, онда жүйенің күйі қалай өзгеретінін айтуға болады. Бұл туралы «Молекулалық физика. Жылу құбылыстары» белімінің соңғы жағында айтылады.
Күй теңдеуін тәжірибе жүзінде тексеру . (3. 5) -түріндегі күй теңдеуінің дұрыстығына 24-суретте кескінделген приборлардың көмегімен тәжірибе жасап көз жеткізуге болады.
Герметикалық кеңірдекті ыдыс, өзінің ішіндегі қысымды көрсетіп тұратын манометрмен қосылған. Винтті айналдырып, ыдыстын көлемін өзгертеміз, Көлемді сызғыштың көмегімен анықтауға болады. Ыдыстағы газдың температурасы айнала қоршаған ауаның температурасына тең және оны термометр көрсетіп тұрады.
Газдың бастапқы күйіндегі
р
1
қысымды,
Т
1
температураны және
V
1
көлемді,
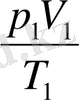 қатынасын есептеуге болады (мұндағы
Т
- Цельсий шкаласы бойынша алынған температура емес, абсолют температура екені есте болуы керек) .
қатынасын есептеуге болады (мұндағы
Т
- Цельсий шкаласы бойынша алынған температура емес, абсолют температура екені есте болуы керек) .
Осыдан кейін ыдыстың көлемін өзгерту және ыдысты ыстық суға салып, газды қыздыру керек (24, 6-сурет) . Енді


газдың р
2
қысымын,
V
2
көлемін және
Т
2
температурасын тағы да өлшеп,
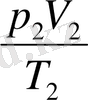 қатынасын есептеуге болады.
қатынасын есептеуге болады.
Тәжірибелік қондырғы аныктап беретін дәлдік шектеріне қарай, күй теңдеуі (3. 5) орындалады. Тек жүздеген атмосфералық қысымда ғана идеал газ күйі теңдеуінің эксперимент нәтижелерінің алдын ала болжанған мөлшерден едәуір ауытқуы байқалады. Тығыз газдарды тіпті жуықтап болса да идеал деп есептеуге болады.
- * Күй теңдеуін әрдайым қорытып шығарудың қажеті жоқ, оны тек есте сақтау керек. Универсал газ тұрақтысының мәнін де есте тұткан теріс болмайды: R≈8 Дж/(моль-К)
ГАЗ ЗАҢДАРЫ
Идеал газ күйі теңдеуінің көмегімен газ массасы және үш параметрдің - қысым, көлем немесе температура - біреуі өзгермей қалған жағдайдағы процестерді зерттеуге болады. Газдың бір параметрінің мәні тағайындалып, қалған екі мәні арасындағы сандық тәуелділікті айқындайтын заңдарды газ заңдары деп атайды.
Параметрлердің біреуінің мәні өзгермей қалған кезде өтетін процестер изопроцестер деп аталады. Изопроцестер табиғатта кең таралған және техникада жиі пайдаланылады.
Шынында да, ешбір процесс кандай да болмасын қатаң тағайындалған бір параметрдің мәнінде жүрмейді. Температураның, қысымның немесе көлемнің тұрақтылығын бұзуға әсер ететін кандай да бір жағдайлар болады. Тек лабораториялық жағдайларда ғана қайсыбір параметрлердің тұрақтылығын тым дәлірек сақтауға болады, бірақ жұмыс істейтін техникалық құрылғыларда және табиғатта бұл іс жүзінде әсте мүмкін емес. Изопроцесс - бұл тақты процестің идеалдандырылған моделі. Ол шындықты тек жуық қана бейнелейді.
Изотермиялық процесс. Температура тұрақты болғанда макроскопиялық денелердің термодинамикалық жүйесі күйінің өзгеру процесін изотермиялық деп атайды. Газ температурасын тұрақты етіп ұстау үшін ол температурасы тұрақты болып тұратын үлкен жүйемен - термостатпен - жылу алмасатындай болуы қажет. Өйткені сығылғанда немесе ұлғайғанда газдың температурасы өзгеретін болады. Егер атмосфералық ауаның температурасы бүкіл процесс барысында елеулі өзгермесе, онда ол термостат қызметін атқара алады.
Идеал газ күйінің теңдеуіне (3. 4) сәйкес тұрақты температурадағы кез келген күйде газ қысымынын оның көлеміне көбейтіндісі тұрақты болады, яғни Т = const болғанда.
р V = const. (3. 6)
Егер газдың температурасы өзгермесе, онда оның берілген массасы үшін газ қысымының көлемге көбейтіндісі тұрақты болады.
Бұл заңды тәжірибе жүзінде ағылшын ғалымы Р. Бойль (1627-1691), одаң біраз кейінірек француз ғалымы Э. Мариотт (1620-1684) ашты. Сондықтан ол Бойль - Мариотт заңы деп аталады.
Бойль - Мариотт зацы кез келген газ үшін, сондай-ақ олардың қоспасы үшін де, мысалы, ауа үшін де дұрыс. Тек атмосфералық қысымнан бірнеше жүз есе жоғары қысымдарда ғана бұл заңнан ауытқу елеулі түрде байқалады.
Атмосфералықка жақын қысымдарда Бойль - Мариотт заңының дұрыстығына алдыңғы параграфта сипатталған қондырғының көмегімен кез жеткізуге болады.
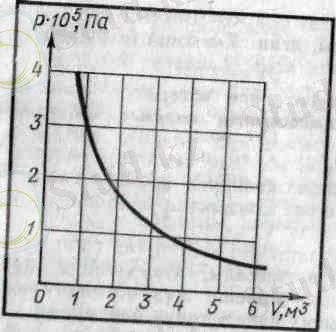
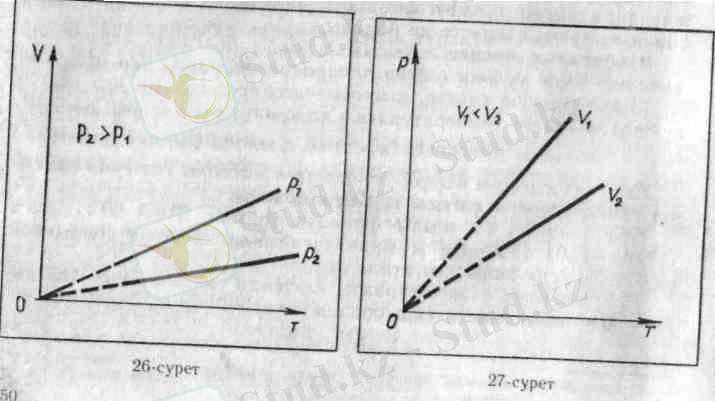
Тұрақты температурада газ қысымының көлемге тәуелділігі график түрінде изотерма деп аталатын қисық сызық арқылы кескінделеді. Газдың изотермасы қысым мен көлемнің арасындағы кері пропорционал тәуелділікті өрнектейді. Кисық сызықтың мұндай түрін математикада гипербола деп атайды.
Әр түрлі тұрақты температураға әр түрлі изотермалар сәйкес келеді. Егер V = const болса, температура жоғарылағанда қысым күй теңдеуіне (3, 4) сәйкес артады. Сондықган жоғарылау Т 2 температураға сәйкес изотерма, төменірек Т 1 температурага сәйкес келетін изотермадан жоғары жатады.
Компрессормен ауаны сығу процесін немесе ыдыстагы ауаны сорып шығарганда поршень астындағы ауаның ұлғаюын - шамамен изотермиялық процесс деп есептеуге болады. Шынында, бұл жағдайда температура өзгеретіні рас, алайда алғашкы жуықтауда ондай өзгерісті елемеуге де болады.
Изобаралық процесс. Қысым тұрақты болғанда термодинамикалық жүйе күйінің өзгеру процесі изобаралық [ деп аталады . (3. 4) -теңдеуіне сәйкес, қысымы өзгермесе газдың кез келген күйінде көлемнің температураға қатысы тұрақты болып калады.
р = const болғанда,
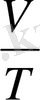 = const (3. 7)
= const (3. 7)
Егер газ қысымы өзгермесе, берілген массалы газ үшін көлемнің температураға қатысы тұрақты болады.
Бұл заңды 1802 жылы француз ғалымы Г е й - Л ю с с а к (1778-1850) тәжірибе жүзінде тағайындаған және сондыктан ол Гей-Люссак заңы деп аталады.
(3. 7) -қатыска сәйкес тұрақты қысымда газдың ке. іемі температураға сызықтық тәуелді болады, яғни:
V = const · Т
Бұл тәуелділік график түрінде изобара деп аталатын түзумен кескінделеді
Әр түрлі қысымға әр турлі изобара сәйкес келеді. Қысым арткан сайын, тұрақты температурада Бойль- Мариотт заны бойынша газдың көлемі кішірейеді. Сондықтан жоғарырақ р 2 қысымпі сәйкес келетін изобара төменірек р 1 қысымға сәйкес келетін изобарадан төменірек жатады.
Төменгі температуралар аймағында идеал газдың барлық изобаралары Т =0 нүктесінде түйіседі. Бірақ бұл реал (тақты) газдың көлемі шынында да нөлге айналады деуге болмайды. Барлық газдар қатты суынғанда сұйыққа айналады, ал күй тендсуі (3. 4) сұйықтарға колданылмайды.
Жылжымалы поршеньді цилиндрдегі газды кыздырғанда оның ұлғаюын изобаралық процесс деуге болады. Онда цилиндрдегі қысымның тұрақтылығы поршеньнің үстіңгі бетіне атмосфералық ауа қысымының әсері арқылы жүзеге асады.
Изохоралық процесс. Көлем тұрақты балғанда термодинамикалық жүйе күйінің өзгеру процесін изохоралық деп атайды.
Күй теңдеуінен (3. 4) газдың көлемі өзгермеген кездегі кез келген күйінде газ қысымының температураға қатысы тұрақты болатыны шығады:
V
= const болғанда,
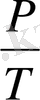 = const (3. 9)
= const (3. 9)
Егер газ көлемі өзгермесе массасы берілген газ үшін қысымның температураға қатысы тұрақты болады.
Бұл газ заңын 1787 жылы француз физигі Ж. Шарль (1746-1823) ашкан және сондықтан ол Шарль заңы деп аталады. (3. 9) -теңдеуіне сәйкес көлем тұрақты болғанда газ қы-сымы температураға сызықтық тәуелді болады, яғни
Р = const Т , (3. 10)
Бұл тәуелділік графикте түзумен кескінделеді де, ол изохора деп аталады (27-сурет) . Түрлі көлемге түрліше изохора сәйкес келеді. Температура тұрақты болғанда, Бойль - Мариотт заңына сәйкес, газ көлемі ұлғайғанда оның қысымы азаяды. Сондықтан үлкен V 2 көлемге сәйкес келетін изохора, кіші V 1 көлемге сәйкес келетін изохорадан төмен жатады. (3. 10) -теңдеуге сәйкес барлық изохоралар Т = 0 нүктесінен басталады. Демек, абсолют нөлде идеал газдың қысымы нөлге тең.
Кез келген жабық ыдыстағы немесе электр шамындағы газды қыздырғандағы газ қысымының ұлғаюы изохоралық процесс болып табылады. Изохоралық процесс көлемі тұрақты газ термометрлерінде пайдаланылады.
Газ заңдарын еске тұту міндет емес. Кез келген газ заңын идеал газ күйі теңдеуінен өздерің-ақ шығарып аласыңдар.
Есеп шығару үлгісі.
Күй теңдеуіне және газ заңдарын пайдалануға берілген есептерде әдетте төмендегідей жағдайлар кездеседі:
- Газдың бастапқы күйі кезіндегі макроскопиялық параметрлер және ақырғы күйдегі қайсібір параметрлер белгілі.
Егер бастапқы күйден ақырғы күйге ауысқан кезде параметрлердің біреуі өзгермеген болса, ондай изотермиялық процесте (3. 6) -түріндегі немесе осы (3. 6) -дан шығатын оның эквивнленті
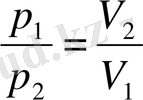 түріндегі Бойль - Мариотт заңын пайдалануға болады. Изобаралық процесте (3. 7) -түріндегі немесе оның
түріндегі Бойль - Мариотт заңын пайдалануға болады. Изобаралық процесте (3. 7) -түріндегі немесе оның
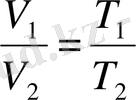 эквиваленті түріндегі Гей-Люссак заңын: ал изохоралық - (3. 9) түріндегі немесе оның
эквиваленті түріндегі Гей-Люссак заңын: ал изохоралық - (3. 9) түріндегі немесе оның
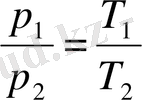 эквиваленті түріндегі Шарль заңын пайдалану керек.
эквиваленті түріндегі Шарль заңын пайдалану керек.
Егер барлық үш параметр де өзгерсе, онда (3. 4) немесе (3. 5) күй теңдеуін пайдалануға болады:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz