α-Амин қышқылдары, пептидтер мен белоктардың құрылымдық ұйымдасуы, стереоизомериясы және сапалық реакциялары


Жоспар
І Кіріспе
ІІ Негізгі бөлім
- Амин қышқылдары пептидтер мен белоктар.
- Амин қышқылдарының стереоизомериясы.
- Амин қышқылдарының сапалық реакциялары.
ІІІ Қорытынды
α - Амин қышқылдары, пептидтер мен белоктар
Маңызды α - амин қышқылдарының құрылысы мен қасиеттері және белокты молекулалардың құрылымдық ұйымдасуының химиялық негізі жайлы білімді қалыптастырып, белоктардың биологиялық қызметін одан әрі
молекулярлы деңгейде зерттеу.
Молекуласында бір мезгілде амин және карбоксил топтары болатын гетерофункционалды косылыстарды амин қышқылдары деп атайды. Карбоксил тобына қарағанда амин тобының орналасуына байланысты α -, β-, γ- және т. б. амин қышқылдары деп бөледі. Алуан түрлі пептидтер мен белоктар α -амін қышқылдарының калдықтарынан тұрады.
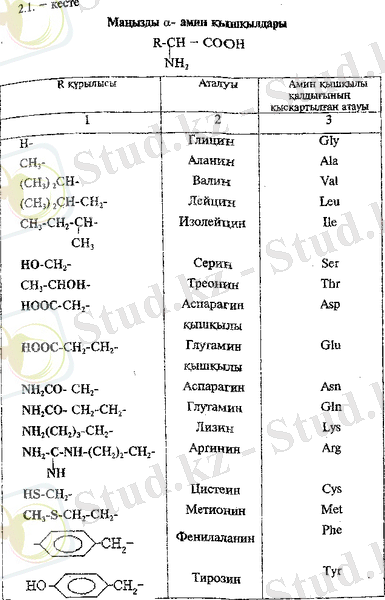
Табиғатта кездесетін амин қышқалдарының жалпы саны 300-ге жетеді, дегенмен олардың біразы тек белгілі түрлер қауымдастығыңда немесе бір ағзаның өзінде табылған. Амин қышқылдарының ішінде барлық белоктарда үнемі кездесетін аса маңызды 20 α - Амин қышқылдарынан тұратын топты ерекше бөліп көрсетуге болады (2. 1. -кесте) .
α - Амин қышқылдары қатты күйде және сулы ерітінділерде рН-тың бейтарап мәндерінде көбінесе диполярлы иондар түрінде болады. α - Амин қышқылдары - суда жақсы еритін қристалдық заттар. Олардың көпшілігі тәтті дәмді заттар. Брі қасиет α - амин кьшқылдарының гомологтық қатарының бірінші мүшесі - глициннің атауынан да айқын көрінеді.
Тірі ағза үшін α - амин қышқылдарының негізгі көзіне қорек белоктары жатады.
Көптеген α - амин қышқылдары ағзада синтезделеді, бірақ белоктар синтезіне қажетті кейбір α - амин қышқылдары ағзада синтезделмейді, олар қорекпен бірге келіп отыруы кажет. Мұндай амин қышқылдарын ауыстыруға болмайтын қышқылдар деп атайды, Мысалы валин, лейцин, изолейцин, лизин, треонин, метионин, фенилалалин, триптофан. Әсіресе туа біткен кейбір аурулар кезінде ауыстыруға болмайтын қышқылдар тізімі жиі ұлғаяды. Айталық фенилкетонурия кезіңде адам ағзасы тағы бір α - амин қышқылы
 н - тирозинді синтездемейді, ал ол әдетте дені сау адамдардың ағзасында фенилаланиннің гидроксиклденуі кезінде түзіледі.
н - тирозинді синтездемейді, ал ол әдетте дені сау адамдардың ағзасында фенилаланиннің гидроксиклденуі кезінде түзіледі.
α - Амин қышқылдары азотты алмасуда негізгі орын алады. Олардың көпшілігі медициналық практикада ұлпалық алмасуға әсер ететін дәрілік заттар ретінде колданылады. Мысалы, глутамин қышлқылы орталық жүйке жүйесін емдеу үшін, метионин және гастадин бауыр ауруларын емдеу және алдын алу үшін, цистеин көз ауруларын емдеу үшін қолданылады. α - Амин қышқылдарын топтарға бөлудің негізіне алынған белгісіне байланысты бірнеше әдістермен жіктейді. Жіктеу белгілерінің біріне радикалдың (R ) химиялық табиғаты жатады. Бұл белгісіне қарай α - амин қышқылдары алифатты, ароматты және гетероциклді қышқылдар деп бөлінеді.
Алифатты α - амин қышқылдары саны жағынан ең көп топты құрайды. Бұл топтың ішінде оларды қосымша жіктелу белгілерін ескере отырып бөледі, Мыеалы, молекулалардағы карбоксил және амин топтарының санына байланысты бейтарап (бір NН 2 - және бір СООН- топтар), негіздік (екі NН 2 - және бір СООН- топтар) және қышқылдық (бір NН 2 - және екі СООН- тоіттар) амин қышкылдары деп бөледі.
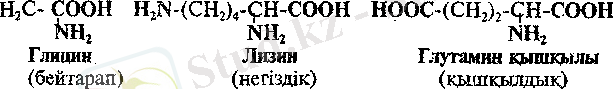
Алифатты радикалда тағы да басқа функционалдық топтар болуы мүмкін, мысалы, серин мен треонинде гидроксил, аспарагин және глутамин қышқылдарында карбоксил, цистиңде тиол, аспарагин мен глутаминде амид топтары бар.
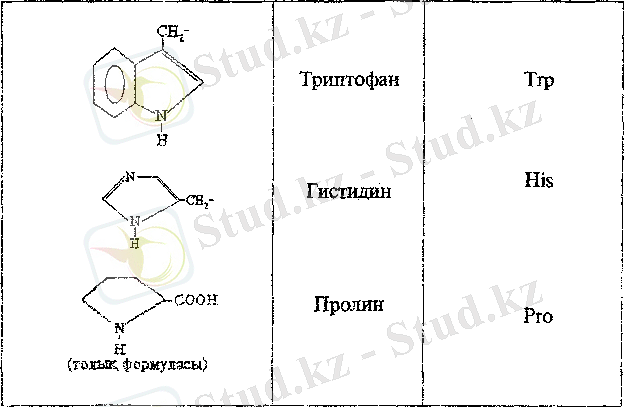
Ароматты және гетероциклді α - амин қышқылдарын аданиннің орын басқан туындылары ретінде қарастыруға болады.
α - Амин қышқылдарының стереоизомериясы. α - амин қышқылдарын құраетыру принципі, яғни жалғыз бір ғана көміртегі атомында екі әртүрлі функционалдық топтардың, радикалдың жене сутегі атомының болуы - α -көміртегі атомының хиральді екеңдігіне нұсқайды. Тек қана карапайым α - амин қықылы глицинде NН 2 СН 2 СООН көмірсутек радикалы Е болмағандыктан, хиральдылық орталығы да жоқ болады.
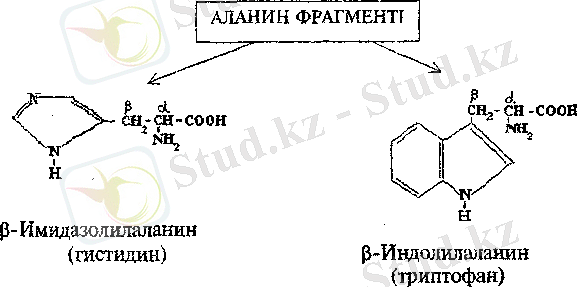
α - Амин қышқылдарының салыстырмалы конфигурациясы гидроксиқышқылдар жағдайындағыдай конфигурациялық стандарт- глицерин альдегиді бойынша "гидроксиқышқылдық" кілтті пайдалану арқылы анықталады. Фишердің проекциялық формуласында амин тобының сол жақта орналасуы (L - глицерин альдегидіндегі ОН - тобы сияқты) хиральді көміртегі атомының L - конфигурациясына, ал оң жақта орналасуы D конфигурациясына сәйкес келеді. Белгілеулердің R, S-жүйесі бойынша L-қатардағы барлық α - амин қьшқылдарында α - көміртегі атомы S -конфигурацияға, ал D - қатардағылары - R - конфигурацияға ие болады (цистинді қоспағанда) .
Көптеген α - амин қышқылдардың бір асимметриялық көміртегі атомы бар және олар оптикалық активті екі энантиомерлер мен бір оптикалық активті емес рацемат түрінде кездеседі, Барлық дерлік табиғи α - амин қышқылдары Ь - қатарға жатады.
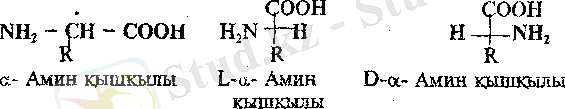
а-Амин хяшқщдары изолейщш, треонин, 4-гидроксипролинде екі хиралъдық орталықтары бар,
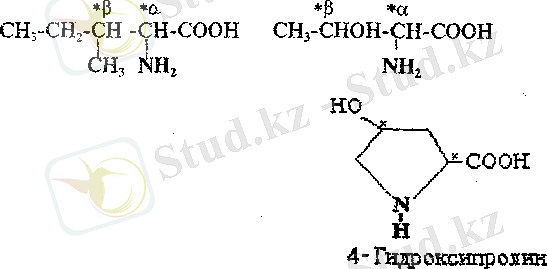
Бұл амин қышқылдары төрт диастереомерлер түрінде кездесуі мүмкін, ал олар әрқайсысы рацемат түзетін екі энантиомерлер тобын құрайды. Төрт стереоизомерлердің ішіңде адам ағзасының белоктарын құру үшін біреуі ғана қолданылады. Екі хиральдық орталықтары цистин молекуласында да бар, бірақ онда жазықтық симметриясының болуынан оның стереоизомерлерінің саны үшке тең. Цистиннің мезоформасы оптикалық активті емес.
Адам ағзасының белоктарын құрастыру үшін α - амин қышқылдарының стереоизомерлерінің тек қана бір түрін, яғни L - энантиомерлерді қолдану белоктардың кеңістіктегі құрылымын қалыптастыру үшін маңызды болып саналады. Онымен ферменттер әрекетінің стереоспецификалылығы тікелей байланысты.
α - амин қышқылдарынан (яғни хиральды материалдан) құралған ферменттердің макромолекулалары жалпы алғанда хиральды болып табылады және сондықтан олар белгілі конфигурациясы бар субстраттармен ғана әрекеттесуге түседі.
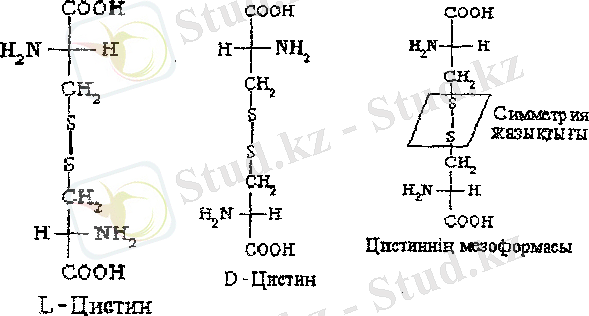
D-қатардың α - амин қышқылдарын кейде "табиғи емес" қышқылдар деп атайды, өйткені олар адам ағзасының белоктарын құрастыруға қолданылмайды. D- α - амин қышқылдары микроорганизмдерден бөлінетін көптеген табиғи пептидтерде кездеседі, мысалы, антибиотиктерде (грамицидин, актиномацин, полимиксин), сонымен қатар, бактериялардың жасуша қабырғаларының биополимерлерінің құрамында, мысалы, D-глутамин қышқылының калдығы күйдіргі бактерияларының қабығында кездеседі. Бактериялардың бұл түріне қарсы адамдар мен жануарлардың ыдыратушы ферменттері әлсіз болады.
Әртүрлі стереохимиялық қатарларға жататын α - амин қышқылдары бір-бірінен дәмі жағынан өзгешеленеді. Мысалы, D- глутамин қышқылы дәмсіз, ал L- глутамин қышқылы ет дәмі бар зат. Сондықтан бидай ұлпасынан алынатын Ь-глутамин қышқылын натрий глутаматы түріңде тамақ концентраттарына қосылатын дәмдік қоспа ретінде пайдаланады. Тәтті дәмді D -қатардың номерлері: валин, лейцин, треонин, метионин, аспарагин қышқылы, тирозин, триптофан, гистидин. Олардың энантиомерлері дәмсіз не болмаса ащы дәмді болады. L- қатардың изомерлері ішінде тәтті дәмге аланин, серин, пролин ие. Осыған қатысты α - амин қышқылдары көмірсулар табиғаты бар тәтті заттарды алмастырушы заттар ретінде диабет проблемасына байланысты басты назар аударып отыр. Қазіргі кезде өнеркесіптік масштабта тамақ заты аспартам шығарылады, ол сахарозамен салыстырғанда 200 еседей тәтті және амин қышқылдық табиғаты бар зат. Аспартам - дипептид, ол L - аспарагин қышқылының және L-фенилаланиннің метил эфирінің қалдықтарынан құралған.
L-қатардағы α - амин қышқылдарын алу үшін белоктарды
гидролиздеп ыңыратады. Синтездік жолмен, мысалы, α -
галогенкарбон қышқылдарын аммонолиздеу арқылы тек қана
рацемиялық α - амин қышқылдары алынады. Жеке энантиомерлерге қажеттіліктің көп болуына байланысты (белоктар, дәрілік заттар және т. б. синтезі үшін), жасанды рацемиялық α - амин қышқылдарын ыдыратудың химиялық әдістері ойластырылған. Дегенмен, анағұрлым жоғары бағаланатыны N - ацетил - L - α - амин қышқылдарын гидролиздеуге қабілетті ацилаза ферменттерін қолдана отырып ыңыратудың ферментативті әдісі болып саналады.
α - Амин қышқылдарының сапалық реакциялары. Амин қышқылдары мен белоктар химиясы өз уақытында химиялық анализдің негізін құраған көптеген сапалық (түсті) реакциялардың болуымен ерекшеленеді. α - Амин қышқылдарының жалпы сапалық реакциясы - олардың нингидринмен реакциясы. Нингидрин реакциясының өнімі көк-күлгін түсті болады, оны амин қышқылдарын хромотограммаларда (қағазда, жұқа қабатта) көзбен байқап анықтау үшін, сонымен қатар амин қышқылы анализаторларда спектрофотометриялық анықтау үшін қолданады (өнім 550-570 нм аумағында жарықты сіңіреді) .
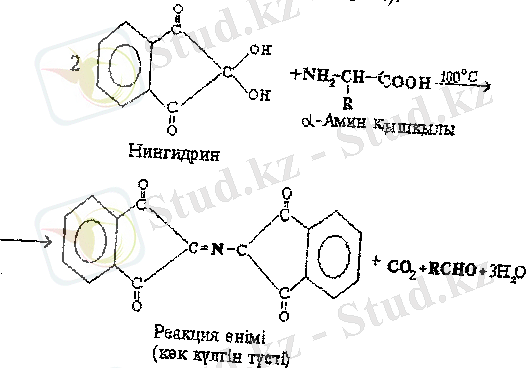
 Пептидтер мен белоктардағы пептидті байланыстарды анықтау үшін биурет реакциясы қолданылады. Бұл реакцияға ең кеміңде екі мұңдай байланыстары бар барлық пептидтер мен белоктар түседі. Сілтілі ерітінділерде биурет мыс (II) иондарымен әрекеттескенде күлгін түсті хелатты комплекс түзіледі (биурет реакциясы) .
Пептидтер мен белоктардағы пептидті байланыстарды анықтау үшін биурет реакциясы қолданылады. Бұл реакцияға ең кеміңде екі мұңдай байланыстары бар барлық пептидтер мен белоктар түседі. Сілтілі ерітінділерде биурет мыс (II) иондарымен әрекеттескенде күлгін түсті хелатты комплекс түзіледі (биурет реакциясы) .
Хелатты комплексте биурет қалдығы имидті структуралы болады.
Жеке α - амин қышқылдарын немесе туыстас α - амин қышқылдар топтарын анықтау үшін бірқатар жеке реакциялар белгілі. Триптофанды n-аминбензальдегид көмегімен күкірт қышқылы ортасында қызыл-күлгін түстің пайда болуына қарай анықтайды (Эрлих реакциясы) . Бұл реакцияны белоктардың ыдырау өнімдерінің құрамындағы триптофанға сандық анализ жасау үшін қолданады.
Цистеинді оның кұрамындағы меркаптотоптың реакцияласу қабілетіне негізделген бірнеше сапалық реакциялардың көмегімен анықтайды. Мысалы, белок ерітіндісін қорғасын ацетатымен (СН, СОО) 2Рb сілтілі ортада қыздырғанда, қорғасын сульфидінің РbS қара тұнбасы түзіледі, ал бұл белоктарда цистеиіннің бар екеңдігіне нұсқайды.
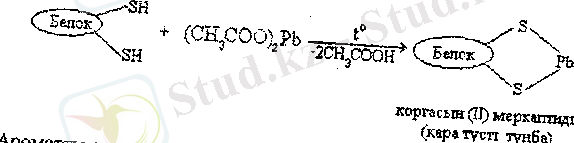
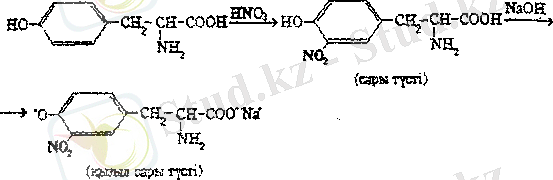
Ароматты және гетероциклді α - амин қышқылдарын анықтау үшін ксантопротеин реакциясы қолданылады. Бұл реакция фенилаланинге, тирозинге, гистидинге, триптофанға арналған. Мысалы, концентрлі азот қышқылымен тирозинге әсер еткеңде, сары түсті нитроқосылыс түзіледі, Оған сілті қосқанда фенолды гидроксид тобының колдануына және анионның қабысуға қосатын үлесінің артуына байланысты қызыл сары түс пайда болады.
Пептидтер мен белоктардың біріншілік кұрылымы
Пептидтер мен белоктар α - амин қышқылдарының калдықтарынан құралған қосылыстар. Шартты түрде пептидтер молекуласында 100-ге дейін (молекулалық массасы < 1), ал белоктарда 100-ден жоғары амин қышқылдар қалдықтары кездеседі (молекулалық массасы 1-нан бірнеше миллионға дейін) .
Өз кезегінде пептидтер тобында олигопептидтер (төмен молекулалы пептидтер) және полипептидтер деп бөлу қабылданған. Тізбек құрамына кіретін амин қышқылдар қалдықтарының саны 100-ге жуық немесе одан аздап жоғары болатын макромолекулалар үшін полипептидтер және белок рымдары іс жүзіңде шектелмейді және олар жиі синонимдер болып саналады.
Пептидтер мен белок молекуласын шартты түрде α - амин қышқылдарының поликонденсациясының өнімі ретінде қарастыруға болады. Бұл процесте мокомер буындар арасында пептидті (амидті) байланыс түзіледі.
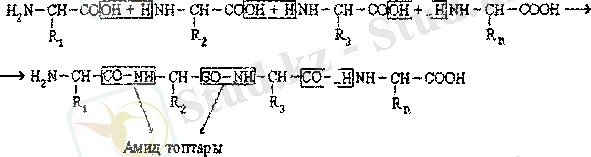
Полиамидті тізбек конструкциясы барлық алуан түрлі пептидтер мен белоктар үшін бірдей болады. Бұл тізбек тармақпен құрылысқа ие және кезектесіп келетін амид (СОМН) және метилен (СН) топтарынан құралған.
Біркелкі құрастырылған полиамидті тізбек болғанда пептидтер мен белоктардың өзіне тән өзгешелігі, екі маңызды сипаттамалармен анықталады, олар - амин қьшқылдық құрам және амин қышқылдық кезектілік.
Пептидтер мен белоктардың амин қышқылдық құрамы оларды кұрайтын α - амин қышқылдарының табиғатын және сандық қатынасын білдіреді. Амин қышқылдық құрамы пептидті және белокты гидролизаттарды анализдеу арқылы (көбінесе хроматографиялық әдістер көмегімен) анықталады. Қазіргі кезде мұндай анализ амин қьшқылдық анализаторлар көмегімен жүзеге асырылады.
Амидті байланыстар қышқылдық ортада, сол сияқты сілтінік ортада гидролизге ұшырайды. Пептидтер мен белоктардың жартылай гадролизі кезінде атағұрлым қысқа тізбектер, ал толық гадролизі кезінде а - ашш қышқылдарының қосласы тузіледі. Сілтілік гадролиз іс жүзінде қолданылмайды, өйткені көптеген: α - амин қышқаадары бұл жағдайларда тұрақсыз болады., Әдетте гадролизді қааіқылдьж, ортада жүргізеді. Кез келген пеішадтер мен белоктар дәнекерленген ампулада (вакуумда немесе азот атмосферасында) -20% хлорлы сутек қьшқылымен бірге 110°С -қа дейін 24 сағат бойы қыздырғанда толық гадролизденеді. Кейбір α - амин қышқылдары қышқыл ортада да өзгеріске ұшырауы мүмкін, мысалы, мұнай жағдайда триптофан толық ыдырайды.
Амин қышқылдық кезектілік, яғни α - амин қышкылдары қалдықтарының кезектесу реті, лептидтер мен белоктардың біріншілік құрылымын құрайды. Біріншілік құрылым тізбектің қандай да бір ұшынан α - амин қышқылдарының кезекпен бөлініп кетуі және оларды идентификациялау арқылы анықталады. α - Амин қышқылдарын тізбектің N - ұшынан бөліп әкетудің химиялық әдістері алдеқайда жақсы ойластырылған.
Динитрофенилдеу әдісі тізбектің N - ұшындағы α - амин қышқылын динитрофенші туындысы түрінде бөліп әкету және идентификациялаудан тарихтағы алғашқыІ әдісі болып табылады, оны Ф. Сенгер (1945ж) ұсынған. Эдман әдісі тізбектің N -ұшындағы α - амин қышқылының фенилизотиоцианатпен сілтілік ортада әрекеттесуіне негізделген. Дансил әдісі дансилхлоридпен өңдеу кезінде N - ұшындағы α - амин қышқылдардың туындыларын алып, оларды 6н. хлорлы сутек қышқылымен (105°С, 12-16 сағ. ) гадролиздеу кезінде кезекпен бөліп әкетуге негізделген.
Эксперименталдық әдістердің жетілдірілуіне қарай және
автоматикалық приборлардың енгізілуіне байланысты біріншілік
құрылымы анықталған пептидтер мен белоктардың саны жылдам
өсуде. Қазіргі уақытқа дейін 1500-ге жуық белоктардың құрамы
ашылып табылған, солардың ішінде маңызды гормондар (адренокортикотропты гормон) және ферменттер (химотрипсиноген, карбоксипептидаза, аспартаттринсаминаза) бар.
Пептидтердің құрылысы мен синтезі. Пептидтер белоктармен салыстырғанда физикалық-химиялық зерттеулер үшін анағүрлым қолайлы объекттер болып саналады. Сондықтан олардың көпшілігі үшін құрылымы анықталған және синтездеу әдістері ойластырылған. Пептидтер барлық ағзалар түрлерінде кездеседі. Белоктарға қарағанда олардың амин қышқылдық құрамы анағұрлым әр текті болады, сонымен қатар жиі Д-қатардың амин қышқылдарын қамтиды. Сондай-ақ, кұрылымына қатысты пептидтер әртүрлі болады: циклді фрагментті, тармақталған тізбекті және т. б. Көптеген антибиотиктер, токсиндер, гормоңдар негізгі табиғаты бар заттарға жатады.
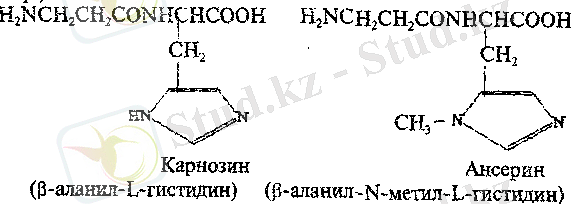 Дипептидтер.
Ең "кішкентай" пептидтердің өкілдеріне жануарлар мен адамның бұлшық еттерінде болатын карнозин және ансерин жатады. Олардың құрамына әдеттегіден өзгеше амин қышқылы - β-аланин кіреді (ол α-аланиннің құрылымдық изомері) .
Дипептидтер.
Ең "кішкентай" пептидтердің өкілдеріне жануарлар мен адамның бұлшық еттерінде болатын карнозин және ансерин жатады. Олардың құрамына әдеттегіден өзгеше амин қышқылы - β-аланин кіреді (ол α-аланиннің құрылымдық изомері) .
Карнозин және ансерин рН-тың физиологиялық мәндерінде имидазол сақинасының (гастидин қалдығы) болуынан (рКа-6) буферлік қызметті орындай алады деп болжанады.
β-Аланин қалдығы пантотен қышқылының құрамына кіреді, ал ол А коферментінің құрылымдық элементі болып саналады. Пантотен қышқылын синтездеу қабілетіне тек қана өсімдіктер мен бактериялар ие.
Трипептидтер. Олардың ең кең тараған өклдерінің біріне глутатион жатады, ол барлық жануарларда, өсімдіктерде және бактерияларда кездеседі.
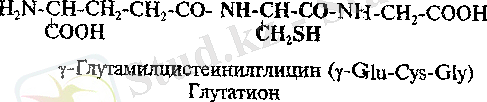
Глутатион бірқатар тотығу-тотықсыздану процестеріне қатысады. Ол белоктар протекторы қызметін атқарады, яғни бос тиол топтары (-SН) бар белоктарды дисульфидті байланыстар (-S-S-) түзу арқылы тотығудан қорғап қалатын заттар болып табылады.
Пептидті антибиотиктер. Кейбір пептидтер антибактериалды әрекет көрсетеді және дәрі-дәрмек заттар ретінде қолданылады. Айталық, грамицидин S (циклді декаделтид) стрептококки пневмококки және басқа микроорганизмдерге антибактериалды әсер көрсетеді, ол Bacillus brevis споралық таяқшасынан бөлінеді. Оны бөліп алған Г. Ф. Граузе және М. Г. Бражникова (1942ж) . Циқлді полипептидтерге антибиотиктер полимиксиңдер жатады.
Грамицидин S құрамына бұрыннан белгілі α - амин қышқылдарымен қатар L-орнитин NН 2 (СН 2 ) 3 СН(NН 2 ) СООН кіреді. Ол адам ағзасында мочевинаның метаболиттік циклында арганиннен түзіледі, бірақ адам ағзасының белоктары құрамында кездеспейді.
Грамицидин ионоформ бола алады, яғни ол мембраналар арқылы иондарды тасымалдайды. Мысалы оның көмегімен мембраналар арқылы К + иондары, сол сияқты Nа + және басқа бір валенті катиондар тасымалданады.
Ионоформ қызметін басқа да циклді пептид-валиномицик атқара алады, ол калций иоңдарын өзінше байланыстыруға және тасымалдауға қабілетті. Валиномициннің циклді молекуласы үш бірдей фрагменттерден кұралған, оның әрбірінің құрамына кезекпен D-валиннің, L-cүт қышқылының, L -валиннің және D-гидроксиизовачериак қышқылының қалдықтары кіреді. Ватаномицин Nа+ иондарымен іс жүзінде әрекеттеспейді.
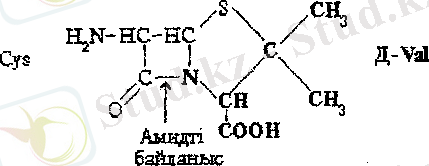
Зең саңырауқұлақтары Penicillium бөліп шығаратын пеницилдинді антибиотиктердің құрылымдық негізі 6-аминопенициллан қышқылы болып табылады. Оны D- валин және цистеин қалдықтарынан құралған дипептид ретінде қарастыруға болады,
Пептидті гормондар. Гормоналды әсер көрсететін, яғни ағзадан химиялық реакцияларды реттейтін пептидтер тобы аса маңызды болып саналады. Олардың көбісі таянақты зерттелген, кейбіреулері жақында ғана ашылған.
Окситоцин және вазопрессин гормондары гапофиздің артқы бөлігінен бөлінеді. Бұл екі гормондар құрамында 9 амин қышқылдарының қалдықтары бар, сондықтан олар нонапептидтерге жатады. Окситоцин және вазопрессиннің біріншілік структурасы ұқсас болады және ол тек қана екі α-амин қышқылдар калдықтарымен бір-бірінен өзгешеленеді: окситоциндегі изолейцин (3) және лейцин (8) орныңда вазопрессинде фенилаланин (3) және аргинин (8) қалдықтары болады. Екі пептидте бір дисульфид байланысы бар, және С-ұшында бос СООН - тобының орнында амид тобы - СОNН 2 орналасқан.
Амин қышқылдық кезектіліктегі аздаған айырмашылықтар әрбір бұл гормоңдардың өзіндік биологиялық әрекет көрсетуі үшін жеткілікті болады. Окситоцин тек қана әйел жынысты түрлерде кездеседі.
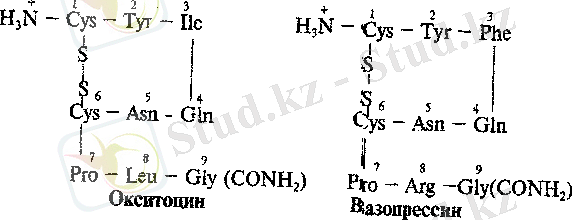
Ол тегіс бетті бұлшық ет жиырылуын тудырады және ветеринарияда, гинекология мен акушерлікте қолданылады. Вазопрессин әйел және еркек ағзаларында болады (ангадиуреттік гормон) . Соңғы уақытта вазопрессин есте сақтаудың күшті стимуляторлары катарына кіретіндігі анықталған.
Инсулин - көмірсулар, майлар мен белоктар метаболизмін бақылауға жауапты гормон, ол асқазан асты безінен бөлінеді. Ағзада инсулиннің жетіспеушілігінен көмірсулар алмасуы едәуір бұзылады (қант диабеті) . Инсулиннің молекулалық массасы 5727, молекулалық формуласы С 259 Н 377 N 65 О 75 S 6 . Инсулин бір-бірімен дисульфидті көпіршелермен байланысқан екі пептидті тізбектен тұрады. Бір тізбегіңде 21, ал екіншісінде 30 амин қышқыл қалдыктары орналасқан. Сонымен бірге, бірінші тізбекте Суs6 және Суз-11 арасында дисульфидті байланыс бар, ол ілмек түзілуіне әкеледі. Инсулиндердің түрлі ерекшелігі бірінші тізбектік 8-10 бөлігіндегі өзгерістерге байланысты болады. Мысалы, адам инсулинінде бұл бөлікте Тhr-Ser-Ilе тізбегі, өгіздікінде Аlа-Sеr-Vаl қойдікінде Аlа-Sеr-Vаl, жылқыныкіңде Тhr-Ser-Ilе тізбегі орналасқан.
Пептиді токсиндер. Көптеген уытты заттарға пептидті -белокты табиғат тән, мысалы улы саңырауқұлақтардың, аралардың. жыландардың, сары шаяндардың токсиндері.
Пептид апамин аралар уының компоненті болып табылады және ол орталық жүйке жүйесіне күшті әсер етеді. Апаминде 18 амин қышқылдар калдықтары бар, ол төмен молекулалы нейротоксиндердің біріне жатады. Ең кіші молекулалық массаға теңіз моллюскасынан бөлінетін нейротоксиндер - конотоксиндер ие. Олар 13-15 амин қышқылдар калдықтарынан тұрады. Конотоксиндердің уыттылығы өте жоғары болады.
Токсиндердің құрылысы мен физиологиялық әрекетін зерттеу оларды залалсыздандыру жолдарын іздеу тынысынан ғана емес, сонымен бірге оларға ұқсас дәрі-дәрмек заттарды молельдеу мақсатында кұрылыс принциптерін анықтау үшін де қызықты болып саналады.
Нейропептидтер. Оларға бас миыңдағы пептидтер жатады (олардың 150-ден астамы белгілі) . Нейропептидтердің энкефалиндер деп аталатын алғашқы екі өкілі 1975 жылы жануарлар миынан бөлініп алынды. Бұл екеуі де пентапептидтерге жатады, бір-бірінен тек қана С-ұшындағы α-амин қышқылымен өзгешеленеді.
Туr-Glу-Glу-Рhе-Меt Меt- энкефалин
Туr-GІу-GІу-Рhе-Lеu Lеu- энкефалин
Бұл пептидтер ауыруды сездірмейтін әсер береді және дәрі-дәрмек заттар ретінде қолданылады.
Белоктар
"Белоктар" деген атауға "протеиндер" деген термин сәйкес келеді, ол грек тілінде proteios- бастауыш (алғашқы) деген сөзден шыққан, өйткені бұл заттар тірі материяның барлық формаларында кездеседі. Белоктардың табиғаттағы атқаратын қызметі алуан түрлі. Олардың ішінде ферментер, гормондар, қирылымдық белоктар (кератин, фиброин, коллаген), тасымалдаушы белоктар (гемоглобин, миоглобин), қозғалыс белоктары (актин, миозин), қорғаныс белоктары (иммуноглобулиндер), қор белоктары (казеин, жұмыртқа альбумині), токсиндер (жылан уы, дифтерия токсині) бар.
Белок химиясы - биологияның, медицинаның, химия мен физиканың идеяларын және әдістерін өзіне жинақтаған ерекше сала болып табылады. Қазіргі кезде белоктардың құылымы мен атқаратын қызметтерінің катынасы мәселесін және ағзаның тіршілік етуінің маңызды процестерінде олардың қатысуының механизмін зерттеуде, көптеген аурулардың патогенезінің молекулалық негізін түсінуге үлкен жетістіктерге қол жетті. Қазіргі заманның өзегі мәселелерінің біріне белоктың химиялық синтезі жатады. Синтездік жолмен табиет пептидтер мен белоктардың аналоттарын алу, мына мәселелерді шешуге жағдай жасайды: бұл қосылыстардың жасаудағы әрекетінің механизмін анықтау, олардың активтілігі мен кеңістіктегі құрылысы арасындағы өзара байланысты анықтау, жаңа дәрі-дәрмек заттарды жасау, сонымен қатар ағзада жүретін процестерді молельдеуге мүмкіндік алу.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz