Полимер ерітінділерінің термодинамикасы: еру механизмдері, Флори-Хаггинс теориясы, еріткіштің сапасы және фазалық тепе-теңдік


12. 3. ЕРУ ТЕРМОДИНАМИКАСЫ
Сонымен, еру дегеніміз - термодинамикалық тұрақты гомогенді жүйе түзетін өздігінен жүретін процесс. Полимер өздігінен ерігенде мынандай процестер жүреді:еріткіш молекуласы полимерлер қанқасына диффузияланады, еріткіш молекулалары макромолекуланың активті орталықтарында сольваттанады, сольваттану нәтижесінде молекуладан ірі құрылым ыдырайды және молекулааралық әрекеттестік әлсірейді, шекті сольваттанған макромолекулалар ісінген полимер бетінен бөлінеді, сольваттанған макромолекула полимерден ерітіндіге диффузияланады. Ерудің міндетті шарты -
Компоненттер араласқанда еркін энергияның азаюы. Полимердің ерекшелігі - мұнда энтропияның ролі жоғары болады, өйткені полимер ерітіндіні сіңіргенде макромолекула конформациясының өзгеру ықтималдығы артады. Энтропияның өзгеруі Флори-Хаггинс теңдеуімен анықталады:
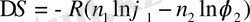
мұндағы R - универсал, газ тұрақтысы, n
 және n
және n
 компоненттердің моль саны,
компоненттердің моль саны,
 және
және
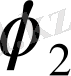 - олардың көлемдік үлесі.
- олардың көлемдік үлесі.
Полимер ерітіндісі термодинамикалық тұрақты және қайтымды жүйе болғандықтан, полимер ерігенде еркін энергия төмендейді.
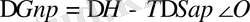
Бұл өрнек бірнеше жағдайларда орындалады:
1.
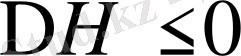 және
және
 еру экзотермиялық, энтропияның өсуі арқылы жүреді, мұнда әр текті молекулалардың арасындағы әрекеттестік энергиясының мәні, бір текті молекулалардікіне қарағанда көп.
еру экзотермиялық, энтропияның өсуі арқылы жүреді, мұнда әр текті молекулалардың арасындағы әрекеттестік энергиясының мәні, бір текті молекулалардікіне қарағанда көп.
2.
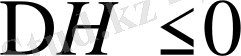 және
және
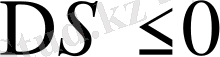 , егер
, егер


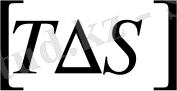 шарты орындалса: еру экзотермиялық, ал энтропия кемиді, яғни полимер мен еріткіш молекулалары арасындағы энергетикалық әрекеттестік өте мықты, энтропияның төмендеуі полимер буындары мен еріткіш молекулалары арасында ассоциаттардың түзілуіне байланысты. Мұндай жағдай полюсті полимерлер полюсті еріткіштерде ерігенде байқалады.
шарты орындалса: еру экзотермиялық, ал энтропия кемиді, яғни полимер мен еріткіш молекулалары арасындағы энергетикалық әрекеттестік өте мықты, энтропияның төмендеуі полимер буындары мен еріткіш молекулалары арасында ассоциаттардың түзілуіне байланысты. Мұндай жағдай полюсті полимерлер полюсті еріткіштерде ерігенде байқалады.
3.
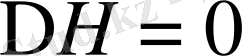 және
және
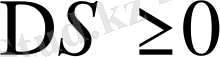 егер,
егер,


 шарты орындалса: еру эндотермиялық, энтропияның өсуі арқылы жүреді. Мұндай жағдай полюсті еріткіштерді қолданғанда байқалады.
шарты орындалса: еру эндотермиялық, энтропияның өсуі арқылы жүреді. Мұндай жағдай полюсті еріткіштерді қолданғанда байқалады.
4.
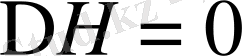 және
және
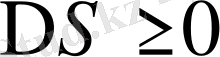 еру атермиялық, энтропияның өсуі арқылы жүреді.
еру атермиялық, энтропияның өсуі арқылы жүреді.
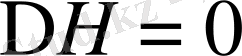 болу себебі, әрекеттестік энергиясы және макромолекуланың текшелену тығыздығы полимер ерігенде өзгеріске ұшырамайды. Полимер мен еріткіш жанасқан кездегі араласу жылуы мен когезия энергиясының арасындағы байланыс мына теңдеумен анықталады.
болу себебі, әрекеттестік энергиясы және макромолекуланың текшелену тығыздығы полимер ерігенде өзгеріске ұшырамайды. Полимер мен еріткіш жанасқан кездегі араласу жылуы мен когезия энергиясының арасындағы байланыс мына теңдеумен анықталады.
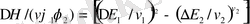
мұндағы
 толық араласу жылуы : v - жүйенің жалпы көлемі,
толық араласу жылуы : v - жүйенің жалпы көлемі,
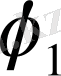 және
және
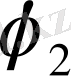 - компоненттердің көлемдік үлесі,
- компоненттердің көлемдік үлесі,
 және
және
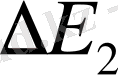 когезия энергиясының араласу кезіндегі өзгеруі, v
когезия энергиясының араласу кезіндегі өзгеруі, v
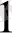 ; және v
; және v
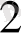 компоненттердің көлемі.
компоненттердің көлемі.
 қатынасын когезия энергиясының тығыздығы дейді.
қатынасын когезия энергиясының тығыздығы дейді.
Ал
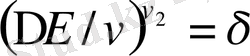 ерігіштік параметрі деп атайды. Сонда
ерігіштік параметрі деп атайды. Сонда
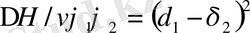
яғни, ерігіштік параметрлері айырымының квадраты араласу жылуының мәнін береді. Демек, араласу үшін ерігіштік параметрлерінің айырымы
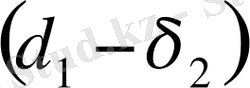 және араласу жылуының мәні минималь болуы керек. Егер
және араласу жылуының мәні минималь болуы керек. Егер
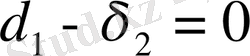 яғни
яғни
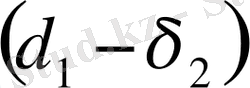 болса, онда
болса, онда
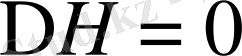 , мұнда араласу процесі тек энтропиялық фактормен анықталады. Егер
, мұнда араласу процесі тек энтропиялық фактормен анықталады. Егер
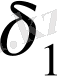 және
және
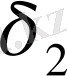 мәндері бір-бірінен өте алшық жатса, еру процесі жүрмейді.
мәндері бір-бірінен өте алшық жатса, еру процесі жүрмейді.
12. 4. ПОЛИМЕР МЕН ЕРІТКІШТІҢ ТЕРМОДИНАМИКАЛЫҚ ЫНТЫҚТЫҒЫ. ЕРІТІНДІЛЕРДІҢ ТЕРМОДИНАМИКАЛЫҚ САПАСЫ.
Полимерлердің еріткіштерде ісінуі мен еруі функционал топтар мен атомдардың әрекеттесуіне байланысты, осының нәтижесінде донорлы - акцепторлы және басқа байланыстар түзіліп, макромолекула мен еріткіш молекулалары арасында тұрақты комплекс пайда болады. . Мысалы, ароматикалық полимерлер бензол сақинасындағы
 - электрондарының қозғалтқыштығының салдарынан ароматикалық немесе хлорлы бар еріткіштермен
- электрондарының қозғалтқыштығының салдарынан ароматикалық немесе хлорлы бар еріткіштермен
 - комплекстер түзеді. Еру (ісіну) процесі компоненттер бір-бірімен араласқанда ғана жүреді, яғни олардың арасында термодинамикалық ынтықтықтың болуына байланысты. Еріткіштердің полимерлерге деген термодинамикалық ынтықтық дәрежесіне қарай олар полимерлермен термодинамикалық сыйысатындар және сыйыспайтындар болып бөлінеді. Компоненттердің бір-бірімен әрекеттесуінің термодинамикалық ынтықтығын, олардың химиялық потенциялдарының
- комплекстер түзеді. Еру (ісіну) процесі компоненттер бір-бірімен араласқанда ғана жүреді, яғни олардың арасында термодинамикалық ынтықтықтың болуына байланысты. Еріткіштердің полимерлерге деген термодинамикалық ынтықтық дәрежесіне қарай олар полимерлермен термодинамикалық сыйысатындар және сыйыспайтындар болып бөлінеді. Компоненттердің бір-бірімен әрекеттесуінің термодинамикалық ынтықтығын, олардың химиялық потенциялдарының
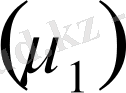 азаюынан анықтауға болады. Химиялық потенциал мыныған тең:
азаюынан анықтауға болады. Химиялық потенциал мыныған тең:
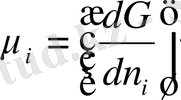 P, T, n
i
P, T, n
i
яғни, химиялық потенциал қысым мен температура және басқа компоненттердің моль саны n i тұрақты болған жағдайда концентрациясы берілген ертіндіге i-компонентінің аз мөлшерін қосқан кезде пайда болатын еркін энергияның өсімшесіне тең.
Химиялық потенциял осы компоненттердің парциялдық мольдік еркін энергиясын G
i
сипаттайды. Таза зат үшін
 . Компоненттің ертіндідегі химиялық потенциялы
. Компоненттің ертіндідегі химиялық потенциялы
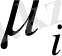 оның ерігенге дейінгі химиялық потенциалынан
оның ерігенге дейінгі химиялық потенциалынан
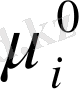 аз болуы керек, демек, осы мәндердің айырымы теріс сан болады
аз болуы керек, демек, осы мәндердің айырымы теріс сан болады
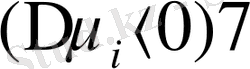 .
.
Компоненттердің арасында ынтықтық болса ғана прогресс араласу бағытына қарай жүреді. Сондықтан ынтықтық пен бағыттыалудың таңбалары бірдей
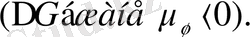 Осы мәндердің абсолбт шамалары неғұрлым көп болса, соғұрлым компоненттердің арасындағы ынтықтық көп болады, яғни олардың әрекеттесу процесі толвқтау жүреді.
Осы мәндердің абсолбт шамалары неғұрлым көп болса, соғұрлым компоненттердің арасындағы ынтықтық көп болады, яғни олардың әрекеттесу процесі толвқтау жүреді.
Термодинамикалық ынтықтықтың шамасына қарай еріткіштерді нашар және жақсы деп бөледі, яғни еріткіштің термодинамикалық сапасын бағалайды. Термодинамикалық тұрғыдан жақсы еріткіштер деп полимерлермен әсерлескенде
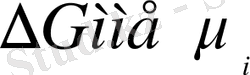 абсолют мәндері жоғары болатын еріткіштерді атайды. Полимерлердің әрекеттескен кезде еркін энергия мен химиялық потенциал өзгерісі аз болатын еріткіштер нашар еріткіштерге жатады.
абсолют мәндері жоғары болатын еріткіштерді атайды. Полимерлердің әрекеттескен кезде еркін энергия мен химиялық потенциал өзгерісі аз болатын еріткіштер нашар еріткіштерге жатады.
Сонымен, еріткіштің термодинамикалық ынтықтығын не термодинамикалық сапасын
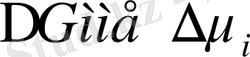 шамалары арқылы бағалауға болады. Бұл шамаларды экперимент жүзінде ертіндінің үстіндегі еріткіштің бу қысымын, немесе ісіну қысымын және де екіші варильды коэффициенті А
2
анықтау арқылы табуға болады.
шамалары арқылы бағалауға болады. Бұл шамаларды экперимент жүзінде ертіндінің үстіндегі еріткіштің бу қысымын, немесе ісіну қысымын және де екіші варильды коэффициенті А
2
анықтау арқылы табуға болады.
Плимер ертіндісінің үстіндегі бу қысымының өзгеруі арқылы анықтау.
Тепе теңдік күйдегі кез-келген ертіндінің үстіндегі компаненттердің парциалдық бу қысымы р
i
таза копаненттердің үстіндегі қаныққан бу қысымынан
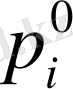 кем.
кем.
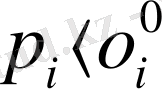
Ертіндінің салыстырмалы бу қысымы мен химиялық потенциалдың арасындағы қатынас былай өрнектеледі:
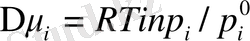
Ал
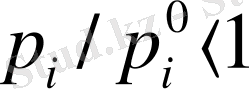
 болғандықтан
болғандықтан
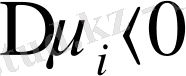 Equation. 3 болады да, еру процесі өздігінен жүреді.
Equation. 3 болады да, еру процесі өздігінен жүреді.
Идеал ертіділнр үшін әрбір компонентеің химиялық потенциялы ертіндідегі сол компоненттің молбдік үлесімен Х i ғана сипатталады:
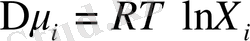
Демек,
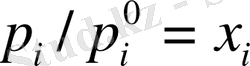
Сонда ертіндідегі компоненттің салыстырмалы бу қысымы сол компоненттің мольдің үлесіне тең. Бұл қатынас Рауль заңы деп аталады. Рауль заңына бағынатын идеал ертінділер әдетте химиялық құрылысы мен мөлшері бірдей мольнкулалар арасында түзіледі. Бұл кезде біртекті және әртекті мольекулалардың әрекеттестік энергиясы мен олардың энтальпия және көлем өзгерісі байқалмайды, яғни идеал ертінділердің қасиеттері компоненттердің қасиеттеріне аддитивті өзгереді. Идеал ертінділердің араласу энтропиясы әрдайым оң және тең болады:
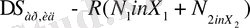 (12. 1. )
(12. 1. )
Мұндағы X
1
, X
2
-компоненттердің мольдік үлесі. N
1
, N
2
-компонеттер мольекуласының саны. R- Больцман тұрақтысы. Реал ертіндінің парциалдық бу қысымы да таза компонеттердің бу қысымынан нем болады, бірақ компоненттердің парциалды бу қысымы Рауль заңы бойынша шығатын шамадан кем, не артық болуы мүмкін. Егер реал ертіндінің үстіндегі компоненттердің парциалдық бу қысымы идеал ертіндінің үстіндегі парциалдық бу қысымынан артық болса
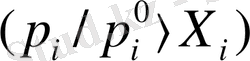 оны оң ауытқу дейді, ал керісінше болса
оны оң ауытқу дейді, ал керісінше болса
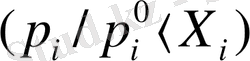 теріс ауытқу дейді. Теріс ауытқу берілген компоненттің бу қысымының төмендігінен, яғни ертінді компоненттерінің әрекеттестігі жақсы екендігін көрсетеді.
теріс ауытқу дейді. Теріс ауытқу берілген компоненттің бу қысымының төмендігінен, яғни ертінді компоненттерінің әрекеттестігі жақсы екендігін көрсетеді.
Рауль заңынан оң ауытқу компоненттерінің арасындағы әрекеттестік нашар ертінділерге тән, бұл кезде әртекті мольекумалардың тартылыс күші азайып, әрқайсысы булануға бейім келеді де, парциалдық бу қысымы артады. Полимер ертінділері де идеал ертінділерінің талаптарына сай келмейді. Полимер мен еріткіштің химиялық құрамы ұқсас болса
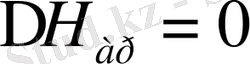 болуы мүмкін. Бірақ полимер макромольекуласы мен еріткіш мольекуласының көлемдері ешқандай салыстыруға келмейді.
болуы мүмкін. Бірақ полимер макромольекуласы мен еріткіш мольекуласының көлемдері ешқандай салыстыруға келмейді.
Флори мен Хаггинс модель ретінде алынған иілгіш тізбекті макромольекулалардың төмен мольекулалық еріткіштегі атермиялық ертіндісінің энтропия өзгерісі мынандай теңдеуге бағынатыны дәлелденген:
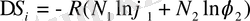 (12. 2. )
(12. 2. )
Мұндағы
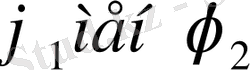 еріткіш пен полимердің көлемдік үлестері. Сонымен, нақты есептеулерде мольекулалардың көлем болмайды. Демек, полимер ертінділерінде әрдайым идеал ертінділерден ауытқу болатынын алдынала күтуге болады. Полимер буланбайды, сондықтан полимер ертіндісінің бу қысымының төмендеуін қарастырғанда ертіндінің үстінднгі еріткіштің бу қысымы соғұрлым аз болады да, таза еріткіштің үстіндегі бу қысымынан айырмашылығы соғұрлым елеулі болады.
еріткіш пен полимердің көлемдік үлестері. Сонымен, нақты есептеулерде мольекулалардың көлем болмайды. Демек, полимер ертінділерінде әрдайым идеал ертінділерден ауытқу болатынын алдынала күтуге болады. Полимер буланбайды, сондықтан полимер ертіндісінің бу қысымының төмендеуін қарастырғанда ертіндінің үстінднгі еріткіштің бу қысымы соғұрлым аз болады да, таза еріткіштің үстіндегі бу қысымынан айырмашылығы соғұрлым елеулі болады.
Полимер ертіндісі идеал ертіндіден теріс ауытқу берсе, онда полимер макромольекулалары мен еріткіш мольекулаларының арасындағы термодинамикалық ынтықтық күшті, яғни еріткіш термодинамикалық жақсы деп есептеледі. Ннеғұрлым термодинамикалық ынтықтық күшті болса, соғұрлым ертіндідегі концентрациядағы p
i
мәні аз болады да,
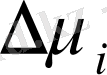 абсолют мәні өсіп, ертіндінің термодинамикалық сапасы артады. Иілгіш сүзбекті полимер ерігенде әдетте теріс ауытқу береді. Термодинамикалық нашар еріткіштер полимер макромолекулаларымен онша әрекеттеспейі, ол полимер ерітіндісінен таза компонентке қарағанда тезірек буланып, ерітіндінің үстіндегі бу қысымын арттырады да, оң ауытқу береді.
абсолют мәні өсіп, ертіндінің термодинамикалық сапасы артады. Иілгіш сүзбекті полимер ерігенде әдетте теріс ауытқу береді. Термодинамикалық нашар еріткіштер полимер макромолекулаларымен онша әрекеттеспейі, ол полимер ерітіндісінен таза компонентке қарағанда тезірек буланып, ерітіндінің үстіндегі бу қысымын арттырады да, оң ауытқу береді.
Осмос қысымы бойынша анықтау. Вант-Гофф заңы бойынша ерітінділердің осмос қысымы p коецентрацияға (с) тура пропорционал:
O = cRT.
Тұрақты температурада, ерітіндінің парциялдық мольдік көлемі тұрақты болса (V
 ), еріткіштің химиялық потенциялының сырттқы қысымға байланысты өзгерісі былай өрнектеледі:
), еріткіштің химиялық потенциялының сырттқы қысымға байланысты өзгерісі былай өрнектеледі:
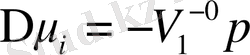
Не
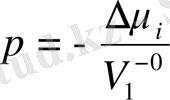 (12. 3)
(12. 3)
12, 6-сурет, 12, 7 -сурет.
Іс жүзінде ерітінділер қысым түсіргенде сығылады. Еріткіштің порциал көлемінің қысымға тәуелділігін ескеріп, (12. 3) теңдеуге кейбір өзгерістер енгізу арқылы осмос қысымы p мен
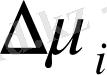 арасындығы байланысты былай келтіруге болады:
арасындығы байланысты былай келтіруге болады:
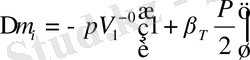 (12. 4. ) .
(12. 4. ) .
Мұндағы
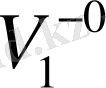 - еріткіштің парциалдық мольдік көлемі,
- еріткіштің парциалдық мольдік көлемі,
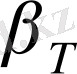 еріткіштің ерітіндідегі изотермиялық сығылғыштық қасиеті.
еріткіштің ерітіндідегі изотермиялық сығылғыштық қасиеті.
Демек, осмос қысымы дегеніміз еріткіштің көлем бірлігіне келтін, компоненттер арасындағы термодинамикалық ынтықтық . Осмос қысымы неғұрлым көп болса,
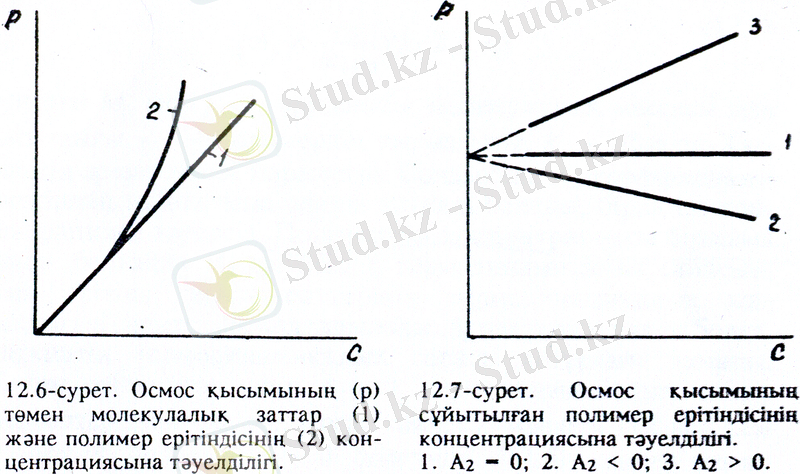
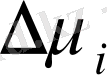 абсолют мәні де соғұрлым көп болады, яғни еріткіштің полимерге деген термодинамикалық ынтықтығы да артааады. Кез -келген төмен молекулалық қосылыс және өте сұйытылған жоғары молекулалық қосылыстардың осмос қысымы Вант-Гофф заңымен сипатталады. Бірақ тәжірибе жүзінде көпшілік полимер ерітінділерінің осмос қысымы Вант-Гофф заңдылығынан алынатын осмос қысымынан біршама жоғары екені дәлелденген. Айтылғандарды график түрінде көрнекті келтіруге болады. (12. 6-сурет) .
абсолют мәні де соғұрлым көп болады, яғни еріткіштің полимерге деген термодинамикалық ынтықтығы да артааады. Кез -келген төмен молекулалық қосылыс және өте сұйытылған жоғары молекулалық қосылыстардың осмос қысымы Вант-Гофф заңымен сипатталады. Бірақ тәжірибе жүзінде көпшілік полимер ерітінділерінің осмос қысымы Вант-Гофф заңдылығынан алынатын осмос қысымынан біршама жоғары екені дәлелденген. Айтылғандарды график түрінде көрнекті келтіруге болады. (12. 6-сурет) .
Төмен молекулалық қосылыстардың осмос қысымы концентрацияға тура пропорционал артса, жоғары молекулалық қосылыстардың осмос қысымының өсімі концентрациядан кем. Демек, полимер ерітінділеріне Вант-Гофф заңы жарамайды. Аталған өзгешелік макромолекулалардың тізбекті құрылысының салдарынан туады. Ұзын да иілгіш макромолекулалардың кинетиклық элементі тұтас макромолекула емес, оның фрагменттері-сегментті. Сондықтан макромолекула ерітіндіде бірнеше қысқа молекулалардың қасиетін көрсетеді. Макромолекула неғұрлым иілгіш болса ерітіндінің осмос қысымы соғұрлым жоғары болады да, Вант-Гофф заңы бойынша алынатын осмос қысымынан көбірек ауытқиды. Флори-Хаггинс теориясы бойынша, осмос қысымының полимердің концентрациясына тәуелділігі Вант-Гофф теңдеуімен емес, Вандер-Вальстің концентрациясы бойынша дәрежелі жіктелу теңдеуімен сипатталады
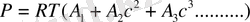
немесе
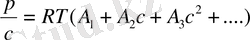 (12. 5) .
(12. 5) .
мұндағы с - ерітіндідегі полимердің концентрациясы, г/мл: А 1 А 2 және А 3 - осмос қысымының бірінші, екінші және үшінші виральді коэффиценттерді.
Бірінші вириальді коэффицент полимердің молекулалық массасына тікелей байланысты шама А 1 /М, А 2 коэффиценті макромолекуланың құрылысы мен молекулалық массасына, еріткіштің сапасына, температураға және т. б. байланысты болып келеді де, негізінен поимер ерітіндісінің идеал ерітіндіден қаншалықты ауытқитынын көрсетеді. Сұйытылған ерітінділер үшін үшінші және одан кейінгі вириальді коэффиценттерінің шамасы елеусіз, оларды ескермеуге болады. Сонда (12. 5) вириальді теңдеу қолдануға ынғайлы қарапайым түзу сызықтық теңдеуге айналады:
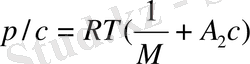 (12. 6. )
(12. 6. )
- теңдеу бойынша вириальді коэффиценттерді графиктік жолмен оңай табуға болады. Ол үшін әртүрлі концентрацияда полимер ерітіндісінің осмос қысымын табады да, p/c = f (c) координатасында график тұрғызып алынған түзуді ордината осьімен қиылысқанша экстрополяциялайды түзу абсцисса осінің арасындағы бұрыштың тангенсі А2береді, tg a.
Флори-Хаггинс теориясы бойынша А
2
- нің мәніне полимер мен еріткіштің к кіреді:
А
2
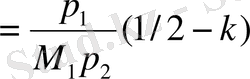 (12. 7)
(12. 7)
мұндағы М
1
мен р
1
- еріткіштің молекулалық массасы мен тығыздығы . р
2
- полимердің тығыздығы, к - Флори - Хаггинстің әрекеттестік параметрі. Сондықтан А
2
коэффициенті еріткіштің табиғатына елеулі тәуелді болады, бірақ ол концентрацияға тәуелсіз. Полимердің концентрациясы біршама төмен болғанда А
2
еріткіштің термодинамикалық сапасын, яғни ерітінді компоненттерінің термодинамикалық ынтықтығын сипаттауға қолданылады . А
2
неғұрлым үлкен болса, еріткіштің термодинмикалық сапасы соғұрлым жоғары. Жақсы еріткіштер үшін
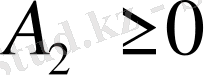 , термодинамикалық нашар еріткіштер үшін
, термодинамикалық нашар еріткіштер үшін
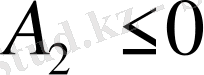 . Соған сәйкес к мәндері ½ ден кем не артық болады. A
2
= 0 болғанда (12. 5) теңдеу идеал ерітінділерге арналған Вант- Гофф теңдеуіне айналады. Флори - Хаггинс параметрі бұл кезде к
. Соған сәйкес к мәндері ½ ден кем не артық болады. A
2
= 0 болғанда (12. 5) теңдеу идеал ерітінділерге арналған Вант- Гофф теңдеуіне айналады. Флори - Хаггинс параметрі бұл кезде к
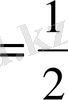 болады.
болады.
Сонымен:
А 2 = 0 k = ½ идеал ерітінді
А
2
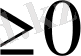
 k =1/
2
жақсы ерітінді
k =1/
2
жақсы ерітінді
А
2
 k = ½ нашар ерітінді
k = ½ нашар ерітінді
к - параметрі Гиббстің әрекеттестік энергиясын сипаттайды, демек ол еріткіштің жылулық эффектісін де, бағдарлау эффектісін де ескереді. Сондықтан к- энтальпиялық (к
1
) және энтропиялық
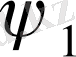 факторлардан тұратын екі қосынды арқылы беріледі:
факторлардан тұратын екі қосынды арқылы беріледі:
½ - к =
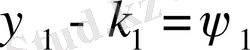 (1 - Ө / Т) (12. 8)
(1 - Ө / Т) (12. 8)
мұндағы ө =
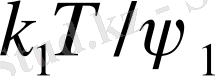 өлшемі температура өлшемімен берілетін ө (тэта) - температура деп аталынатын параметр.
өлшемі температура өлшемімен берілетін ө (тэта) - температура деп аталынатын параметр.
- теңдеуімен (12. 7) қойып, А2мен температураның арасындағы байланысты алуға болады:
А 2
(1 - Ө - Т) (12. 9)
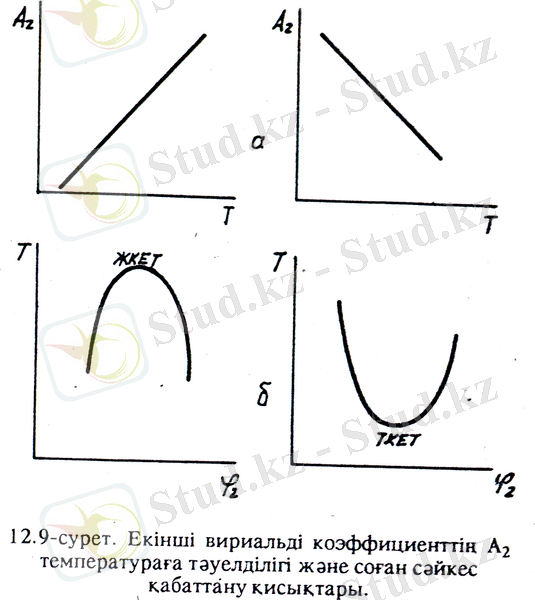
Т = Ө болғанда А 2 = 0 айналады, яғни ерітінді идеал ерітінді сияқты болады. Ө температураны A 2 = f (t) тәуелділігін А 2 = 0 экстрополяциялау арқылы табады. А 2 = 0 болған жағдайды ө - жағдай дейді, ал осы жағдай туатын ерітіндіні ө ерітінді дейді. Сонымен полимер ерітіндісі ө - жағдайда, яғни ө - температура мен ө - еріткіште формальді түрде идеал ерітінділердің заңына бағынады. Бірақ әрбір жүйе үшін бұл жағдай тек белгілі бір температурада ғана сақталады.
Сондықтан мұндай ерітінділерді псевдоидеал ерітінділер деген жөн.
Флори - Хаггинс анықтамасы бойынша Ө - температурада
Демек,
Т
ө
=
Ө - температурада Р = Crt, яғни ө - жағдайдағы ерітінділерге осмос қысымының теңдеуін қолдануға болады.
Полимер ерітіндісінің тұтқырлығы арқылы анықтау.
Полимер ерітіндісінің тұтқырлығы макромолекуланың ерітіндідегі мөлшеріне, еріткіштің табиғаты мен температураға байланысты. Жақсы еріткіште макромолекулалық шумақ ісініп, тұтқырлық артады. Сондықтан полимердің тұтқырлығын әр түрлі еріткіштерде өлшеу арқылы еріткіштің сапасын анықтауға болады. Тәжірибе жүзінде әр түрлі еріткіштерде өлшенген иілгіш тізбекті полимерлер үшін
 мәні мен екінші вириальді коэффиценттің арасында белгілі бір тәуелділік ьар екені көрсетілген. А
2
мәні артқан сайын
мәні мен екінші вириальді коэффиценттің арасында белгілі бір тәуелділік ьар екені көрсетілген. А
2
мәні артқан сайын
 - да өседі. Сонда
- да өседі. Сонда
 өсуіне қарай сол полимерге алынған еріткіштің сапасы да артады деуге болады. Кригбаумның жартылай эмпирикалық теңдеуі бойынша бұл байланыс былай өһрнектеледі:
өсуіне қарай сол полимерге алынған еріткіштің сапасы да артады деуге болады. Кригбаумның жартылай эмпирикалық теңдеуі бойынша бұл байланыс былай өһрнектеледі:
 (12. 10)
(12. 10)
Мұндағы
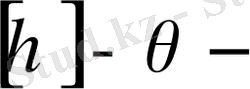 еріткіште өлшенген сипаттамалық тұтқырлық. .
еріткіште өлшенген сипаттамалық тұтқырлық. .
Иілгіш тізбекті полимерлер үшін Стокмайер - Фиксман теңдеі де жақсы нәтижелер береді.
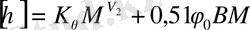 (12. 11)
(12. 11)
Мұндағы к ө ө - еріткіште аныталатын тұрақты, М - полимердің молекулалық массасы.
Ф 0 - универсал вискозиметриялық тұрақты, В - әрекеттестік параметрімен байланысты шама. Ол мына теңдікпен анықталады:
- В =V 2 мен (1 - 2к 1 ) /V 1 N A (12. 13)
(12. 11) теңдеуі
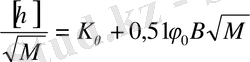 түріне келтіріп,
түріне келтіріп,
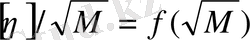 тәуелділігінің графигінен алынған түзудің ордината осін кесетін кесіндіден
тәуелділігінің графигінен алынған түзудің ордината осін кесетін кесіндіден
 , ал түсу бұрышынан В, ал одан К табуға болады.
, ал түсу бұрышынан В, ал одан К табуға болады.
Полимер ерітіндісінің келтірілген тұтқырлығының оның концентрациясына байланысты өзгеруі де еріткіштің сапасын бағалауға мүмкіндік береді. Бұл байланыс Хаггинс теңдеуімен өрнектеледі:
 мен
/ С =
мен
/ С =
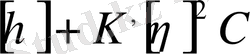 (12. 14)
(12. 14)
мұндағы К - Хаггинстің вискозиметриялық константасы деп аталатын полимердің еріткішпен әсерлесуін сипаттайтын, осы жүйе үшін тұрақты шама. Сыртқы түрі жағынан (12. 14) теңдеу келтірілген осмос қысымының концентрациялық тәуелділігінің теңдеуіне (12. 6) ұқсас.
Жалпы түрде 12. 14 және 12. 6 теңдеулерін былай келтіруге болады:
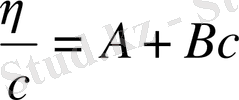
(12. 15)
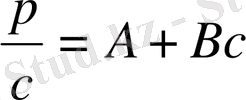
Екеуінде де теңдеудің оң жағындағы бірінші мүше молекулалық массаға тікелей байланысты тұрақты шама, ал екінші мүше концентрациядан және макромолекула мен еріткіштің арасындағы байланысты, яғни еріткіштің сапасын сипаттайтын шамадан тұрады.
Хаггинс константасын (
 мен
/ с) = f (c) тәуелділігінің графигінен табады. Түзудің ордината өсінен
мен
/ с) = f (c) тәуелділігінің графигінен табады. Түзудің ордината өсінен
 шамасы анықталады, ал түсу бұрышының тангенсінен К табылады (tg a = K
шамасы анықталады, ал түсу бұрышының тангенсінен К табылады (tg a = K
 К мәні соғұрлым жоғары. Жақсы еріткіштер үшін К = 0, 2 - 0, 3 Ө - еріткіште К = 0, 5 дейін артады. К еріткіштің сапасына тәуелді болғанымен полимердің молекулалық массасына байланысты емес.
К мәні соғұрлым жоғары. Жақсы еріткіштер үшін К = 0, 2 - 0, 3 Ө - еріткіште К = 0, 5 дейін артады. К еріткіштің сапасына тәуелді болғанымен полимердің молекулалық массасына байланысты емес.
- Полимер ерітінділерінің фазалық тепе-теңдігі
Полимер ерітінділері термодинамикалық тұрақты, тепе- тендіктегі гомогенді жүйе. Тепе- теңдік күйдегі көп фазалы бірнеше компонентті кез- келген жүйе Гиббстің фазалар ережесіне бағынады.
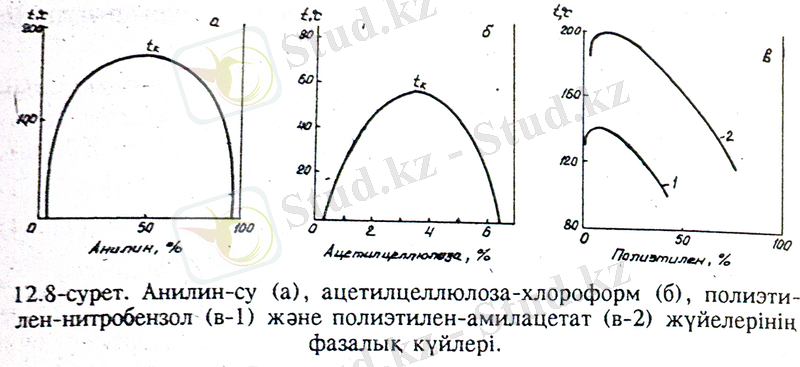
12, 8 - сурет.
Мұндағы Ф - фазалар саны, К-жүйедегі компоненттер саны, С -оның еркіндік дәрежесі.
Еркіндік дәреже С жүйедегі санын өзгертпей, яғни жүйедегі тепе-теңдікті сақтай отырып, өзгертуге болатын тепе-теңдік факторларының (қысым, температура, концентрация және т. б) санын көрсетеді. Еркіндік дәрежесі 0, 1, 3 тең болувна байланысты жүйе нөл, бір, екі, үш вариантты болып есептеледі.
Әдетте қысым конденсацияланған жүйелердің қасиетіне онша әсер етпейді, сондықтан қысымды тұрақты деп алып, фазалар ережесінің теңдеуін былай жазады:
С =К - Ф + 1
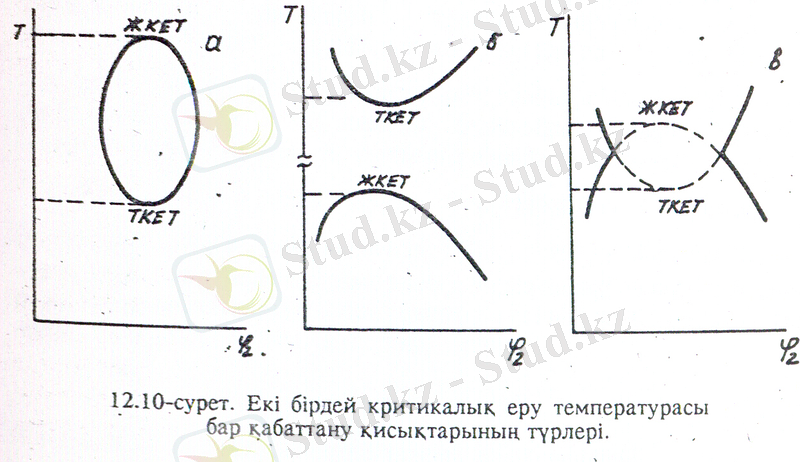
Бұл теңдеу бойынша екі компонентті бір фазалы жүйенің екі еркіндік дәрежесі бар, яғни жүйенің күйі температура мен когмпоненттерінің концентрациясымен анықталады. Екі фазалық (Ф =2) екі компонентті жүйенің тек бір еркіндік дәрежесі болады. Демек, температура өзгергенде екі фазаның концентрациясы да өзгереді. Екі компонентті жүйе, не ерітінділер температураға байланысты бір фазалы гомогенді болуы, не болмаса екі фазаға бөлініп, қабаттануы мүмкін. Ерітіндінің қабаттана бастаған температурасын фазалық қабаттану температурасы, не фазалық бөліну температурасы (Т Ф ) дейді. Фазалық бөліну температурасының ерітіндінің құрамына тәуелділігі өзара араласу қисығымен - бір фазалы ерітінділерді екі фазалы ерітінділерден бөлетін шекаралық қисықпен өрнектеледі. (12. 8, а-сурет) . Компенненттердің құрамына тәуелсіз бір - бірінде шексіз ери бастайтын температурасын критикалық еру температурасы не критикалық қабаттану температурасы Т с дейді.
12, 9-сурет.
Көпшілік полимерлер төмен молекулалық сұйықтарда белгілі бір температура аралығында ғана шексіз ериді (толық араласу) . Бұл температура аралығынан тыс компоненттердің өзара ерігіштігі шектеледі де (жартылай араласу ), ерітіндінің әр фазасы бір компенненттің екіншісіндегі қаныққан ерітіндісін береді. Төмен молекулалық заттар ерітіндісінен өзгеше полимер ерітінділері фазалық бөлінгенде өте ісінген тұнба түзіледі. Бұл тұнбада полимерге қарағанда еріткіш көбірек болады. Полимер ерітінділерінің тағы бір ерекшелігі, оның құрамында еріген зат өте көп бола алмайды, себебі полимердің ерігіштігі аз болғандықтан ерітінді тез қанығады. Сондықтан критикалық еру температурасы ерітіндінің біршама төмен концентрациясында байқалады да, (12. 8, б-сурет), полимердің толық фазалық диаграммасы өте ассиметриялы келеді (12. 8, в- сурет) .
Полимер ерітінділеріне де бірнеше фазалық диаграммалар тән. Критикалық еру температурасының типі еріткіштің полимерге дееген термодинамикалық ынтықтығы температураға сәйкес қалай өзгертетіне байланысты. Мұндай тәуелділік сызба нұсқа түрінде 12. 9 - суретте келтірілген. Егер екінші вириальді коэффициент А
2
температура төмендегенде кеміп тұрса, яғни еріткіш нашарлай берсе, онда жүйе салқындағанда қабаттанады деуге болады. Мұндай фазалық диаграммада жоғары критикалық еру температурасы (ЖКЕТ) байқалады (12. 9, а-сурет) . Процесс эндотермиялық, энтропияның жүреді (
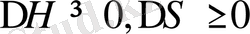 ) .
) .
Температура артқанда А
2
абсолют төмендейтін болса, онжа жүйе қызғанда қабаттанауы керек, яғни қабатану қисығы төменгі критикалық еру температурасы (ТКЕТ) арқылы өтеді (12. 9 б-сурет) . Бұл кезде (
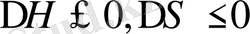 ), яғни процесс эгзотермиялық, , энтропия бұл кезде төмендейді. Энтропияның төмендеуіне екңі фактор әсер етуі мүмкін. Біріншіден, ТКЕТ бар фазалық диаграмма араларында күшті дипольдік әрекеттестік не күшті сутектік байланыс бар компененттерге тән. Бірінші типті компонентердің мысалына өзара сутектік байланыс түзетін целлюлоза нитраты мен этил спиртін алуға болады. Бұл жүйенің күй диаграммасындағы ТКЕТ еріткіштің қайнау температурасынан төмен температурада жатады. Екінші типті ТКЕТ компененттерінің термиялық ұлғаю коэффиценттерінің айырмашылығы өте үлкен ерітінділерге тән. Мұндай жүйелерді қыздырғанда еріткіш молекулаларда, полимер макромолекулаларда бір-бірімен ассоцияциялануда әр компоненттердің өзара байланысы күшейіп, ерітінді қабаттанып кетеді. Мысылы: полиэтиленоксид - су, метильцеллюлоза - су және т. б. жүйелер. Кейбір ерітінділердің фазалық диаграммасында ЖКЕТ, ТКЕТ да болуы мүмкін, және компоненттердің табиғатына қарай ерігіштік қисығының түрі де әртүрлі болады (12. 10. а- сурет) . Мұндай жүйелерде ТКЕТ
), яғни процесс эгзотермиялық, , энтропия бұл кезде төмендейді. Энтропияның төмендеуіне екңі фактор әсер етуі мүмкін. Біріншіден, ТКЕТ бар фазалық диаграмма араларында күшті дипольдік әрекеттестік не күшті сутектік байланыс бар компененттерге тән. Бірінші типті компонентердің мысалына өзара сутектік байланыс түзетін целлюлоза нитраты мен этил спиртін алуға болады. Бұл жүйенің күй диаграммасындағы ТКЕТ еріткіштің қайнау температурасынан төмен температурада жатады. Екінші типті ТКЕТ компененттерінің термиялық ұлғаю коэффиценттерінің айырмашылығы өте үлкен ерітінділерге тән. Мұндай жүйелерді қыздырғанда еріткіш молекулаларда, полимер макромолекулаларда бір-бірімен ассоцияциялануда әр компоненттердің өзара байланысы күшейіп, ерітінді қабаттанып кетеді. Мысылы: полиэтиленоксид - су, метильцеллюлоза - су және т. б. жүйелер. Кейбір ерітінділердің фазалық диаграммасында ЖКЕТ, ТКЕТ да болуы мүмкін, және компоненттердің табиғатына қарай ерігіштік қисығының түрі де әртүрлі болады (12. 10. а- сурет) . Мұндай жүйелерде ТКЕТ
 ЖКЕТ және
ЖКЕТ және
12, 10 - сурет. Екі бірдей критикалық еру температурасы бар қабаттану қисықтарының түрлері.
ТКЕТ еріткіштің қайнау температурасынан төмен жатады. Ал полиэтилен- алкандар, полистироль- циклогексан сияқты, химиялық құрамы жағынан бір-біріне жақын, бірақ өлшемдерінен айырмашылығы өте үлкен жүйелер үшін ТКЕТ
 ЖКЕТ (12. 10 б- сурет) .
ЖКЕТ (12. 10 б- сурет) .
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz