Ni2+ ионының глицин мен лимон қышқылымен түзілетін комплексті қосылыстарды спектрофотометриялық әдіспен зерттеу


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ ҒЫЛЫМ ЖӘНЕ БІЛІМ МИНИСТРЛІГІ
БІТІРУ ЖҰМЫСЫ
Тақырыбы: Ni 2+ ИОНЫНЫҢ ГЛИЦИН ЖӘНЕ ЛИМОН ҚЫШҚЫЛЫМЕН КОМПЛЕКСТІ ҚОСЫЛЫС ТҮЗУІН СПЕКТРОФОТОМЕТРИЯЛЫҚ ӘДІСПЕН ЗЕРТТЕУ
МАЗМҰНЫ
Кіріспе . . . 3
1. КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫҢ ТЕОРИЯЛЫҚ НЕГІЗДЕРІ
1. 1. Комплексті қосылыстардың зерттелу жайы . . . 5
1. 2. Комплекс түзілу процесін зерттеу . . . 9
2. ЕРІТІНДІДЕГІ КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫ ЗЕРТТЕУДІҢ ӘДІСТЕРІ
2. 1. Үздіксіз өзгерулер әдісі . . . 15
2. 2. Молярлы байланыс әдісі . . . 17
2. 3. Бент-Френчтің шектелген логарифмдік әдісі . . . 20
2. 4. Тепе-теңдікті ығыстыру әдісі . . . 21
2. 5. Комплекс түзілу процесін зерттеудегі
потенциометриялық әдіс . . . 22
2. 6. Я. Бъеррум әдісі . . . 24
2. 7. Түзілу функциясын және түзілу қисығын анықтау . . . 25
2. 8. Түзілу функциясынан түзілу тұрақтысын анықтау . . . 30
2. 9. Ерітіндідегі комплекс түзілу процесін зерттеудегі
спектрофотометриялық әдіс . . . 33
3. ТӘЖІРИБЕЛІК БӨЛІМ
3. 1. Зерттеудің әдістері мен аппаратурасы . . . 37
3. 2. Тәжірибенің әдістемесі . . . 39
3. 3. Тәжірибе қорытындысын есептеуге арналған формулалар . . . 42
3. 4. Тәжірибе нәтижелерін талқылау . . . 45
ҚОРЫТЫНДЫ 60
ӘДЕБИЕТТЕР ТІЗІМІ 62
КІРІСПЕ
Комплексті қосылыстар ΧІΧ ғасырдан бері белгілі. Осы облыста көптеген зерттеушілер жұмыс атқарды. Олардан А. Вернерді, П. Пфейфферді, Ф. Файгльді, А. Б. Бабконы, Я. А. Фиалковты, Б. В. Некрасовты және тағы басқаларды айтуға болады. Ал қазақстандық ғалымдар Е. Х. Абланова, Х. К. Оспанов, Шалдыбаева, Е. А. Мамбетқазиевтар осы салада елеулі еңбек атқарды.
Химия ғылымы бойынша маңызды тың мәселеге негіз болып отырған комплексті қосылыстарды жан-жақты зерттеуді қажет етеді. Ал оның дамуы біздің білімімізді жетілдірудің басты кепілі болып табылады. Ағзадағы тасымалдау құбылысын сөз еткенде комплексті қосылыстардың өмірлік қажеттілігі арта түседі. Осы қажеттілікті өтеуден тақырыптың өзектілігі туындайды.
Зерттеу нысаны: Ni 2+ ионының глицин және лимон қышқылымен комплексті қосылыс түзуін спектрофотометриялық әдіспен зерттеу.
Зерттеу пәні: Ni 2+ ионының глицин және лимон қышқылымен комплексті қосылыс түзілу процесін зерттеудің әдістемесін талдау және осы жұмысқа лайықтап құру.
Жұмысты жазудағы мақсат: Комплексті қосылыстар төңірегіндегі түрлі зерттеу нәтижелерін туғызған теориялық негізді бір жүйеге келтіре отырып, Ni 2+ ионының глицин және лимон қышқылымен комплексті қосылыс түзуін зерттеу.
Аталған мақсат төмендегідей міндеттерді көздеп отыр:
-комплексті қосылыстардың зерттелу тарихы деңгейіне шолу жасау;
-ерітіндідегі комплексті қосылыстарды зерттеудің әдістері, яғни оның ішінде:
а) Үздіксіз өзгерулер әдісі
б) Молярлы байланыс әдісі
в) Бент-Френчтің шектелген логарифмдік әдісі
г) Тепе-теңдікті ығыстыру әдісі
д) Комплекс түзілу процесін зерттеудегі
потенциометриялық әдіс
е) Я. Бъеррум әдісі және т. б
- Ni 2+ ионының глицин және лимон қышқылымен комплексті қосылыс түзуін спектрофотометриялық әдіспен зерттеу.
Зерттеу болжамы: Ni 2+ ионының глицин және лимон қышқылымен комплексті қосылыс түзуі мүмкін.
Жұмысты жазу барысында теориялық-әдеби шолу жасау және эксперименттік-спектрофотометрлік әдіс басшылыққа алына отырып жасалды.
Жұмыстың жаңашылдығы : комплексті қосылыстар табиғатын тануда түрлі арнайы зерттеу жұмыстары жүргізілген. Мен осы зерттеу жұмыстарының нәтижелері туғызған түрлі теориялық негізді басшылыққа ала отырып, Ni 2+ ионының глицин және лимон қышқылымен комплексті қосылыс түзуінің әдебиеттерде қарастырылмағанын анықтадым. Осы анықтаулар нәтижелері жұмыстың жаңашылдығын көрсетеді.
Жұмыстың практикалық маңызы: осы жұмыста алынған нәтижелерді химия пәнінен комплексті қосылыстарды өткен кезде әртүрлі семинар сабақтарда және арнайы курстарда қолдануға болады.
Жұмыстың құрылымы: бітіру жұмысы кіріспеден, негізгі бөлімнен, қорытындыдан, әдебиеттер тізімінен тұрады.
1. КОМПЛЕКСТІ ҚОСЫЛЫСТЫҢ ТЕОРИЯЛЫҚ НЕГІЗДЕРІ
1. 1 Комплексті қосылыстардың зерттелу жайы
Қазіргі таңда химия саласында комплексті қосылыстар химиясы, оларды синтездеу мәселесі және практикалық маңызы жайлы қарастыру өмір талабынан туып отыр. Комплексті қосылыстар халық шаруашылығының түрлі тармағында қолданылады.
Сулы ерітіндіде берік, ыдырамайтын немесе өзінің құрам бөліктеріне өте аз мөлшерде ыдырайтын жоғарғы реттегі қосылыстарды Вернер комплексті қосылыс деп атады. Яғни Вернер комплексті қосылыстарды жоғарғы реттегі қосылыстардың жеке жағдайы деген түсінік қалыптастырды.
Комплексті қосылыс туралы Д. И. Менделеевтің пікірі өз мағынасын әлі күнге дейін жойған емес. Бір қосылыс оның термодинамикалық жағдайына байланысты қарапайым қосылыс немесе комплексті қосылыс болуы мүмкін деген. Мысалы, хлорлы натрий бу күйінде NaCl-дың жеке молекулаларынан тұрады; осы жағдайда ол қарапайым бинарлы қосылыс. Егер осы тұзды кристалдық жағдайынан алып, рентгендік талдау жасасақ, біз әрбір натрий ионының симметриялы алты хлор ионы, ал әрбір хлор ионын -алты натрий ионы қоршаған жоғарғы молекулалы қосылыс(NaCl) n аламыз. Бу күйінде су қарапайым H 2 O формуласына, ал сұйық күйінде (H 2 O) n формуласына сай келеді. [1]
Чугаев, Пфейффер және басқа ғалымдар комплексті қосылыстарды немесе жоғары ретті қосылыстарды бірінші қатардағы қосылыстардың молекулаларының өнімдерінің қосылысы дейді. Бірақ бұл анықтама тиімді болып табылмайды. Бір жағынан, осы анықтама тұрғысынан, мысалы H 2 SO 4 (SO 3 пен H 2 O қосылысының өнімі), AuU 3 (AuU мен U 2 қосылысының өнімі және т. б. түсінуі мүмкін. Ал басқа жағынан, жеке өнімдердің қосылысы түрінде қаралмайтын комплексті қосылыстардың класы да бар. )
Соған байланысты көптеген әдебиеттерде комплексті қосылысқа әртүрлі анықтама береді.
Б. Ф. Некрасов комплексті қосылыстарды құрам бөліктерінің бірігуімен, бірақ жаңа электрон жұбының пайда болуымен байланысы жоқ қосылыс екенін анықтаған. Комплексті қосылыстар ұғымын сулы емемс ерітіндідегі заттың жағдайы мен кристалдың жағдайы жөніндегі талдауды Я. А. фиалков жүргізген.
Осы айтылғанның барлығынан барып, комплексті қосылысқа дәл, нақты анықтама беру мүмкін емес екеніне көзім жетті.
Комплексті қосылыстар дегеніміз - ерітіндіде және кристалл күйінде кездесетін оң және теріс зарядталған күрделі иондары бар анықталған молекулалы қосылыстар.
XIX ғасырдың аяғында комплексті қосылыстарды зерттеу орталығы Вернер зертханасына көшіп келеді. Ұлы Қазан төңкерісінен кейін зерттеулер Совет Одағында жүргізілді. Бұл бағыттағы зарттеу жұмыстарын Д. И. Менделеев бақылап отырды. Д. И. Менделеев «Химия негіздері» еңбегінде комплексті қосылыстардың түзілуі, құрылысы, қасиеттері жөнінде құнды мәліметтер бар.
Комплексті қосылыстар туралы түсініктер ерітіндіде жүретін реакцияларды зерттеу негізінде туды. Алғашында комплексті қосылыстар химиясында препаративті әдіс маңызды болған, демек ерітіндіден белгілі қосылыстарды бөлу әдісі еді. Осы әдістің арқасында координациондық теория дамыды. Кейінірек физико-химиялық анализ әдісі қолданылып, ол ерітіндіден комплексті қосылысты бөлмей, оның тұрақтылық константасы мен құрамын анықтауға қолданылды.
Сонымен қатар Вернердің координациялық теориясының орны ерекше. Диссоциацияның сипатын және химиялық реакцияларды зерттеуі комплексті қосылыстың әрекеттесуі атомдар мен молекулаларды ажыратуға, мықты және мықты емес байланысқан комплекс түзуші атомды анықтауға мүмкіндік берді.
Комплексті тұздардың иондарға ыдырау типі және комплексті ионның құрамын анықтағанда физико-химиялық әдістердің ішінде ыңғайлы және ерітіндінің электрөткізгіштігін өлшеуді Вернер тәжірибеге енгізген.
Ерітіндідегі комплекс ионының құрамын анықтау үшін спектрофотометриялық әдіс қолданылады. Негізінен екі спектрофотометриялық әдістің екі түр өзгерісін пайдаланады; олар: «үздіксіз өзгерістер» әдісі(Остролигеленский-Жоб әдісі) мен «шектеулі логарифмдеу әдісімен» құрамын анықтау.
«Үздіксіз өзгерістер» әдісі, молярлығы бірдей ерітінді күйіндегі заттардың әртүрлі арақатынасы араласып, бірақ жалпы көлемінің өзгеріссіз қалуына негізделген.
Мысалы, 8 мл А ерітіндісі мен 2 мл В ерітіндісі араластырылса, 6 мл А ерітіндісі мен 4 мл В ерітіндісі, 5 мл А ерітіндісі мен 5 мл В ерітінділері араластырылса т. с. с. Әр комбинация үшін қандай да бір қасиеті өлшенеді (бұл жағдайда сіңіру өзгерісі) . Таңдалынып алынған қасиеттердің максимумы немесе минимумы ерітіндідегі қосылыстардың құрамына жауап береді. [6]
Координациялық теория бойынша комплексті қосылыста орталық орын алып тұрған ион немесе атом комплекс түзуші деп аталады.
Мысалы, мына қосылыстар CuSO
4
*4NH
3
немесе PtH
4
*2KCl комплексті қосылыстар болады. Бұлардағы [
 4
] SO
4,
K
2
4
] SO
4,
K
2

 мыс және платина иондары комплекс түзуші.
мыс және платина иондары комплекс түзуші.
Комплекс түзушінің айналасына, соның әсері тиетіндей жақындатқанда жиналған, яғни координацияланған иондарды немесе молекулаларды лигандтар, аддендтер деп атайды. Міне, осылар (комплекс түзуші мен лигандтар) бірігіп, комплексті қосылыстардың ішкі сферасын құрайды. Комплексті қосылыстарды жазғанда олардың ішкі және сыртқы сфераларын айырып көрсету үшін ішкі сфераны жоғарыда айтқандай квадрат жақшаға алады. Мысалы: [Pt (NH 3 ) 4 Cl 2 ], [NH 4 ] Cl, [Pt(NH 3 ) 2 Cl 2 ] т. б
Комплексті қосылыстардың саны әлдеқайда көп. Өйткені, біріншіден, элементтердің көпшілігі, оның ішінде металдар, әсіресе қосымша топтардағы металдардың барлығы, комплекс түзуші бола алады. Екіншіден, комплекстің ішкі сферасына лиганд ретінде кіретін бөлшектер өте көп, олар:
- Құрамында оттек бар қосылыстар - су (комплексті қосылыс - кристаллогидраттар түзеді), спирттер (алкоголяттар түзеді), қышқылдар(ацидаттар түзеді) альдегидтер лептондар да комплекстің ішкі сферасына кіре алады.
- Құрамында азот бар қосылыстар - аммиак - (аммиакаттар түзеді), нитридтер, амидтер т. б. қосылыстар да ішкі сфераға кіре алады.
- Құрамында күкірт бар қосылыстар - сульфидтер, тиоспирттер, тиоэфирлер т. б. қосылыстар да ішкі сфераға кіріп комплекс түзеді.
- Тұздар және тұздардың қос тұз типті комплексті қосылыстары.
- Полигалогенид, полисульфид сияқты комплексті қосылыстары
- Күрделі қышқылдар (изополиқышқылдар, гетерополиқышқылдар) .
Химияда неше комплекс түзуші элемент болса, соның әрқайсысы осы аталған лигандтармен комплекс түзе алады. Осының өзінен комплексті қосылыстардың қаншалықты көп екендігін байқауға болады.
Орталық атомның төңірегіне лигандтардың қандай санын ұстап қалуына, яғни оның координациялық санына байланысты болады. [2]
Комплексті қосылыстардың қазіргі ғылымда алатын орны мен маңызына қысқаша тоқталсақ:
- Ең алдымен, комплексті қосылыстар кең таралған. Олардың әрбіреуі кристаллогидрат түзіп, жағдайға байланысты кристаллогидраттың құрамы әртүрлі болады.
- H2O формуласына су тек бу күйінде сәйкес келеді, ал сұйық, қатты күйлерінде ассоциацияланып, молекулааралық әрекеттесу байқалады. Сонымен қатар бірінші ретті қосылыстар, мысалы, NaCl, NH3, CH3COOH бола алады. Яғни қарапайым бинарлы қосылыстар валенттілік іліміне сай болғанымен, ары қарай зерттегенде қанықпаушылық қасиет көрсететіні анықталды.
- Комплексті қосылыстардың құрылысының кеңістіктік түрінің дамуы ерекше. Химиялық қосылыстың мағыналы арифметикалық, геометриялық сипатта ғана болып қоймаса, біздің көзқарасымыз шектеулі болмайды.
- Комплексті қосылыстың қасиетін сипаттайтын кеңістіктік түсініктер қатты дене химиясында, кристаллохимияда өте ерекше орын алады. Егер тұздардың рентгенограммасын оқу үшін қажет, комплексті қосылыстардың изомериясын талқылау нәтижесінде туындаған координация түсінігі болмаса, онда ғалымдарға бұл түсінікті комплекстен тыс зерттеу қажеттігі туар еді.
- Еру процесінің нәтижесінде, еритін зат пен еріткіштің әрекеті комплекс түзеді. Комплекстердің құрылысын терең зерттеу электролиттік диссоциация механизмін түсінуге мүмкіндік туғызады.
- Комплексті қосылыстарды зерттеу арқасында қышқыл мен негіздің электростатикалық теориясы дамыды.
- Катализатор ретінде қолданылып, органикалық синтезде аралық өнім болып табылады.
- Комплексті қосылыстардың тек қана теориялық мағынасы ғана емес, тәжірибелік мәні зор. Сандық және сапалық анализ әдістерінде көп қолданылады. Комплекс түзілу құбылысы жеке иондардың қасиеттерін анықтауға мүмкіндік туғызады.
- Платина тобының химиялық таза металдарын алуда қосалқы мағынасы бар. Сілтілік-жер, транс уран элементтерін бөлуде, химиялық технологияда алтын, никель, кобальт, мысты бөлуде, сілтілік металдарды бөлуде қолданылады.
- Комплексті қосылыстар бояу прцестерінде де үлкен рөл атқарады.
- Комплексті қосылыстар радиохимияда мағынасы зор. Олар радиоактивті изотоптарды концентрлегенде қолданылады. [4]
1. 2 Комплекс түзілу үрдісін зерттеу
Ерітіндідегі комплексті бірігуге химиялық тепе-теңдікке комплекстің үздіксіз түзілуі және ыдырауы жатады. Оны мына түрде жазуға болады:
M + L ↔︎ML (1)
М - металл түзілудің ионы
L - лиганда
ML - комплексті элементар нысана
Металдың гидратталған ионында сатылы орынбасу жүрсе де комплекс түзілу үрдісін металдың еркін ионына лигандалардың бірігуімен сипаттауға болады. Нақтылы түрдегі комплекс түзілу реакциясын сатылы К
і
комплекс түзілу тұрақтысымен және
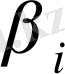 немесе
немесе
 -ң жалпы сәйкес келетін тұрақтысы көмегімен жазуға болады.
-ң жалпы сәйкес келетін тұрақтысы көмегімен жазуға болады.
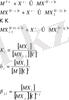 (2)
(2)
[1-2] әдебиеттерде термодинамикалық және концентрациялық беріктік тұрақтысы ретінде қолданылады. Термодинамикалық тұрақты теңдеуі құрамына белсенділік коэффициенті кіреді. Комплекстің концентрациялық беріктік шегі мен термодинамикалық беріктік шегі келесідей түрде байланысады:
 (3)
(3)
Ерітіндіні шексіз араластыру кезінде белсенділік коэффициенті 1-ге ұмтылады. Концентрациялық тұрақтылар мәні термодинамикалық тұрақтылардың мәніне жуықтайды.
Әр лигандалы комплекс түзілудің тұрақтылығын ішкі сферадағы лигандалардың сәйкестілігінің мөлшерлік және сапалылығына сүйеніп түсіндіруге болады.
Комплекстің ішкі сферасындағы екі лиганданың бірігуінің мөлшерлік сипаттамасында беріктік тұрақтысы және бөлшектену тұрақтысы қолданылады.
Екі әртекті лигандалы, бір ядролы комплекстің түзілуін жалпы түрде келесідей теңдеумен сипаттауға болады.
M + pX +qY ↔︎MX p Y q (4)
Бұл теңдеудің тепе-теңдік (беріктік) тұрақтысы:
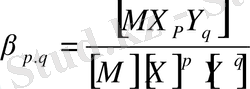 (5)
(5)
Мұндағы М-металл ионы;
Х, Ү - лигандалар;
p, q - стехиометриялық коэффициенттер;
 - беріктіктің жалпы тұрақтысы.
- беріктіктің жалпы тұрақтысы.
Бұл тұрақты жай құрамнан тұратын, араласқан комплексті бірігуді сипаттайды. Әр лигандалы комплекстің салыстырмалы беріктігінің біртектіден айырмашылығы реакцияның тепе-теңдік тұрақтысымен анықталады.
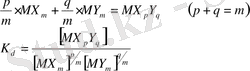 (6)
(6)
Мұндағы К d -бөлшектену тұрақтысы. Оны орталық атомның координациялық сферасындағы табиғаты бойынша әртүрлі лигандалардың сәйкестік өлшемі деп қарастыруға болады. Беріктік және бөлшектену арасындағы қатынас келесідей түрде болады.
 (7)
(7)
Мұндағы
 -жеке комплекстердің беріктік тұрақтылары.
-жеке комплекстердің беріктік тұрақтылары.
Әр лигандалы комплекс бірігудің беріктігін химиялық байланыстың түрін және металдың орталық атомының табиғатын анықтайтын мөлшерлік сипаттаманы негізге ала отырып түсіндіруге болады. . [5]
1963 жылы Ральф Пирсон лиганда атомын және металл ионын жұмсақ және қатты қышқылдарға бөліп, негізгі электртерістілігі мен полярлығын сәйкестендірді. Пирсонның ережесінің негізгі мағынасы келесідей тұжырымдалады: қатты қышқыл қатты негізбен байланысады, ал жұмсақ қышқыл жұмсақ негізбен байланысады.
Комплекс түзілуді қышқыл-негіз концепциясының жеке жағдайы ретінде қарастыруға болады. Бұл жағдайда Льюис қышқылы ретінде металл ионы алынады, ал лигандалардың көбі Льюис негізі болып табылады. Жалпы түрде металдарды арасында периодтық кестедегі ауысу металдары орналасқан А және В металдарға бөледі. Пирсон А класының металл иондарын қатты қышқыл деп атады. Олар жоғарғы зарядпен, сонымен қатар жеңіл қозғалатын сыртқы электрондары жоқ төменгі полярлылықпен сипатталады. В класының металл ионы жұмсақ қышқыл деп аталады. Оның төменгі оң заряды, үлкен өлшемділігі және жоғарғы полярлылығы бар. Бұндай иондардың жеңіл қозатын бірнеше сыртқы электроны бар.
Жоғарғы полярлылық қасиеттеріне ие төменгі терістілігі және тез қышқылданатын донорлық атомдары бар лигандалар жұмсақ негіздер деп аталады.
Төменгі полярлық: жоғарғы электртерістілік және қиын қышқылданатын қасиеттерге ие донорлық атомдары бар лигандалар қатты негіздер деп аталады. Ауысу металдарының ионы А және В металдарының арасында орналасады. Олардың құрылымы жұмсақ пен қатты арасындағы мәмілеге (компромиске) ұқсайды. Т катиондарын жұмсақ және жеңіл деформацияланатын сыртқы электрондық қабықпен қоршалған сфералық ядро деп қарастыруға болады. Пирсонның ережесін әрлигандалы және әр ядролы комплексті бірігудің салыстырмалы беріктігін сапалы бағалауда қолайлы ереже ретінде пайдалануға болады.
Лиганда түзілуі жағдайында атом мен металдың ковалентті байланысы кезінде оның орбиталі анти байланысқа ұшырайды және олардың энергиясы жоғарылайды. Бұдан кейін бұл орбитальдардың басқа лигандалардың орбиталімен байланысы төмендей түседі. Байланыс сипатының коваленттілігінің ұлғаюы, металл атомының теріс заряд әсерінің төмендеуіне әкеледі, сонымен қатар басқа лигандалармен байланысының нашарлауына әкеледі. Атом мен металдың π-дативті байланыс түзу үшін бос орбитальдар лигандасының тасымалдануы теріс әрекетке әкеледі: Металл орбиталінің байланысы төмендейді, металл атомындағы эффективті заряды ұлғаяды. Олай болса, комплекстегі π-акцепторлы лигандалар басқа лигандалармен жақсы сәйкес келу керек.
Лиганданың орталық атом табиғатымен сәйкестену байланысы Ирвинг-Уильямс қатарымен келесідей түрде анықталады:
Mn 2+ < Fe 2+ < Co 2+ < Ni 2+ < Cu 2+ > Zn 2+
Қатар N және О донорлық атомға ие әртүрлі лигандалары бар комплекстің көп саны үшін орындалады.
Комплекстің бұндай өзгеру реті кристалдың өріс теориясының және лиганданың өріс теориясының позитивтілігімен түсіндіріледі. Металдың орталық ион маңайындағы кристалдық өріс металл ионы маңайында орналасқан лигандалардың электр өрісін тудырады. Бұл өріс d-орбиталдарының энергиясына әсер етеді де, оның үзілуіне әкеледі. Егер d электрондары энергиялық деңгейге неғұрлым аз орналасса, комплекс соғұрлым тұрақты болады.
Cu 2+ комплексі октаэдр осінің біреуінен тартылған құрылымға ие. Осының әсерінен, қосымша тұрақтылық және Cu 2+ комплексінің беріктігі Ni 2+ ұқсас комплексіне қарағанда арта түседі. . [11]
Комплексті бірігу беріктігін зерттегенде тағы бір маңызды факторлардың бірі - хелаттық әсер энергиясы және металдың донорлық атоммен жеке байланыс түзілу энергиясы.
Хелаттық әсер металдардың табиғатына, олардың тұйықталу цикліне және стереохимиясына байланысты болады. Хелаттық әсер энтальпия мен энтропия өзгерісінен қалыптасады.
Ереже бойынша металл комплексонатының түзілуі орталық ионның және комплексонның десольватациялық әсерінен ерітіндіде энтропияның өсуіне әкеледі. Металдардың табиғатына байланысты ереже бойынша ML комплексінің энтропия түзілуі бірдей зарядты металдар қатарындағы Z ML (r M +r L ) шамасына сызықты тәуелді. Көптеген комплексонаттың түзілу энтальпиясының мәндері жоғары емес.
Бъеррум мен Нильсон алғаш рет бірдей лигандалар кезіндегі хелатты әсер мәндерінің бірақ әртүрлі металл иондары үшін айырмашылықтары болуы мүмкін екендігін көрсетті. Сонымен қатар хелаттық әсер тек энтропиядан ғана емес, изобаралық потенциалдың энтальпиялық құраушыларына да тәуелді. Көп жағдайда хелаттық түзілудің ∆Н мәніне әсер етуін комплекстегі лигандалардың тебілуімен түсіндіреді.
Моноциклді лигандалы комплекске қарағанда полициклді лигандалы комплекс тұрақты болады. Хелаттық әсер күміс(І), мыс(І) қосылыстарын ескермегендегі барлық металл комплекстерінде байқалады.
Комплекс түзілудің тепе-теңдігіне сонымен қатар ерітіндінің белсенділік коэффициент туындысы байланысын есептегендегі иондық күштің өзгерісі әсер етеді.
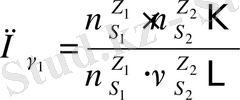 (8)
(8)
8-ші теңдеуді концентрациялық тұрақтыны есептегенде қолданады, сондықтан оның сандық мәні иондық күшке байланысты болады.
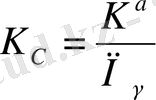 (9)
(9)
Комплекс түзілу үрдісіне су ерітінділерінің қышқылдығы да әсер етеді.
Сілтілік ортада металдардың гидрокомплексі түзілуі мүмкін, бұл кезде ерітіндінің құрамындағы лигандалар сутегі ионымен біріге отырып протондалады. Көп жағдайда рН ортадан комплекс бірігудің түзілуінің беріктік тұрақтысы байланысты болады. Сонымен бұл жұмыстағы протондалу дәрежесіне байланысты лигандалар, әр түрлі комплекс түзілу құрылымдарына ие болады. Сондықтан рН-тың белгілі бір мәні тұрақты ұсталынып тұрады. [14]
2. ЕРІТІНДІДЕГІ КОМПЛЕКСТІ ҚОСЫЛЫСТАРДЫ ЗЕРТТЕУ ӘДІСТЕРІ
2. 1 Үздіксіз өзгерулер әдісі
Бұл әдісті қолданудың алғышарттары келесідей болады:
- А және В компонентерінің қатысуы кезінде комплекс түзілудің тек бір ғана тепе-теңдігінің болуы.
- Массалар әрекеттесу заңының концентрациялық формада қолданылу мүмкіндігі.
- Тек бір ғана комплекстің түзілуі.
1-ші шарт жиі орындалады. Егер компоненттердің біреуі негіз болып саналса, яғни өзіне протон қосып алса, және қышқыл-негіздік тепе-теңдікке қатыса алса, онда рН-тың тұрақты мәнін ұстай отырып (сәйкес буферлік жүйені қолдану), әдісті қолдануға болады.
2-ші шартты қанағаттандыру үшін комплекс түзілуші компоненттердің аз концентрациясы кезінде, салыстырмалы жоғары концентрациялы тұз ерітіндісінде тұрақты иондық күш болғанда тәжірибені жүргізу қажет. Бұл шарт өлшенетін мәндер ретінде қату температурасы мен электрөткізгіштіктің төмендеуі сияқты физикалық қасиеттердің қолданылуын ескермейді. Осы қасиеттерге негізделген зерттеулер нәтижесі сандық қатынаста сенімді емес. Жарықтың жұтылуы, керісінше бұл үшін толықтай қолданылады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz