Әрекеттесуші массалар заңын тотығу-тотықсыздану тепе-теңдігіне қолдану және аналитік химиядағы қолданбалары


СОДЕРЖАНИЕ
Әрекеттесуші массалар заңын тотығу -тотықсыздану тепе - теңдігіне қолдану. 2
§1. Негізгі түсініктер2
§2. Тотығу - тотқсыздану реакциясының жүру бағыты8
§3. Тотығу - тоықсыздану реакциясына түрлі жағдайлардың әсері9
§4. Комплексті қосылыстардың түзу процесінің әсері12
§5. Тотығу - тотықсыздану тепе -тепеңдігінің константасы13
§7. Тотығу -тотықсыздану реакцияларын қарастыру15
§8 Редокс жұбының реалды потенциалын есептеу17
§9. Тотығутотықсыздану бағытын анықтау18
§9. Тотығутотықсыздану реакцияның аяғына дейін жүруін есептеу19
§3 Химиялық анализдің негізгі тараулары20
§4. Химиялық анализдің қолданбалы түрлері21
§5. Аналитикалық реакциялар мен рагенттер22
§6. Аналитикалық реакцияның сезгіштігі25
§ 7. Анализ әдістері27
Элементтердің периодтық системасы және катиондардың аналитикалық топтары. 30
§5. Химиялық тепе - теңдік және тепе - теңдік константасы42
§ 6. Концентрациялық және термодинамикалық константалары45
§7. Әлсіз электролиттердің су ерітінділеріндегі тепе - теңдігі46
7 - тарау48
Әрекеттесуші массалар заңы және гетерогенді48
тепе - теңдік48
§1. Ерігіштік көбейтіндісі48
2. Ерігіштік көбейтіндісі және ерігіштік52
3. Тұнбалардың ерігіштігіне түрлі жағдайлардың әсері57
4. Фракциялық немесе сатылап тұндыру62
5. Бір шашар еритін электролитті екінші нашар еритін қосылысқа айналдыру63
6. Тұнбаларды еріту процесі65
II тарау68
Экстракцияны сапалық анализде пайдалану68
§1. Негізгі түсініктер68
§2. Экстракцияның негізгі теориялық қатынастары69
§3. экстракциялау мефанизмінің түрлері72
Ішкі комплексті қосылыстардың /хелаттардың/ экстракциясы73
§4. VI аналитикалық топ катиондарын экстракциялық әдіспен бөліп алу. 76
§1. Жүйелік және бөлшектеу тәілдерімен анализдеу77
§2. Сапалық анализде катиондарды жіктеу түрлері78
Қышқылды негіздік жіктеу78
Сульфиттік жіктеу79
Аммиак - фосфатты жіктеу82
8 - тарау
Әрекеттесуші массалар заңын тотығу -тотықсыздану тепе - теңдігіне қолдану.
Сапалық анализде пайдаланылатын реакциялардың көбі тотығу - тотықсызану процестерімен байланысты, себебі осы проесс нәтижесінде тұнба түзіледі, ерітіндінің түсі өзгереді немесе басқа көзге көрінетін өзгерістер болуы мүмкін. Тотығу - тотықыздану (редокс) процестер сандық анализде де кеңінен қоданады. Мысалы, редоксиметрия, электроанализ, полярография
Тағы басқа әдістер де тотығу тотықсыздану поцестеріне негізделген. Сол себепті осы процестердің негізгі сұраөтарын қарастыру қажет.
 §1. Негізгі түсініктер
§1. Негізгі түсініктер
Тотығу тотықсыдану реакцияларының электрондық теориясын алғаш рет 1914 ж Л. В. Писаржевский ұсынды. Тотығу - тотықыздану реакциялары дегеніміз электрондардың бір атомдардан малекулалардан, иондардан, комплексті иондардан екіншілеріне ауысуымен байланысты процесстер. Электрондарды беріп жіберетін бөлшектер - тотығу - тотықыздандырғыштар, электронды қосып алатын бөлшектер - тотықтырғыштар болады. Сол себепті процесс барысында тотықсыздандырғыш ектронды беріп жіберіп, өзінен оң тотығу дәрежесін жоғарлатады, ал тотықтырғыш электронды қосып алып, тотығу дәрежесін төмендетеді. Мысалы:
Cu
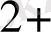 + Zn
+ Zn
 Cu + Zn
Cu + Zn
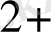
Zn - электрондарын мыс(II) иондарына береді, сондықтан ол тотықсыздандырғыш, ал Cu
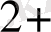
 электрондарды қосып алып -тотықырғыш қасиет көрсетеді. Осы реакцияны екі жартылай реакциялардан тұрады деп қарастыруға олады.
электрондарды қосып алып -тотықырғыш қасиет көрсетеді. Осы реакцияны екі жартылай реакциялардан тұрады деп қарастыруға олады.
Zn
 - 2е
- 2е
 Zn
Zn
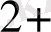 тотықсыздандырғыш, тотығады
тотықсыздандырғыш, тотығады
Cu
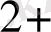 + 2e
+ 2e
 Cu
Cu
 тотықтырғыш, тотықсызданады.
тотықтырғыш, тотықсызданады.
Электрондардың ауысуы екі әдіспен жүруі мүмкін: химиялық және электрохимиялық.
Электрондардың химиялық жолмен ауысуын заттың сапалық өзгерістерінен байқауға болады (заттың түсі өзгереді, не газ бөлінеді немесе тұнба түзіледі. )
Электрондардың электрохимиялық әдіспен ауысуы гальваникалық элементтер жұмысының нәтижеснде өтеді, бұл кезде тотықсыздандырғыштың электрондары өкізгіш арқылы тотықтырғышқа көшіп, жүйеде электр тоғын немесе гальваникалық элементтердің электр қозғацшы күшін туғызады. Гальваникалық элементтерднгі электр тоғының пайда болуын гальваникалық элементтер теориясын түсіндіреді.
Металл пластинкасын суға немесе аттас иондары бар ерітіндіге батыратын болсақ, металдың бетінен ион - атомлары аздаған мөлшерде болса да ерітіндіге көшеді, ал суда ол иондар гидратталып ерітіндіде қалады. Металл катиондары ерітіндіге көшкенде оның бетіне артық мөлшерде теріс зарядтары болғандықтан пластика теріс зарядталады. Сонымен қатар ерітіндідегі иондар үнемі қозғалыста болуына байланысты металл бетімен соқтығысып, таралу күшінің әсерінен пластиканың сыртқы бетінде ұсталып қалады.
Осы себептен ерітіндідегі катиондар мен беті теріс зарядталған пластиканың арасында электростатикалық тартылу күші пайда болады, демек, металл пласинкасының ерітіндімен жанасқан шекарасында қос электрлік қабат түзіледі.
Кейде меалдың беті оң зарядталып өзіне ерітіндідегі теріс иондарды
( аниондарды) тартады. Нәтижесінде тағы да металдың ерітінді мен жанасқан шекарасында қос электрлік қабат түзеді.
8. 1- сурет, мырыш электроды. 8. 2 - мыс электроды.
Ерітіндідегі батырылған металдың заряд шамасы мен таңасы оның табиғатына тәуелді болады. Егерде катионның гидратталу энергиясы кристалл торының энергиясынан жоғары болса, бірінші сәтте ерітіндідегі ауысқан иондар саны пластинкаға кері тартылған иондардан көп болады да, метал пластинкасының беті теріс зарядталады. Кристалл торының энергиясы нан жоғары болса металдың беті оң зарядталады. Демек, ас тұзының ерітіндісіне батырылған металдарды оң немесе теріс потенциалы бар электрод деп қарастыруға болады. (Потенциалы Е деп белгілейді) .
Потенциал (Е) шамасы мен табасы металдың қасиетіне, крисалл торының
 энергиясына, ерітідідегі аттас иондар концентрациясы тәуелді болады. Меалл потенциалының тепе- теңдік күйде концентрациаға тәуелділігін 1988 ж. Нернст мынадай теңдеумен сипаттады:
энергиясына, ерітідідегі аттас иондар концентрациясы тәуелді болады. Меалл потенциалының тепе- теңдік күйде концентрациаға тәуелділігін 1988 ж. Нернст мынадай теңдеумен сипаттады:
E = E
 +
+
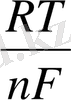 -
-
 lgC
lgC
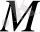 n + немесе
n + немесе
 E = E
E = E
 +
+
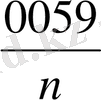 lg
lg
E- металдың электрондық потнциалы
E
 - металдың нормальды немесе стпндарты потенциалы.
- металдың нормальды немесе стпндарты потенциалы.
R - газ тұрақтысы = 8, 314 Джоуль/ моль, град.
n - металдың берген немесе қосып алған электрондар саны.
F - Фарадей саны, 95600 К
Т - 273 + t
Температура 298 K болған кезде 2, 3
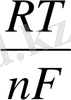 Equation. 3 =
Equation. 3 =
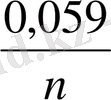 Equation. 3 тең, ал T=293 долған жағдайда
Equation. 3 тең, ал T=293 долған жағдайда
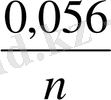 тең.
тең.
Электродтық потенциалдан шын мәнін өлшеу мүмкін емес, сондықтан оны салыстырмалы электрод арқылы өлшейді. Салыстырмалы электрод потенциалының мәні белгілі жағдайда тұрақты болып есептеледі Осындай салыстырмалы электродтардың қатарына стандартты сутек электроды жатады.
Стандартты сутек электроды Pt - пластинкасына (тілігіне ) электролиз арқылы платинаның ұнтағы қондырылған, сол себепті оның беттік ауданы өте үлкен, осыған бйланысты адсорбциялау қабілеті де өте жоғары болып келеді. Осылай дайындалан платина 0. 1н
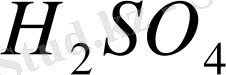 ерітіндісіне батырылып 1 моль газ күйінде сутек жіберіледі. Pt өз бетіне сутекті өте жақсы адсорбциялап, сутек электродының ролін атқарады, яғни
ерітіндісіне батырылып 1 моль газ күйінде сутек жіберіледі. Pt өз бетіне сутекті өте жақсы адсорбциялап, сутек электродының ролін атқарады, яғни
H
 2H
2H


 2H
2H
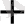 +2e
+2e
Бұл қайтымды процесс болғандықтан сутегі әрә тотықсызданады, әрі тотығады. Осындай дайындалған сутек электродының нольге тең деп алып, салыстырмалы электрод ретінде пайдаланады. Нормальды сутек электродынан басқа да салыстырмалы электродтар болады, оларға хлор - күмісті, карамельді т. б жатады.
Стандартты жағдайда металл потенциалын стадартты немесе нориальды электродтық потенциал деп атайды (E
 ) . Стандартты жағдай дегеніміз
) . Стандартты жағдай дегеніміз
C
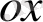 = C
= C
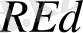 = 1 моль/л, T=298 K, C
= 1 моль/л, T=298 K, C
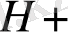 = 1моль/л
= 1моль/л
E
 - металдың және оның ионының тотығу- отықсыздану қабілетін сипаттайтын шама болып табылады. E
- металдың және оның ионының тотығу- отықсыздану қабілетін сипаттайтын шама болып табылады. E
 - оң немесе теріс таңбалы болуы мүмкін.
- оң немесе теріс таңбалы болуы мүмкін.
Кез - келген электродты стандарты сутек электродымен қосып гальваникалық элемент алуға болады, оның электр қозғаушы күшін милливоьтметрмен немесе патенциометрмен өлшеуге болады. Мысал ретінде мырыш - сутекті гальваикалық элементін қарастыруға болады. (8. 3 сурет) Мыыш электродының ролін 1н ZnSO
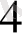 (ZnCl
(ZnCl
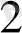 ) ЕРІТІНДІЛЕРІНЕ БАТЫРЫЛҒАН МЫРЫШ ПЛАСТИНКАНЫ АТҚАРАДЫ.
) ЕРІТІНДІЛЕРІНЕ БАТЫРЫЛҒАН МЫРЫШ ПЛАСТИНКАНЫ АТҚАРАДЫ.
Мырыш электродын стандартты сутек электродымен қосқан кезде тңзбекте электр тоғы пайда болады, оның кенеуін милливольтметрмен немесе потенцоиметрмен өлшеуге болады. Бұл гальваникалық элементтің схемасы күйде көрсетуге болады:
(-) Zn /ZnSO
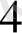 / H
/ H
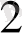 SO
SO
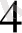 / (H
/ (H
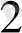 ) Pt (+)
) Pt (+)
Мұнда Zn SO
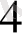 (
(
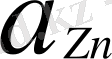 2+ = 1 моль) ерітіндісіне батылылған мырыш тілігі - анод, сутекті электорд - катод, ол электролиттік көпірше арқылы Zn SO
2+ = 1 моль) ерітіндісіне батылылған мырыш тілігі - анод, сутекті электорд - катод, ол электролиттік көпірше арқылы Zn SO
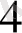 ерітіндісімен қосылады. Бұл кезде анодта мырыш тотығады, яғни мырыш пластинкасы ериді:
ерітіндісімен қосылады. Бұл кезде анодта мырыш тотығады, яғни мырыш пластинкасы ериді:
Zn
 - 2e
- 2e
 Zn
Zn
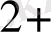
ал катодта H
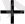 тотықсызданады:
тотықсызданады:
2H
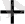 + 2e
+ 2e
 H
H
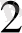
Электрондық реакцияларының жалпы күйін мына түрде жазуға болады:
Zn + 2H
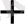
 Zn
Zn
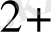 + H
+ H
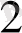
Электрондар мырыш электродынан сутек электродына ауысатын болғандықтан Zn
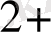 / Zn жұбының потенциалын шартты түрде теріс таңбалы шама деп алынған
/ Zn жұбының потенциалын шартты түрде теріс таңбалы шама деп алынған
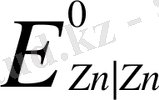
 = - 0, 76. осы сияқты басқада гальваникалық элементтерді қарастыруға болады. Мысалы, мыс - сутекті гальваникалық элемент жұмысын қарастырайық. Бұл жолы электрондар керісінше сутек электродынан мыс электродына ауысады:
= - 0, 76. осы сияқты басқада гальваникалық элементтерді қарастыруға болады. Мысалы, мыс - сутекті гальваникалық элемент жұмысын қарастырайық. Бұл жолы электрондар керісінше сутек электродынан мыс электродына ауысады:
Cu
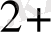 + 2e
+ 2e
 Cu
Cu

H
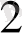 - 2e
- 2e
 2H
2H
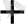
Cu
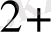 + H
+ H
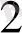
 Cu
Cu
 + 2H
+ 2H
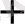
Бұл сызба - нұсқада Cu
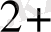 - OX
- OX
Cu
 - Red
- Red
Мұнда электрондар сутек электродынан мысқа қарай ауысқандықтан оның потенциалының мәнін шартты түрде оң таңбамен алады .
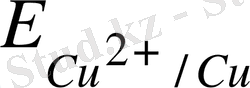 = 0, 34 B
= 0, 34 B
Тотығу - тотықсыздану жұбы білдей агрегаттық күйдегі формалардан тұруы мумкін. Мысалы, Fe
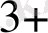 /Fe
/Fe
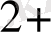 , Sn
, Sn
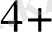 /Sn
/Sn
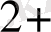 , MnO
, MnO
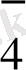 /Mn
/Mn
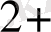 , т. б. Бұл жұптармен де гальваникалық элемент құрастыруға болады. Ол үшін нормальды сутек электродын зерттелетін тотығу - тотықсыздану жұбымен қосады. (8. 4 сурет) . ол үшін химилық стаканға FeCl
, т. б. Бұл жұптармен де гальваникалық элемент құрастыруға болады. Ол үшін нормальды сутек электродын зерттелетін тотығу - тотықсыздану жұбымен қосады. (8. 4 сурет) . ол үшін химилық стаканға FeCl
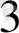 және FeCl
және FeCl
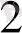 тұздарының молярлық концентрациясы бірдей көлемдерін қосып осы ерітіндіге платина тілігін батырады да элктролиттік көпірше арқылы нормальды сутек электродымен қосады. Гальваникалық элементтің схемасы:
тұздарының молярлық концентрациясы бірдей көлемдерін қосып осы ерітіндіге платина тілігін батырады да элктролиттік көпірше арқылы нормальды сутек электродымен қосады. Гальваникалық элементтің схемасы:
(- ) Pt (H
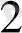 ) / H
) / H
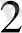 SO
SO
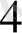 // Fe
// Fe
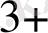 / Fe
/ Fe
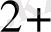 / Pt (+)
/ Pt (+)
Ал жүретін химиялық реакцмя:
2 Fe
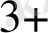 + H
+ H
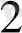
 2 Fe
2 Fe
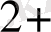 +2 H
+2 H
Fe
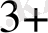 /Fe
/Fe
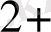 жүйесінің потенциалы E
жүйесінің потенциалы E
 (Fe
(Fe
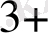 /Fe
/Fe
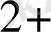 ) = 0, 77 В тең. тотығу - тотықсыздану реакцмясының жүруі редокс - жұбының химиялық активтігімен анықталады. Редокс - жұбтың химиялық активтігі стандартты электрондық потенциялының шамасымен сипатталады. Металлдар потенцмялдарының оң мәнінің өсуіне байланысты орналастырылған қатарды
электрохимиялық кернеу қатары
деп атайды. Демек, электрохимиялық кернеу қатары дегеніміз - бұл сутек стандартты потенциялына байланысты салыстыралы орналасқан нормальды электродтық потенциал қатары. Редокс жұбының E
) = 0, 77 В тең. тотығу - тотықсыздану реакцмясының жүруі редокс - жұбының химиялық активтігімен анықталады. Редокс - жұбтың химиялық активтігі стандартты электрондық потенциялының шамасымен сипатталады. Металлдар потенцмялдарының оң мәнінің өсуіне байланысты орналастырылған қатарды
электрохимиялық кернеу қатары
деп атайды. Демек, электрохимиялық кернеу қатары дегеніміз - бұл сутек стандартты потенциялына байланысты салыстыралы орналасқан нормальды электродтық потенциал қатары. Редокс жұбының E
 оң мәні неғұрлым жоғары болса, тотықан форманың тотықтырғыш қасиеті соғұрлым жоары болады. Керісінше неғұрлым E
оң мәні неғұрлым жоғары болса, тотықан форманың тотықтырғыш қасиеті соғұрлым жоары болады. Керісінше неғұрлым E
 теріс болса, тотықсызданған форманың тотықсыздандырғыштық қасиеті соғұрлым жоғары.
теріс болса, тотықсызданған форманың тотықсыздандырғыштық қасиеті соғұрлым жоғары.
Осындай тотыққан және тотықсызданған түрлері бар еітінділердегі электрод - ерітінді шекарасында пайда болған потенциалды тотығу - тотықсыздану деп атап, Нернст- Петерс теңдеуімен сипаттайды.
E =
 +
+
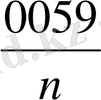 lg [
lg [
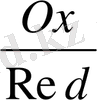 ] немесе
] немесе
E = E
 +
+
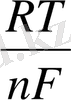 - ln
- ln
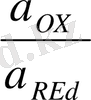 ; я
; я
 E = E
E = E
 +
+
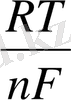 - 2, 3 lg
- 2, 3 lg
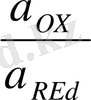
E
 - редокс м жұптың нормальды потенциалы, В
- редокс м жұптың нормальды потенциалы, В
n - реакцияға қатысатын
 Equation. 3 электрондар саны.
Equation. 3 электрондар саны.
 ,
,
 - тотықтырғыш пен тотықыздандырғыштың активтілігі, моль/л.
- тотықтырғыш пен тотықыздандырғыштың активтілігі, моль/л.
[OX] , [Red] - тотықтырғыш пен тотықыздандырғыштың концентрациясы, моль / л.
Тотығу - тотықсыздану потенциялын жалпы концентрация арқылы өрнектеуге де болады, себебі a = 1c
E = E
 +
+
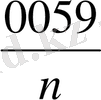 lg
lg
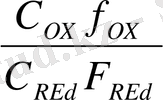 = E
= E
 +
+
 lg
lg
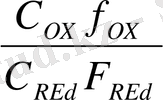
Ерітіндінің иондық күші тұтақты болған кезде
E

 +
+
 Equation. 3 lg
Equation. 3 lg
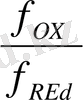 Equation. 3 =
Equation. 3 =

Тұрақты шама болады, оны реалдық стандарты потенциал деп атайды, сонда жүйенің тотығу тотықсыздану потенциалы:
E = E
 +
+
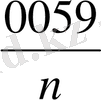 lg [
lg [
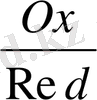 ]
]
Жуықтау септеулерде E
 орнына E
орнына E
 алуға болады. Сонымен Нернст теңдеуі Е тотыққан және тотықсызданған трлерінің концентрациясына тәуелділігін көретед.
алуға болады. Сонымен Нернст теңдеуі Е тотыққан және тотықсызданған трлерінің концентрациясына тәуелділігін көретед.
§2. Тотығу - тотқсыздану реакциясының жүру бағыты
Тотығу - тотықсыздану реакциясының ағыты электр қозғаушы күшінің таңбасымен анықталады:
Э. Қ. Қ =
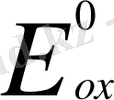 -
-
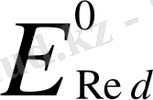 ;
;
Егерде ЭҚҚ > 0, ұл жағдайда тура реакция жүреді, ал Э. Қ. Қ <0 онда кері реакция жүреді. Мысалы:
Cu
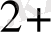 + Fe
+ Fe
 Fe
Fe
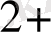 + Cu
+ Cu

E

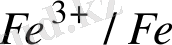 = - 0, 44B E
= - 0, 44B E

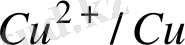 = 0, 34B
= 0, 34B
Э. Қ. Қ. = / +0, 34/ - /0, 44/ = 0, 78 В, Э. Қ. Қ >0, яғни тура реакция жүреді.
Э. Қ. Қ. неғурлым жоғары болса, соғурлым реакцияның жылдамдығы жоғары.
§3. Тотығу - тоықсыздану реакциясына түрлі жағдайлардың әсері
1) тотығу - тотықсыздану потенциалынп иондардың тотыққан және тотықсызданған түрлерінің концентрацияларының әсері.
Нернст теңдеуі тотығу
-
тотықсыздану потенциалының редокс жұбының концентрациясына тәуелді екендігін көрсетеді, сондықтан [Red] және [OX] концентрацияларын өзгертіп, жүйенің реалды потециалының шамасын өзгертуге болады. Мысалы, Fe
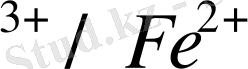 жүйенің потенциалы:
жүйенің потенциалы:
E = E
 + 0, 059 lg
+ 0, 059 lg
 =0, 77 + 0, 059 lg
=0, 77 + 0, 059 lg

[Fe
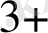 ] = 0, 5 моль, ал [Fe
] = 0, 5 моль, ал [Fe
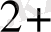 ] = 0, 005 м жұбының реалды потнциалы:
] = 0, 005 м жұбының реалды потнциалы:
E = 0, 77 + 0, 059 lg
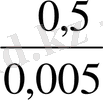 Equation. 3 = 0, 77 + 0, 59 = 0, 829 болады.
Equation. 3 = 0, 77 + 0, 59 = 0, 829 болады.
Егер [Fe
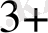 ] = 00, 5 моль/л, [Fe
] = 00, 5 моль/л, [Fe
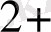 ] =5 моль/л болса, онда:
] =5 моль/л болса, онда:
E = 0, 77 + 0, 059 lg
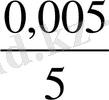 = 0, 77 + 0, 59 * (-3) = 0, 77 - 0, 177 = 0, 593 (В)
= 0, 77 + 0, 59 * (-3) = 0, 77 - 0, 177 = 0, 593 (В)
Яғни иондардың тотыққан және тотықсызданған түрлерінің конйентрацияларын өзгертіп жүйенің реалды потенциалының шамасын өзгертуге болады.
2) . Ерітіндінің ионық күшінің әсері.
Ерітіндінің иондық күшінің өзгеруі иондардың активтік коефициенттерін өзгертеды, ол реалды стандартты потенциалдың өзгеруіне әкеліп соғады. Мысалы, Ce
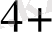 /Ce
/Ce
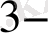 Equation. 3 редокс жұбының реалды стандартты потенциалы мына теңдеумен анықталады:
Equation. 3 редокс жұбының реалды стандартты потенциалы мына теңдеумен анықталады:
E
 = E
= E
 +0, 059 lg
+0, 059 lg
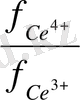 = 1, 77 + 0, 059 lg
= 1, 77 + 0, 059 lg
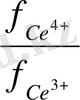
ерітіндінің иондық күші
 = 0. 1 тең болғанда
= 0. 1 тең болғанда
f
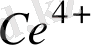 = 0, 065 f
= 0, 065 f
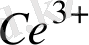 = 0, 18 сонда
= 0, 18 сонда
E
 = 1, 77+0, 059 lg
= 1, 77+0, 059 lg
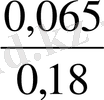 = 1, 77+ 0, 059 (-0, 44) = 1, 744(в)
= 1, 77+ 0, 059 (-0, 44) = 1, 744(в)
Ерітіндінің иондық күші
 = 0. 001 тең болғанда
= 0. 001 тең болғанда

E
 = 1, 77 + 0, 059 lg
= 1, 77 + 0, 059 lg
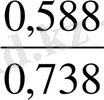 = 1, 77 + 0, 059 (-0, 099) = 1, 77 - 0, 006 = 1, 764(В)
= 1, 77 + 0, 059 (-0, 099) = 1, 77 - 0, 006 = 1, 764(В)
Сонымен ерітіндінің иондық күші өзгергенге реалд стандартты потенциал көп өзгермейді.
3 . Тотығу ө тотықсыздану потенциалына ерітіндінің рН - ының әсері.
Ерітіндінің рН -ының мәні көбіне оттекті қосылыстардың тотығу - тотықсыздану Е шамасына әсер етеді. Мысалы: мына тотығу - тотықсыздану жартылай реакцияны қарастырсақ:
Mn
 + 4H
+ 4H
 O
O
 MnO
MnO
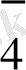 + 8H
+ 8H
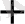

Оның тотығу - тотықсыздану потенциаы мына теңдеумен анықталады:
E = E
 +
+
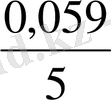 lg
lg
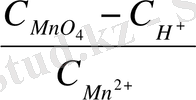 = E
= E
 +
+
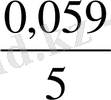 ª lg
ª lg
 +
+
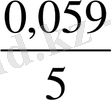 lg
lg
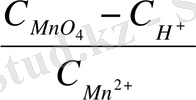
Немесе E = E
 -
-
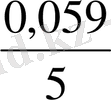 8pH +
8pH +
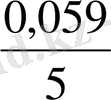 lg
lg
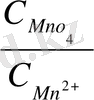
Яғни бұл жүценің тотығу - тотықсыздану потенциалы ерітіндінің рН- ына тәуелді.
Оны дұрыс түсіну үшін мысал ретінде мына реакцияны қарастыруға болады:
 Na
Na
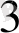 AsO
AsO
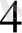 + 2 KI +2HCl = Na
+ 2 KI +2HCl = Na
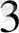 AsO
AsO
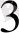 + J
+ J
 + 2KCl + H
+ 2KCl + H
 O
O
C
 = C
= C
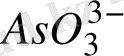 = C
= C
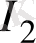 =C
=C
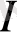
 жағдайды қарастырамыз.
жағдайды қарастырамыз.
Бұл жүйеде оттекті қосылысқа AsO
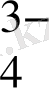 жатады. Оның жартылай реакциасы мына теңдеумен беріледі:
жатады. Оның жартылай реакциасы мына теңдеумен беріледі:
AsO
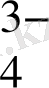 + 2H
+ 2H
 As O
As O
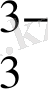 + H
+ H
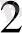 O
O
E = E
 +
+
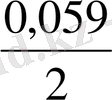 lg
lg
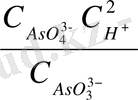 = E
= E
 +
+
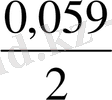 2 lg
2 lg
 C
C
 +
+
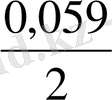 = E
= E
 - 0, 059 pH +
- 0, 059 pH +
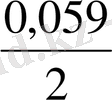 lg
lg
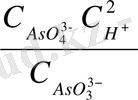
Яғни рН - ына тәуелді, C
 = C
= C
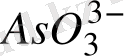 тең болғанда E = E
тең болғанда E = E
 - 0, 059 pH тең болады.
- 0, 059 pH тең болады.
I/. Енді C
 = I моль/л pH = 0 C
= I моль/л pH = 0 C
 = C
= C
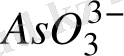
E = E
 - 0, 059 pH + lg
- 0, 059 pH + lg
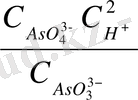 = E
= E
 = 0, 6 В
= 0, 6 В
Осы тотығу тотықсыздану реакциясының бағытын анықтаса, онда
Э. Қ. Қ. = E
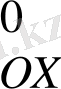 - E
- E
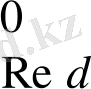 = 0, 6 - 0, 54 =0, 06 В.
= 0, 6 - 0, 54 =0, 06 В.
Э. Қ. Қ >0. Қышқыл ортада

 тотығу реакциасы жүред
тотығу реакциасы жүред
 II. Ал енді C
II. Ал енді C
 =
=
 моль/л, pH = 9 C
моль/л, pH = 9 C
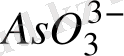 = C
= C

E = 06 - 0, 059 *9 +
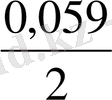
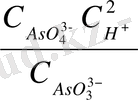 = 0, 08 В
= 0, 08 В
Э. Қ. Қ = E
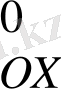 - E
- E
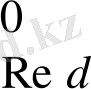 = 0, 08 - 0, 54 = -0, 46 Э. Қ. Қ <0
= 0, 08 - 0, 54 = -0, 46 Э. Қ. Қ <0
Кері реакция жүреді, яғни дербес
 , AsO
, AsO
 тотықтырады. Сонымен:
тотықтырады. Сонымен:
II/ ерітіндінің рн - тотығу - тотықсыздану Е өзгереді.
III/ реакцияның бағытында да өзгере алады.
§4. Комплексті қосылыстардың түзу процесінің әсері
Тотығу - тотықсыздану процесстері жүрген кезде комплексті қосылыстпр түзілу реакциялары жүруі мүмкін. Бұл процестер де потенциалдық амасына әсер етеді. Мысал ретінде:
Ag
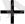 / Ag жүйені қарастыруға болады:
/ Ag жүйені қарастыруға болады:
Ag
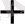 + e
+ e
 Ag
Ag

Бұл жүйенің потенциалы Нернст теңдеуімен анықталады:
E = E
 + 0, 059 lg [Ag
+ 0, 059 lg [Ag
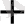 ]
]
[Ag
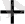 ] = I моль/л тең болған кезде E = E
] = I моль/л тең болған кезде E = E
 = 0, 8В
= 0, 8В
Енді осы жүйеге KCN ерітіндісін қосқан кезде мына реакция бойынша комплекс түзіледі:
Ag
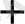 + 2 CN
+ 2 CN

 [ Ag(СN)
[ Ag(СN)
 ]
]

Ag концентрацмясы осы комплекстің тұрақтылық ( немесе тұрақсыздық) константасымен анықталады.
 =
=
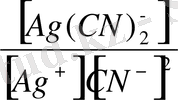
Яғни [Ag
 ] =
] =
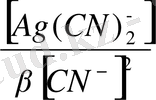
Осы шаманы Нернст теңдуеіне қойып мына теңдеуді алуға болады:
E = E
 + 0, 059 lg
+ 0, 059 lg
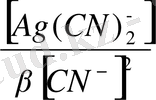 = E
= E
 + 0, 059 lg
+ 0, 059 lg
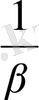 + 0, 059 lg
+ 0, 059 lg
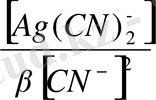
[Ag(CN)
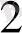
 ] = [CN
] = [CN
 ] = 1моль/ тең деп қарастырып және
] = 1моль/ тең деп қарастырып және
 =
=
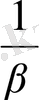 = 1, 410
= 1, 410
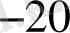 pK
pK
 = 19, 85
= 19, 85
Осы мәндерді тотығу - тотықсыздану потенциалының теңдеуіне қойса:
E = E
 + 0, 059 lg 14 *10
+ 0, 059 lg 14 *10
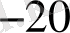 + 0, 059 lg
+ 0, 059 lg
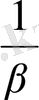
E = 08 + 0, 059/- 19, 85/ = - 0, 37 /В/
Яғни оң мәнңнен теріс мәнге айналады, бұл тотыгу - тотықсыздану потенциалының
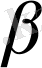 тәуелділігін көрсетеді.
тәуелділігін көрсетеді.
§5. Тотығу - тотықсыздану тепе -тепеңдігінің константасы
Кез - келген тотығу - тотықсыздану ракциялары белгілі тепе - теңдік орнағанша жүреді. Тотығу м тотықсыздану реакциясының бағытын тепе - теңдік константасы сипаттайды.
Мысал ретінде мына реакцияны қарастыруға болады.
Ce
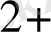 +
+
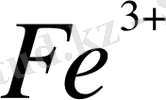

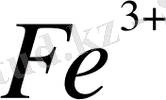 +
+

Осы тепе - теңдікке әркетесуші массалар заңын пайдаланып тепе - теңдік константасын жазуға болады:
K
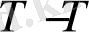 =
=
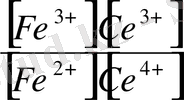
Тотығу- тотықсыздану реакцияның жартылай реакцияларын былай жазуға болады.
Ce
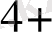 + 1e
+ 1e
 Equation. 3 Ce
Equation. 3 Ce
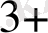
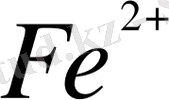 Equation. 3 - 1e
Equation. 3 - 1e
 Equation. 3
Equation. 3
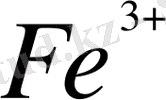
Бұл жартылай реакциялар тотығу -тотықсыздану потенциалымен сипатталады:
E
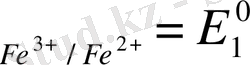 Equation. 3 + 0, 059 lg
Equation. 3 + 0, 059 lg
 Equation. 3
Equation. 3
E
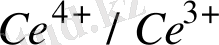 Equation. 3 = E
Equation. 3 = E
 Equation. 3 +lg
Equation. 3 +lg
 Equation. 3
Equation. 3
Жүйеде тепе - теңдік орналған кезде екі жартылай реакциялардың тепе - теңдік потенциалдары бір - біріне тең болады:
 + 0, 950 lg
+ 0, 950 lg
 =
=
 + 0, 059 lg
+ 0, 059 lg

 -
-
 = 0, 059 - lg
= 0, 059 - lg
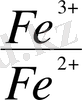
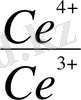
 -
-
 = 0, 059 lg
= 0, 059 lg
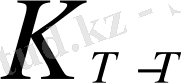
lg
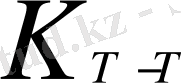 =
=
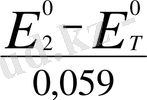 =
=
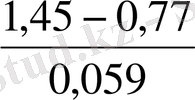 = 11, 53 lgK = 11, 53
= 11, 53 lgK = 11, 53
K =
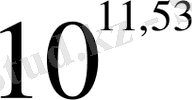 Equation. 3 немесе K = 3, 39 *10
Equation. 3 немесе K = 3, 39 *10
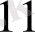 Equation. 3
Equation. 3
Жалпы күйде:
K=
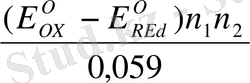 Equation. 3
Equation. 3
Мұнда:
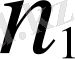 ,
,

 Equation. 3 тотықтырғыштың және тотықсыздандарғыштың жұптарында тотығу
Equation. 3 тотықтырғыштың және тотықсыздандарғыштың жұптарында тотығу
 Equation. 3 тотықсыздану реакцияларына қатысатын электрондар саны.
Equation. 3 тотықсыздану реакцияларына қатысатын электрондар саны.
Тотығу
 тотықсыздану тнпе
тотықсыздану тнпе
 теңдік константасынан мынадай қорытынды жасауға болады. Егер константаның шамасы бірден жоғары болса, онда тура реакция жүреді, константа шамасы бірден төмен болса, онда кері реакция жүреді.
теңдік константасынан мынадай қорытынды жасауға болады. Егер константаның шамасы бірден жоғары болса, онда тура реакция жүреді, константа шамасы бірден төмен болса, онда кері реакция жүреді.
Тотығу
 тотықсыздану константасы реакцияның толық жүруін сипаттайды, егерде К >10
тотықсыздану константасы реакцияның толық жүруін сипаттайды, егерде К >10
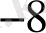 болса, онда химиялық реакция 99, 00 проценті жүреді.
болса, онда химиялық реакция 99, 00 проценті жүреді.
§6 Тотығу
 тотықсыздану реакцияларые сапалық анализде пайдалану
тотықсыздану реакцияларые сапалық анализде пайдалану
- Тотығутотықсыздану реакцияларын көбінесе ұқсастру үшінпайдалашады. Мыалы, Mnкатионын перманганатқа дейін тотықтырып, оның таңқурай тсіене анықтыйды.
Mn
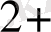 + 4 H
+ 4 H
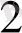 O
O
 HMnO
HMnO
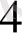 + 2H
+ 2H
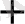
2.
Тотығу
 тотықсыздану реакцияларын түрлі тұнбаларды еріту үшін қолданады. Мысалы:
тотықсыздану реакцияларын түрлі тұнбаларды еріту үшін қолданады. Мысалы:
3 CuS + 8H NO
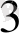 = 3 Cu(NO
= 3 Cu(NO
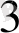 )
)
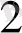 + 3S
+ 3S
 +2 NO+ 4H
+2 NO+ 4H
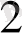 O
O
3.
Катиондарды бір
 бірінен бөлу үшін қолданылады. Мысалы, хром катионын темір, марганец тағы басқа катиондарынан бөлу үшін сілтілік ортада сутек пероксидімен тотықтырады.
бірінен бөлу үшін қолданылады. Мысалы, хром катионын темір, марганец тағы басқа катиондарынан бөлу үшін сілтілік ортада сутек пероксидімен тотықтырады.
Cr

 + 2OH
+ 2OH
 - 3
- 3
 CrO
CrO
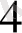
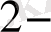 +2H
+2H
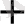
4. Электрлігі оң металды электрлігі терісметалмен тотықсыдандыру реакциялары катиондарды анықтау, концентрлеу, бөлу үшін жиі пайдаланады. Мысалы:
Sb
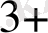 + Fe
+ Fe
 Sb
Sb
 + Fe
+ Fe
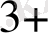
5. Зерттелетін қоспада тотықтырғыштар мен болжау үшін қолданады.
§7. Тотығу -тотықсыздану реакцияларын қарастыру
Тотығу
 тотықсыздану реакцияларының теңдеуін жазу үшін алдымен реакцияға қатысатын қосылыстардың және реакция өнімдерінің формулаларын білу керек. Реакцияның жүру бағытын тотықтырғыш
тотықсыздану реакцияларының теңдеуін жазу үшін алдымен реакцияға қатысатын қосылыстардың және реакция өнімдерінің формулаларын білу керек. Реакцияның жүру бағытын тотықтырғыш
 тотықсыздандырғыш жұптарының стандартты потенциалдарының шамалары бойынша болжауға болады.
тотықсыздандырғыш жұптарының стандартты потенциалдарының шамалары бойынша болжауға болады.
Аналитикалық химияда иондармен жұмыс істеу тура келетін болғандықтан коефициенттерді анықтау үшін ион
 электронды тәсіл пайдаланады. Алдымен берілген реакцияның жалпы иондық схемасын құрастырады, одан соң тотықтырғышты және тотықсыздандырғышт анықтайды. Жартылай тотығу
электронды тәсіл пайдаланады. Алдымен берілген реакцияның жалпы иондық схемасын құрастырады, одан соң тотықтырғышты және тотықсыздандырғышт анықтайды. Жартылай тотығу
 тотықсыздану реакцияларын, суммалық реакцияны жазады. Мысалы:
тотықсыздану реакцияларын, суммалық реакцияны жазады. Мысалы:
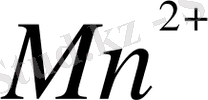 натрий висмутаымен қышқыдық ортада тотығу реакциясын жазуға болады:
натрий висмутаымен қышқыдық ортада тотығу реакциясын жазуға болады:
Шешуі:
1. Реакцияның жалпы иондық схемасын жазу:
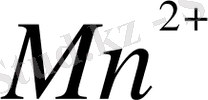 + ВiO
+ ВiO
 + H
+ H
 MnO
MnO
 +Вi
+Вi
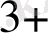
 + H
+ H
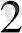 O
O
- ВiOиондары тотықтырғыш, ол Вiкатионына дейін тотықсызданады:
ВiO
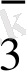 + 6 H
+ 6 H
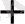 + 2
+ 2
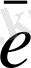
 Вi
Вi
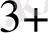 + 3 H
+ 3 H
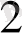 O (тотықсыздану)
O (тотықсыздану)
Бұл жартырай тотықсыздану реакцияның коефициенттерін анықтау үшін В
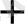 , О
, О
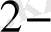 және зарядтар санын теңестіру үшін керек. Схемадан H
және зарядтар санын теңестіру үшін керек. Схемадан H
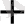 иондары оттек иондарымен су малекуласына байланысатындығын көруге болады. Сонымен, ВiO
иондары оттек иондарымен су малекуласына байланысатындығын көруге болады. Сонымен, ВiO
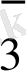 құрамына кіретін 3ион оттегі бар, оныбайланыстырып су алу үшін 6 H
құрамына кіретін 3ион оттегі бар, оныбайланыстырып су алу үшін 6 H
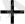 сутегі қажет, нәтижесінде үш малекула H
сутегі қажет, нәтижесінде үш малекула H
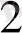 O түзіледі. Аяқталған теңдеу алу үшін заряд қосындысын есептеу керек. Сол жақта заряд қосындысы: -1, +6, +5, ал оң жақта + 3. Сондықтан жартылай реакцияның сол жағына екі электрон қосу керек. Сонда алында көрсетілген теңдеу шығады:
O түзіледі. Аяқталған теңдеу алу үшін заряд қосындысын есептеу керек. Сол жақта заряд қосындысы: -1, +6, +5, ал оң жақта + 3. Сондықтан жартылай реакцияның сол жағына екі электрон қосу керек. Сонда алында көрсетілген теңдеу шығады:
3.
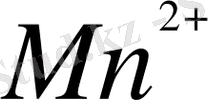 иондары тогтықсыздандырғыш, олар перманганатқа дейін тотығады:
иондары тогтықсыздандырғыш, олар перманганатқа дейін тотығады:
Mn
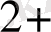 +4 H
+4 H
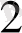 O - 5
O - 5
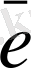
 HMnO
HMnO
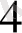 + 7 H
+ 7 H
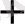 (тотығу)
(тотығу)
Бұл жағдайда тотығу рекциясының коефициенттерін анықтау үшін H
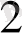 O және заряд санын теңестіру керек. Оны алдындағыдай теңестіреді.
O және заряд санын теңестіру керек. Оны алдындағыдай теңестіреді.
4. Осы жартылай реакциялардан ракцияның толық ион электрондық теңдеуін жазуға болады.
ВiO
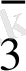 + 6 H
+ 6 H
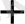 + 2
+ 2
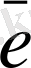
 Вi
Вi
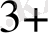 + 3 H
+ 3 H
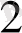 O 5
O 5
Mn
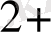 +4 H
+4 H
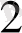 O - 5
O - 5
 HMnO
HMnO
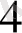 + 7 H
+ 7 H
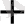 2
2
5 ВiO
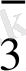 + 2 Mn
+ 2 Mn
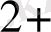 +16 H
+16 H
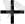
 5 Вi
5 Вi
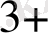 + 2 HMnO
+ 2 HMnO
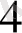 + 7 H
+ 7 H
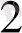 O
O
Малекулалық күйде.
5Na ВiO
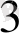 + 7Mn(NO
+ 7Mn(NO
 )
)
 + 16HNO
+ 16HNO
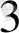 = 5Вi (NO
= 5Вi (NO
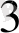 )
)
 +2 HMnO
+2 HMnO
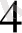 +5Na NO
+5Na NO
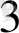 +7
+7
H
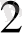 O
O
§8 Редокс жұбының реалды потенциалын есептеу
Есеп.
10 мл 0, 1 моль/л К MnO
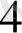 ерітіндісінен 15 мл 0, 1 моль/л MnO
ерітіндісінен 15 мл 0, 1 моль/л MnO
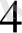 ерітіндісі араластырылған. Берілен редокс жүйенің реалды потенциалын есептеңіздер (ерітіндінің рН = 1 тең)
ерітіндісі араластырылған. Берілен редокс жүйенің реалды потенциалын есептеңіздер (ерітіндінің рН = 1 тең)
Шешуі.
I. Тотығу процесінің жартылай реакциясын жазу керек:
Mn
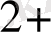 +4 H
+4 H
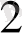 O - 5
O - 5
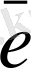
 MnO
MnO
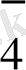 +8 H
+8 H
II. Ерітінділер араластырылғаннан кейін тотыққан және тотықсызданған формаларының конйентрациясын есептеу:
C(KMnO
 Equation. 3 ) =
Equation. 3 ) =
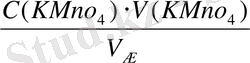 Equation. 3 =
Equation. 3 =
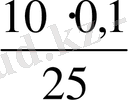 Equation. 3 = 0, 04 моль/л
Equation. 3 = 0, 04 моль/л
С(MnO
 Equation. 3 ) = C(Mn
Equation. 3 ) = C(Mn
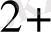 Equation. 3 ) =
Equation. 3 ) =
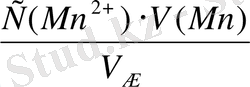 =
=
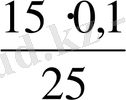 Equation. 3 =0, 06 моль/л
Equation. 3 =0, 06 моль/л
3. Нернст теңдеуін пайдаланып жүйенің реалды потенциалынжазу:
E
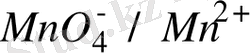 = E
= E
 +
+
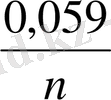 lg
lg
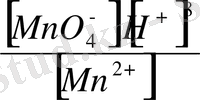
4. есеп шарты бойынша берілген мәліметтерді Нернст теңдеуіне қойып, реалды потенциалдың шамасын анықтау:
E
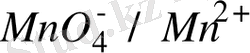 Equation. 3 = + 1, 51 В, рН=1, [H
Equation. 3 = + 1, 51 В, рН=1, [H
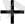 ] = 10
] = 10
 Equation. 3 моль/л, n = 5
Equation. 3 моль/л, n = 5
Мұнда:
Е = 1, 51 +
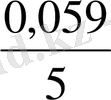 Equation. 3 lg
Equation. 3 lg
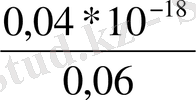 Equation. 3 = 1, 51 +
Equation. 3 = 1, 51 +
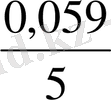 Equation. 3 /-8, 17/= 1, 51- 0, 096= 1, 414 (В)
Equation. 3 /-8, 17/= 1, 51- 0, 096= 1, 414 (В)
§9. Тотығу
 тотықсыздану бағытын анықтау
тотықсыздану бағытын анықтау
Есеп.
Стандартты жағдайда темір/III/ иондарымен иодид және бромид
 иондарын тотықтыруға бола ма? /Тотығу
иондарын тотықтыруға бола ма? /Тотығу
 тотықсыздану реакциясы стандартты жағдада және тура реакция жүредә деп есептеу қажет/
тотықсыздану реакциясы стандартты жағдада және тура реакция жүредә деп есептеу қажет/
Шешуі:
I.
Алдымен тотығу
 тотықсыздану реакцияларын иондық күйде жазу:
тотықсыздану реакцияларын иондық күйде жазу:
2
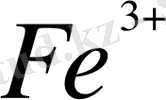 +2
+2

 I
I
 +
+
 2
2
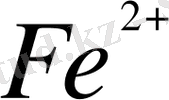
2 . Анықтыһамалардан жұптардың стандартты тотығу -тотықсыздану потенциалдарының шамасын қарап алу керек:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz