Термохимия және калориметриялық әдістер: реакциялардың жылу эффектілері мен еру жылуын өлшеу


Термохимияның негізгі мақсаты
Термохимия - химиялық динамиканың бөлімі, ол химмиялық реакциялардың жылу эффектісін және реакцияның жүру барысындағы элементтердің физико-химиялық параметрлеріне тәуелділігін қарастырады. Сонымен қатар термохимия мақсатына жылудың фазалық өтулер, ерулер, қосылу, тағы басқа процестер, жылу сыйымдылықты меңгеру және заттардың энтальпиясы мен энтропиясы кіреді. Термохимияның негізгі тәсілі - калориметрия болып табылады. Кей жағдайларда калориметриялық емес те тәсілдер (тепе-теңдік константасын өлшеу нәтижелерінен жылу эффектілерін санау) қолданылады, алайда бұл жағдайларда нәтижелер онша дәл болмайды.
1840 жылы Гесс атты химик тамаша заң ашты, кейіннен осы заңға оның аты беріліп, бұл заң реакцияның жылу эффектісін, заттардың түзілу жылулығын немесе олардың жануын есептеуге мүмкіндік береді. Сонымен қатар тузілуі қиын, ал кейде мүлде мүмкін емес реакцияның жылу эффектісін табуға жол ашты. Есептеуге қажетті стандартты жылу түзілулер ∆Н түз о фундаменталды термохимиялық анықтамаларда жиылған.
ХІХ ғасылдың ортасында Томсон және Бертло ой тұжырымдады, олардың айтуы бойынша, энергиясыз болып жатқын химиялық реакциялар максималды жылу бөлінген жаққа ағады. Олармен және олардың шәкірттерімен термохимияның негізгі эксперименталдық тәсілдері жасалды және көптеген реакциялардың жылу эффектілері өлшенді.
 Жалпы алғанда Бертло-Томсеннің мәлімдемелері шындыққа сай болмады, бірақ термохимияда белгілі бір шартта химиялық реакциялардың ағу мүмкіндігін зерттеу маңызы сақталды. Сонымен, Н-ТS=-RTlnK
p
- термодинамиканың бірінші және екінші бастамасының жалпы теңдеуі болып табылып (Н - энтальпия өзгеруі, S - химиялық реакция кезіндегі энтропияның өзгеруі, Т - температура, R - газ тұрақтысы), кез-келген реакцияның тепе-теңдік констартасын К
р
жылулық өлшемдер арқылы есептеуге мүмкіндік береді.
Жалпы алғанда Бертло-Томсеннің мәлімдемелері шындыққа сай болмады, бірақ термохимияда белгілі бір шартта химиялық реакциялардың ағу мүмкіндігін зерттеу маңызы сақталды. Сонымен, Н-ТS=-RTlnK
p
- термодинамиканың бірінші және екінші бастамасының жалпы теңдеуі болып табылып (Н - энтальпия өзгеруі, S - химиялық реакция кезіндегі энтропияның өзгеруі, Т - температура, R - газ тұрақтысы), кез-келген реакцияның тепе-теңдік констартасын К
р
жылулық өлшемдер арқылы есептеуге мүмкіндік береді.
Энтальпия өзгеруін (жылу эффект) лабораторияда оңай есептеуге болады. Мұны көбіне реакция шекарасын қоршап жасайды: бұл кезде энергия алмасу жүзеге асады. Егер реакция экзотермиялық болса, онда су қызады, ал егер эндотермиялық болса, онда суиды. Егер судың
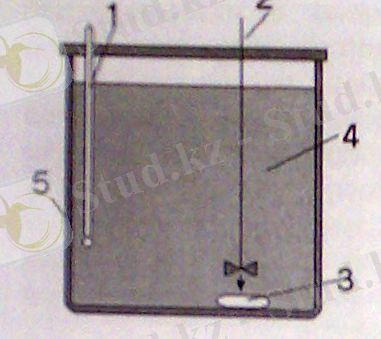 температура өзгеруін өлшесе және су массасы мен оның меншікті жылу сыйымдылығы белгілі болса, бұл жағдайдахимиялық реакция кезінде жұтқан немесе бөліп шығарған энергия мөлшерін табуға болады.
температура өзгеруін өлшесе және су массасы мен оның меншікті жылу сыйымдылығы белгілі болса, бұл жағдайдахимиялық реакция кезінде жұтқан немесе бөліп шығарған энергия мөлшерін табуға болады.
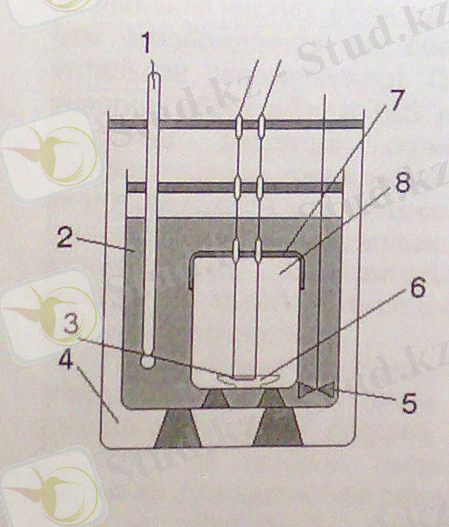
Басқа тәсілдер мен өлшеулерге қарағанда 1-суретте көрсетілген қондырғы көмегімен Н-тың нақты шамасын алуға болады. Бұл қондырғы - калориметрлік бомба деп аталады және заттардың жану жылуын өлшеуге арналған.
Кейбір реакциялармен Н өлшеуге болады. Мысал ретінде метанның жану реакциясын алуға болады. Бұл реакцияның Н қарапайым асүйлік жабдық пен газ плитасын қолданып табуға болады.
Ал басқа реакцияларға мұны орындау қиынға түседі. Мысалға, СаСО 3 түзілу (еру) реакциясына 800 0 С-дан артық температура қажет. Бұл жағдайда берілген энергияны табу үшін суды қолдану қиынға түседі. бұл жағдайларда энтальпияның өзгеруін табу жанама жүріп, энтальпиялық циклдер қолданылуымен жүзеге асады.
Жоғарыда айтылғандай, калориметрия реакцияның жылу эффектісін анықтауға, соның ішінде ол тұздардың еру жылуын немесе басқа қосылыстардың суда, не басқа еріткіштерде еруін анықтау үшін пайдаланылады. Бұл термохимияның ең қызықты мақсаты болып табылады, өйткені тұз еріген кездегі бөлінген жылу заттарды қыздыру немесе суыту үшін пайдаланылады.
Реакцияның жылу эффектісін немен белгілейді?
Айта келе, реакцияның жылу эффектісінің өэгеруі қалай анықталады.
Ерітінділердің түзілу процесі молекулярлы деңгейде келесі түрде байқауға болады. Әрбір таза заттың молекулалар тобы алдымен мына түрде орналасуы керек: молекулалар бір-бірінен ерітіндінің соңғы концентрациясына сәйкестендіріліп алшақтатылуы қажет (мысалы, метанолдың судағы ерітіндісінде метанол молекулалары бір-бірінен өте алшақ орналасқан, ал су молекулалары таза судағыдай жақын орналасады) . Келесіде алшақтатылған молекулалар жүйесі соңғы тығыздықты ерітінді түзілетіндей жақындатылуы керек. Біріншіден бөлшектер бөлектенуі үшін индивидуалды заттар энергия жұтуы қажет; алайда «алшақтатылған» жүйелер бөлшектері жақындап, ерітінді түзген кезде энергия бөлінеді. Бөлшектердің орын ауыстыруы жүйенің статистикалық «кездейсоқтығын» ұлғайтады және энтропияның ұлғаюымен қатар жүреді.
Еру процесіне Гиббс энергиясының кері әсермен өзіндік ағу нәтижесінде еріткіш бөлшектерінің және ерітіндінің араласуына тән қасиет.
Ерітінділердің түзілуінің негізгі айырмашылықтары энергияның бөлінуі мен жұтылуында және бөлшекаралық орындардың өзгеруіне байланысты болып келеді. ∆Н өлшемдері еру процесінде бір-бірінен ерекшеленеді. Бөлшектердің айырылуына кеткен энергия көлемінен жылжуға кеткен энергия көлемі артық болып келген жағдайда, ерітінділердің түзілуі - экзотермиялық процесс болып есептеледі. Егер де бөлшектердің орын ауыстыруына қарағанда айырылуына көбірек энергия қоры жұмсалса, онда бұл еру процесі - эндотермиялық процесс (энтальпия өзгерісі болады) болып есептеледі. Айталық, энтальпиялық функция Гиббс энергиясына G=H-TS өзгеріс әкелсе, онда арнайы эндотермиялық процесс үшін шекті еруді күтсе болады; бұл шынында да термодинамикалық өлшемдермен расталады. Бірақ молекулярлы деңгейде эндотермияның жүрісінің еру процесінде әртектес бөлшектермен салыстырғанда таза сұйықтықтағы біртектес бөлшектер бір-бірін күштірек тартады делінген. Осыдан келе, әртектес бөлшектердің жылжуына кеткен энергияға қарағанда біртектес бөлшектердің бөлінуіне көбірек энергия жұмсалуы қажет.
Жоғарыда келтірілген мысалдар жобалап алынған, бірақ шындығында ерітінділердің көрсететін қасиеттері тым күрделірек. Мысалы, ақырғы ерітінді кездейсоқ реттелген бөлшектерден тұратын жүйе, мұны қарастырғанда ерітіндіде реттелген структура болуының мүмкін екенін аңғармаған. Егер ерітіндінің пайда болуына реттелген структура бар болуы әсер етсе, онда энтропия өзгеруінің мәні анализденбейтін аз оң шама.
Ерітіндінің түзілуі химиялық компоненттерінің потенциалдары ерітіндіге өту кезінде азайғанға дейін жүреді. Бөлшектердің тартылу есебінен энергиялық эффектілер және бөлшектердің орын ауыстыру нәтижесінде, еру процесінде химиялық потенциалының төмендеуімен түсіндіріледі. Егер де біртекті бөлшектердің тартылу энергиясы әртекті бөлшектерге қарағанда көбірек болса, онда химиялық потенциалдың төмендеуі өте сұйытылған ерітіндіге ғана көп, ал содан соң ол білінбей кетеді. Сол кезде екі заттың ортақ жоғары немесе төмен ерігіштікке тәуелділігін айтса болады; бұл үшін тек қана біртекті бөлшектердің тартылу деңгейін білу қажет.
Булану жылуы өте ыңғайлы, әрі жеткілікті тартылу энергиясы болып қызмет етеді, алайда басқа факторларды естен шығанмаған жөн, мысалы: молекула өлшемдері және бөлшектердің спецификалық әсерлесуі. Жалпы алғанда, екі компоненттің еруі шекті болады, егер екеуінің біреуінде булану жылуы көп үлкен мінге ие болса.
Екі ерітіндінің араласуында ерудің бүкіл, мүмкін болғанынша, градиялары байқалады: бір-бірімен мүлде араласпауынан (мысалы, сынап және су) бастап, біртекті ерітінді түзілгенге дейін кез-келген жағдайда араласуы (мысалы, этанол және су) . Еруі шектеулі қоспалар аралық орын алады. Сұйықтық қоспалар А және В (мысалы, анилин және су) шайқағаннан кейін екі аралыққа бөлінеді: қаныққан ерітінді А В-да және қанықпаған ерітінді В А-да. Алайда А және В компоненттері біртекті қоспа түзілуі үшін белгілі температура және құрам облыстары болуы мүмкін.
Термохимиялық өлшеулер
Ерітінділердің қасиеттері әр түрлі болғандықтан, олар термодинамикалық қасиеттеріне қарай жіктеледі. Бұл көзқарастан идеал және идеал емес ерітінділерді бөледі. Көпшілік физико-химиялық өлшеулер үшін процеске түсетін заттың жылусыйымдылығын, сонымен қатар еру процесінің жылу эффектілерін, фазалық ауысуын және химиялық реакцияларды білу қажет. Бөлме температурасына (20-50 0 С) жуық температура кезінде калориметриялық әдіс кеңінен пайдаланылады.
Калориметриялық әдіс кезінде жылу эффектінің Q белгісі мен мөлшерін калориметр температурасын t өлшеу арқылы анықтайды:
Q=(∑m i c i ) t=c ω t
мұнда, m i - зерттелетін заттың массасы, калориметр және қасымша тетіктер (араластырғаш, ампула, термометр) ; c i - зеттелетін заттың меншікті жылу сыйымдылығы; c ω - калориметриялық жүйенің суммалық жылу сыйымдылығы.
1-теңдеу былай жазылуы мүмкін
Q=(K+m 1 c 1 ) t
мұнда, К - калориметр тұрақтысы, яғни жылуалмасуға қатысатын көмекші тетіктер мен калориметр бөлшектерінің жылу сыйымдылығы, Дж/К; с 1 - калориметр құрамының жылу сыйымдылығы; t - калориметр мен қоршаған орта арасындағы жылу алмасу жоқ кездегі процесс температурасының өзгеруі.
Изотермиялық қабаты (диатермиялық) бар калориметр ортамен жылу алмасуын аңғартып, температура өзгеруін ∆t есептеуге мүмкіндік береді.
Жылу сыйымдылық С жүйесін dQ/dT шығарушысы деп атайды. Газ бен сұйықтық жылу сыйымдылықтары температураға тәуелді, ал қатты заттардікі орта және жоғары температураларға тәуелді емес.
Біртекті дененің орташа жылу сыйымдылығын келтірілген жылудың температура көтерілуіне қатынасын айтады:
<C>=Q / (T 2 -T 1 ) =Q-T
Орташа жылу сыйымдылық <C> температуралар интервалына (Т 2 -Т 1 ) тәуелді. Нағыз және орташа жылу сыйымдылық арасындағы тәуелділік мына теңдікпен беріледі:
<C>=∫CdT / (T 2 -T 1 )
T ≤ 5 0 болған жағдайда жетілдірілген калориметр (дәлдік есептеуі 0, 005%) көмегімен нағыз және орташа жылу сыйымдылығын айыра алмаймыз. Сондықтан, калориметриялық температураның өзгеруін 2-3 0 болған жағдайда, оны нағыз деп санайды және (Т 2 -Т 1 ) /2 температураға жатқызады. Біртекті дененің жылу сыйымдылығы оның массасына тәуелді
С=cm немесе <C>=<c>m
мұнда, <c> - заттың меншікті жылу сыйымдылығы, m - зат массасы. Егер масса молярлы немесе атом массасына тең болса, онда жылу сыйымдылық молярлы немесе атомдықпен сәйкестендіріледі. Егер тәжірибе кезінде калориметриялық жүйеде қысым тұрақты болса, онда тұрақты қысым кезінде процестің жылу эффектісі Q p , ал жылу сыйымдылық C p болады. Термохимиялық өзгеру кезінде жылу бөлумен жүретін процестерге оң таңба қойылады. Жүйелік жылу кезінде энтальпиясы жоғалады. Осыдан Q p =-H шығады. Егер есептеулерде жылу эффект Q немесе q болып белгіленсе, бұл жағдайда термохимиялық таңба жүйесін қолдану керек.
Калориметриялық қондырғы
(диатермиялық калориметрия)
Калориметриялық қондырғылар ауа термостатынан және оған салынған калориметрден тұрады. Термостат шыны әйнекпен қоршалған қорап тәріздес және оның ішіне жылытқыш, вентилятор, термохимиялық және контакттық термометрлер орнатылған. Жылытқыш орнында аз жылу инерциясы бар электр шамы қолданылады. Қораптағы температура ±0, 002 0 дейін ұсталып тұрады.
Қораптағы ауа калориметрдің изотермиялық қабаты ретінде жүреді.
Калориметр калориметриялық ыдыстан (полиэтилендік стакан) тұрады. Қақпақтағы тесік арқылы араластырғыш, Бекман термометрі, электр қыздырғыш және зерттелетін зат бар ампула орналасады. Қораптағы жоғары-төмен қозғалатын жылжымалы үстел үстіне калориметр орналасады. Электр жылытқыш тоқ көзіне стабилизатор және трансформатор арқылы жалғасады. Винтелятор және араластырғыштың айналу жылдамдығын автотрансформатор арқылы реттеледі. Электр жылытқыш қуаты реостатпен реттеледі. Уақыт санау 30 с. сайын дыбыс шығарып отыратын дыбыстың сигнализатор көмегімен іске асады. Калориметрлік тәжірибеде процестің жылу тепе-теңдігі мына теңдік арқылы беріледі
Q=(∑ m i c i ) t’+q
мұнда, q - калориметриялық тәжірибе кезіндегі калориметрдің қоршаған ортамен жылу алмасуы.
Егер зерттеліп жатқан процесс және калориметрдегі температураны түзеу бір сәтте жүріп отырса, онда жылу алмасу 0-ге тең болады (q=0) . Іс жүзінде процесс жүруі және температураның түзелуіне уақыт керек, бұл уақытта калориметр кейбір белгілі мөлшерде жылуды q ортадан алады немесе береді. q мөлшерін есепке алмайды, бірақ калориметрдегі тәжірибені алған нәтижелерді қолданып, температураның өзгеруін t есептейтіндей қылып жасайды. Калориметриялық тәжірибе жылу тепе-теңдігіне жақын кезде, температураның білінбес айырымында бастау керек (0, 04 град/мин аспаса) . Бұл шартты қораптағы ауа температурасы 1-2 0 кіші болғандағы араластырғыш жұмыс істеп тұрғанда және калориметрлік температура орналастырғанда орындауға болады. Мұндай температура айырмашылығында жылу келу жылдамдығы ауадан берілетін жылуға тең болып, калориметрдегі жүйелік тепе-теңдігін сақтайды. Егер зерттеліп жатқан процесте жылу бөліне байқалса, онда бастапқы кезде калориметр температурасы көбеюі керек. Егер процесте жылу жұтылса, онда калориметр температурасы төмендеуі тиіс. Тұрақты температураның өзгеру жылдамдығын Бекман термометрі 30 с. сайын 10-12 санау жасайды. Калориметриялық тәжірибенің бастапқы периодында процестің жылу эффектісін анықтайды. Бекман термометрімен температураны үздіксіз сол уақыт аралығында өлшеп отырады. Жылуды жұту немесе шығару кезінде процесте температура күрт өзгереді. Бұл - калориметриялық тәжірибенің басты кезеңі. Басты кезең аяқталғаннан кейін температура тепе-теңдік жағдайға келеді және ол калориметриялық тәжірибенің соңғы кезегі, бұл кезде Бекман термометрімен 12-15 санау жасалады.
t есептеу
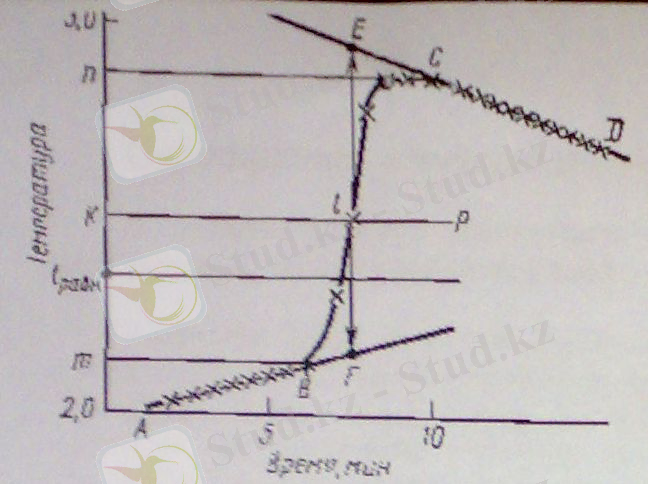 3-суретте дұрыс қойылған калориметриялық тәжірибе кезінде экзотермиялық эффекттің өзгеруінің температуралық қисығы көрсетілген. ∆t мөлшерін жылу алмасуды қосып, аналитикалық немесе графикалық тәсілмен есептеуге болады.
3-суретте дұрыс қойылған калориметриялық тәжірибе кезінде экзотермиялық эффекттің өзгеруінің температуралық қисығы көрсетілген. ∆t мөлшерін жылу алмасуды қосып, аналитикалық немесе графикалық тәсілмен есептеуге болады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz