Комплексті қосылыстар: координациялық теория, құрылым, байланыс және қасиеттер


КОМПЛЕКСТІ ҚОСЫЛЫСТАР
Валенттік жайындағы ілім химияға әбден орныққаннан кейін химиялық қосылыстардың барлығы қарапайым не атомдық қосылыстар және кдмплексті немесе молекулалық қосылыстар делініп екіге бөлінгейдей болды.
Біздің осы уақытқа дейін оқып келген қосылыстарымыздың басым көпшілігі элементтердің атомдары қосылысудан түзілген атомдық қосылыстар. Бірақ осымен қатар біз кейбір күрделі қосылыстармен де таныспыз, олар: кристаллогидраттар (Na 3 Н 2 О), аммиакаттар (СиSО 4 -4NН 3 ), ашудас (КА1(SО 4 ) 2 -•12Н 2 О), тиоарсенаттар (Nа 3 А$3 4 ), криолит (Sа 3 А1Ғ 6 ) , фторсиликаттар (Sа 2 5іҒ б ) (XIII тарау, § 8), кремний фтор-сутек қышқылы (Н 2 $іҒб) .
Қомплексті қосылыстар туралы ілімнің негізін жасаған Швейцария ғалымы Альфред Вернер (1893 жыл) . Вернердің пікірі бойынша қосылыстарды бірінші ретті (қарапайым) және жоғары ретті деп екі топқа бөлуге болады. Жоғары ретті қосылыстар бірінші ретті (қарапайым) қосылыстардың өзара бірігуі нәтижесінде түзіледі. Олардың кейбіреулері қатты күйінде де және еріген күйінде де түрақты болады, ал енді біреулері қатты күйінде тұрақты. Болғанымен, еріті діде құрам бөліктеріне ыдырап кетеді. Мысалы, № 2 SіF және СиSО 4 4NHз қатты күйінде тұрақты, ал А1 2 (SО 4 ) -К2S5О4-24Н 2 О қатты күйінде тұрақты, ерітінділ алюминий А1 3 + , калий К + Және сульфат SО 4 ~ иондарын ыдырайды. Мұндай қатті күйінде де және еріген күйінде де тұрақ ты болып. келетін жо ғары ретті қосылыстар комплексті қосы л ы с т а р деп аталады.
Комплексті қосылыспен танысу үшін мынадай мысал кел тірейік. НҒ мен SіҒ реакцияласқанда:кремний фторсутек қышқыль түзіледі. Мұндай химиялык қосылыстың түзілуін валенттікке сай химиялық байланыстың түрлерімен түсіндіре алмаймыз, шынында НҒ мен SіҒ 4 молекулаларының құрамындағы атомдардың валенттіктері қанық, бұл молекулаларда химиялық байланыстың негізі - электрон жүбын түзетін не бүлттары тоғысып қаптасатын жалқы электрон жоқ. Солай бола тұрса да бұл екі газ жап-жақсы реакцияласады, су ерітіндісінде екеуі түгел қосылысады.
Мұндағы қосылысудың ретін түзілген Н 2 SіҒ 6 қасиеттері көрсетеді; бүл екі негізді күшті қышқыл, былай диссоциацияланады:
H2SіF + SіҒб"
5іҒб //г ионының түзілуі нейтрал молекула SіҒ 4 фтор ионымен қосылысатындығын көрсетеді. Айталық, НҒ мен SіҒ 4 арасындағы реакцияны көрнекі түрде былай жазуға болады:
Кұрамында осындай комплекс ионы бар қосылыстар комплексті қосылыстарға жатады.
Комплексті қосылыстарды ғылыми тұрғыдан А л ь ф р е д Вернер (1866-1919 ж. ) зерттеген; бұл жайындағы Вернердің жұмысы координациялық теория деп аталады. Жоғары келтірілген компл. ексті қосылыстардың анықтамасын Вернер ұсынған.
XX ғасырдан бастап комплексті қосылыстарды жете тексерген теориялар біздің елімізде шықты, бүл салада үлкен еңбек сіңірген біздің ғалымдар Д. И. Менделеев, Н. С. Курнаков, әсіресе Л. А. Чугаев және осы кезде акад. И. И. Черняев, т. б. Лев Александрович Чугаев Москвада туған. Москва университетін бітірген. Әуелгі кезде органикалық химиямен айналысқан, 1907 жылы Л. А. Чугаев Петербург университетінің анорганикалық химия кафедрасын меңгеруге сайланады. Л. А. Чугаев комплексті қосылыстардан көп ірі жұмыстар істеген, осы кезде Совет Одағында комплексті қосылыстарды зерттеушілер Чугаевтың шәкірттері.
Л. А/ Чугаевтың платиналық металдардың химиясы жөнінде істеген жұмыстары ерекше, сол металдарды алу әдістерінің осы күнгі теориялық негізі Чугаевтан шыққан. Ғылым академиясында 1918 ж. платина институтын ұйымдастыруға да Чугаев көп еңбек етті.
Координациялық теория бойынша комплексті қосылыста орталық орын алып тұрған ион, не атом (біздің мысалымызда кремний) комплекс түзуші деп аталады. Мысалы, мына қосылыстар СиSО 4 -4NНз не РіС1 4 -2КС1 комплексті қосылыстар болады. Бұлардағы [Си(NН 3 ) 4 ] SО 4 , К2[(РіС1) б] мыс және платина иондары комплекс түзуші.
Комплекс түзушінің айналасына, соның әсері жететіндей жақындатқанда жиналған, яки координацияланған иондарды не молекулаларды лигандтар (аддендтер) деп атайды. Міне, осылар (комплекс түзуші мен лигандтар) бірігіп, комплексті қосылыстың ішкі сферасын құрайды. Ішкі сфераға орналаспай қалған иондар комплекс түзушіден алысырақ орналасады, олар комплексті қосылыстың сыртқы сферасын құрайды. Комплексті қосылыстарды жазғанда олардың ішкі және сыртқы сфераларын айырып көрсету үшін іщкі сфераны жоғарыда айтқандай квадрат жақшаға алады. Мысалы:
[Рf(NНз) 4 ], С1 2 , [NН 4 ] С1, [Рf(NН 3 ) 2 С1 2 ] С1 2 т. б.
Комплексті қосылысты суға еріткенде сыртқы сферадағы иондар диссоциацияланып кетеді. Сондықтан оның комплекс ионмен байланысы иондық болады. Енді ішкі сферада координацияланған иондар болсын, не молекулалар болсын, олар комплекс түзушімен байланысқан қалпында диссоциацияланбайтын комплекс болып қала береді. Мысалы: РіС1 4 -4NН 3 сияқты аммиакат комплексті қосылыс [Рі(N(Нз) 4 С1 2 ) С1 2 былай диссоциаияланады:
Комплекстің ішкі сферасында координацияланатын лигандтар иондар не бейтарап, бірақ полюсті молекулалар болуы мүмкін, онымен қатар бұлар аралас болуы да мүмкін, дұрысында мынадай комплексті қосылыс [Сг (NН 3 ) SС1] С1 2 . Комплекс түзушінің айналасына координацияланған лигандтардың жалпы саны сол комплекс түзушінің координациялық саны деп аталады. Жиі кездесетін комплексті қосылыстарда координациялық сан алтыға не төртке тең, сирегірек екіге, не үшке тең болады.
Комплекс ионның заряд саны сыртқы иондар зарядының қосындысына тең, бірақ кері мәнді болады, мысалы Н 2 [SіҒ 6 ] комплекс ион теріс екі валентті, себебі сыртқы сферада оң бір валентті сутектің екі ионы бар. [РfNз) Сj] Сj қосылысында комплекс ион оң екі валентті, қосылысында сыртқы сфера жоқ, сондықтан бұл қосылыс суда диссоциацияланбайды, бейэлектролит.
Комплексті қосылыстың құрамы белгілі болса, комплекс түзушінің зарядын табу қиын емес. Ол үшін комплексті қосылыстың формуласына кіретін басқа иондардың барлығының зарядтарының алгебралық қосындысын шығарып, оған теріс мән қояды, мысалы [Рі(1МНз) 4СІ2] СЬ оның қосындысы (4*0) + (2 - ) - + (2-) = (4 - ), демек, бұл арада комплекс түзуші платина оң төрт валентті.
Осы уақытқа дейін оқыған және алдымызда оқитын атомдық (қарапайым) қосылыстардың жалпы санына қарағанда комплексті қосылыстардың саны әлдеқайда көп. Өйткені, біріншіден элементтердің көпшілігі, оның ішінде металдар, әсіресе қосымша топтардағы металдардың барлығы, комплекс түзуші бола алады. Екіншіден, комплекстің ішкі сферасына лиганд ретінде кіретін бөлшектер өте көп, олар:
- Құрамында оттек бар қосылыстар - су (комплексті қосылыс - кристаллогидраттар түзеді), спирттер (алкоголяттар түзеді), қышқылдар (ацидат түзеді), альдегидтер мен кетондар да комплекстің ішкі сферасына кіре алады.
- Құрамында азот бар қосылыстар - аммиак (аммиакаттар түзеді), органикалық аминдер (аминат түзеді), нитридтер, амидтер т. б. қосылыстар да ішкі сфераға кіре алады.
- Құрамында күкірт бар қосылыстар - сульфидтер, тиоспирттер, тиоэфирлер т. б. қосылыстар да ішкі сфераға кіріп комплекс түзеді.
- Тұздар және түздардың қос түз типті комплексті қосылыстары.
- Полигалогенид, полисульфид сияқты комплексті қосылыстар.
6. Күрделі қышқылдар (изополиқышқылдар, гетерополиқышқылдар) .
Химияда неше комплекс түзуші элемент болса, соның әрқайсысы осы аталған лигандтармен комплекс түзе алады. Осының өзінен комплексті қосылыстардың қаншалықты көп екендігін байқауға болады:
Комплекс иондарының беріктігі әр түрлі болады, ионы берік ион, ол туз суға ерігенде бүл ион диссоциацияланбайды, ерітіндіде Р1+ + + + не С1' иондары білінбейді, ал енді [Сd(NНз) з] С1 түзының ерітіндісінде С1 иондарымен қатар Сd + + иондары және NН 3 молекулаларының бар екендігі білінеді, демек бұл түз суға ерігенде: [СdNНз] Сl2 «=* +=± [Сd(NHз) " + 2С1' осылайша диссоциацияланумен қатар.
Координациялық сан 2 бір валентті күміс А§, алтын Аи және мыстың Си комплексті қосылыстарында кездеседі. Мысалы, [СиС1] -", [Аg(NНз) 2 ] + , [АuС1 2 ] ". Мүндай комплекстерде орталық атом мен екі лиганд бір түзудің бойына орналасады, де, құрылысы түзу сызықты болады (1-формула) .
О - Орталық атом
Координациялық сан 3 сирек кездеседі. Мысал ретінде сынаптың мынадай комплексті қосылысын: [(СН 3 ) з$] [НgЛ 3 ] келтіруге болады. [НgЛ 3 ] ~ ионының құрылысы теңқабырғалы үшбүрыш сияқты (II-формула) .
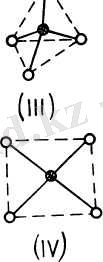
Комплекс түзушінің координациялық саны 4 болғанда комплексті ионның құрылысы тетраэдр немесе квадратты болып келеді (III және IV формулалар) . Тетраэдрлі комплекстерді бейметалдар және кейбір металдар түзеді. Мысалы, [ВеҒ 4 ] 2 ~, [ВС 4 ] -, [ВВ1] -, [ВВг 4 ] -, [ZпС1 4 ] 2 -, [ZпВг 4 ] 2 - [Ссі(СN) 4] 2 -, [Н ё (СN) 4 ] 2 -және т. б. Жазық квадратты комплекстерді әдетте, й(металдар түзеді. Мысалы, [Р1(^Н 3 ) 4] 2 + [РіС1] 2+ , [РсіС1] 2 ", [АиС1 4 ] " және т. б. ' Координациялық саны 5 болып келетін комплекстер онша көп емес. Мұнай комплекстердің құрылысы үшбұрыштыбипирамида немесе квадратты пирамида
\ \
сияқты болады (V және VI формулалар) . Ең жиі кездесетін координациялық .
6. Мұндай комплекстердің қүрылысы октаэдр сияқты (ҮІІ-формула) . Алтыдан үлкен коордийациялық сандар сирек кездеседі.
Ондай комплекстерді 5-және 6-периодтағы металдар, лантаноидтер және актиноидтер түзеді.
Шынында да қос түздар мен комплексті түздардың арасында үлкен айырмашылық жоқ. Қос түзды координациялық ішкі сферасы берік емес, тұрақсыз комплексті қосылыс деп қарауымыз керек. Бүл екеуінің негізгі айырмашылығы еріген кезде қос түздар қүрамындағы иондарға иссоциа
цияланады: ал комплексті тұздар комплекс ион түзеді.
Сондықтан қос тұздарды комплексті тұздардан айырмашылығын көрсету үшін К2[СиС1 4 ] деп жазбайды, СиСІ2-2ҚС1 деп жазады.
Комплексті қосылыстардың беріктігін сипаттау үшін, комплексті ионның диссоциациялану тепе-теңдігін алып, комплекстің тұрақсыздық константасын есептейді. Неғұрлым К т мәні кіші болса, соғұрлым комплексті ионның беріктігі арта түседі.
Комплексті ионның диссоциациялануы қайтымды процесс болғандықтан оған термодинамика заңдарын қолдануға болады: Бірнеше бөлшектердің бірігіп, үлкен комплексті ионның түзілуі-көбіне экзотермиялы болады, өйткені 4 каңа байланыстар түзіп жүйе экзотермиялық тұрақты күйге ауысады. Ал ретсіздік дәрежесіне келсек, керісінше, көп жағдайда оның кемігенін көрер едік (Д5<сО), яғни, ол ионның түзілуіне кері әсерін тигізеді.
Қазіргі кезде комплексті қосылыстардағы байланыстың табиғатын қарастыратын үш теориялық әдіс бар:
1) валенттік байланыс әдісі, 2) кристальдық өріс теориясы, 3) молекулалық орбитальдар әдісі. Осылардың алғашқы екеуін қарастырамыз. Валенттік байланыс'әдісі. Валенттік байланыс әдіс бойынша орталық атом мен лиганд донорлыакцепторлы жолмен байланысады. Әдетте, орталық атом байланыс түзуге бос орбитальдарын, лиганд пайдаланылмаған электрон жүбын (басқаша екі электронды орбиталін) жұмсайды. Демек, орталық атом (ион) -акцептор, лиганддонор. Молекула немесе ион лиганд ролін атн&ру үшін оның құрамындағы атомның пайдаланылмаған электрон жұбы болу керек.
Орталық атомның бос орбитальдарының саны оның комплексті қосылыстағы координациялык санына тең болады. Енді осы тұрғыдан кобальт катионы Со 3+ аммиак молекуласымен әрекеттескенде пайда болатын комплексті ионның (Со(NН 3 ) 6 ] 3+ түзілуін қарастырайық. Кобальт катионының кобальт атомынан Үш электроныоны кем, сондықтан кобальт катионының валенттік қабатының электрон құрылысы кобальт катионының валенттік қауызында төрт бос орбиталь бар (бір «45» және «4р» орбиталь) . Кобальт катионын қоздыру арқылы 3-деңгейшесіндегі жалқы электрондарды өзара жұптастырып, бос орбитальдар санын алтыға дейін жоғарылатуға болады:
Жұлдызша (*) белгісі кобальт катионының қозған күйде екенін көрсетеді. Қозған күйдегі кобальт катионының алты бос орбиталі: екі «3<і», бір «45» және үш «4р» орбитальдары бар. Аталған бос орбитальдар байланыс түзуге катыспастан бұрын кS р 3 -гибридті орбитальдарға айналады.
Кобальт катионының аталған алты орбиталі аммиак молекуласының қүрамындағы азот атомының екі электронды орбиталімен (басқаша пайдаланылмаған электрон жүбымен) жұптасқанда комплексті катион [Со(МН 3 ) 6 ] 3 + түзіледі. Кобальт катионының й 2 fр 3 -гибридті орбитальдары октаэдр төбесіне бағытталғандық-тан, түзілген комплекстің қурылысы октаэдр болады.
Сонымен валенттік байланыс әдісі бойынша комплексті қосылыстағы орталық атом (ион) мен лиганд арасындағы байланыс донорлы-акцепторлы жолмен түзілетін коваленттік байланыс. Комплексті ионның кеңістіктегі құрылысы орталық атомның бай-ланыс түзуге жұмсайтын бос орбитальдарының типіне байланысты. Орталық атом байланыс түзуге р-гибридті екі орбиталін пайдаланса сызықтық, sр 2 -гибридті үш орбиталін пайдаланса жазық үшбұрышты, sр 3 -гибридті төрт орбиталін пайдаланса тетраэдрлік, dsp 2 -гибридті төрт орбиталін пайдаланса квадратты комплекстер, dsр 3 -гибридті бес орбиталін пайдаланса үшбұрышты бипирамида тәрізді комплекс, <і 2 sр 3 -гибридті алты орбиталін пайдаланса октаэдрлік комплекс түзіледі, т. с. с.
Валенттік байланыс әдісі комплексті қосылыстардағы орталық атом мен лиганд арасындағы байланыстың түзілу механизмін" және комплекстердің кеңістіктегі қүрылысын түсіндіре алады. Енді валенттік байланыс комплексті қосылыстардың магниттік қасиеттерін қалай түсіндіреді екен, соны қарастырайық. Тәжірибелік деректер бойынша үш валентті кобальттың аммиакты комплексі димагнитті, жалқы электрондары жоқ, ал фторокомплексі [С6Ғ 6 ] 3 -парамагнитті, төрт жалқы электроны бар. Бұл құбылысты түсіну үшін аталған комплекстердің тузілуінің жолдарын қарастырамыз. Бос күйіндегі кобальт катионының төрт жалқы электроны бар, ал аммиакты комплекс құрамындағы <і 2 £ 3 -гибридті кобальт катионының жалқы электрондары жоқ, сондықтан диамагнитті. Фторо-комплекстегі жалқы электрондардың саны бос күйіндегі кобальт катионыныкі сияқты төртке тең, яғни, тәжірибелік деректер бой-ынша фторокомплекс [СоҒ б ] 3+ түзілгенде Со 3+ ионының битальдары өзгеріссіз қалады. Ал қалыпты күйіндегі кобальт катионының Со 3+ бар болғаны төрт бос орбиталі бар, алты лиганд (фтор иондары) қосып алу үшін тағы да екі бос орбиталь қажет. Жетіспейтін екі орбитальды кобальт катионы 4-деңгейшесінен алады, яғни фторокомплексте байланыс түзуге кобальт ионының бір «45, үш «4р» және екі «4сі» орбитальдары қатысады:
Аталған орбитальдар гибридтенгенде алты sр 3 с1 2 -орбитальдар түзіледі.
Аммиакты комплексте кобальт катионы байланыс түзуге ішкі 3d-орбитальдарын, фторокомплексте сыртқы 4d-орбитальдарын пайдаланады. Орталық атомның ішкі орбитальдарының қатысуымен түзілген комплекстер «ішкі орбиталъды» комплекстер, ал сыртқы -орбитальдардың қатысуымен түзілетін комплекстер «сыртқы орбитальды» комплекстер деп аталады. Біздің мысалымызда аммиакты комплекс Со(NН 3 ) б 3+ ішкі орбитальды комплекс, ал фторокомплекс СоҒ б 3 ~ сыртқы орбитальды комплекс. Ішкі орбитальды комплекстер түзілгенде жалқы электронды саны азаяды, сондықтан ішкі орбитальды комплекстер басқаша аз спинді комплекстер деп те аталады. Сыртқы орбитальды комплекстерде орталық атомның ішкі -деңгейшесі өзгермейді, жалқы электрондар бос ионда қанша болса комплекстің құрамында сонша болады. Сыртқы орбитальды комплекстердеғі жалқы электрондар саны ішкі орбитальды комплекстердегіден көп болғандықтан, оларды көп спинді комплекстер деп атайды. Комплекс түзушінің ішкі орбитальды немесе сыртқы орбитальды комплекс түзуші лигандтың табиғатына байланысты болады. Бірақ валенттік байланыс теориясы комплекс қандай лигандпен ішкі орбитальды, ал қандай лигандпен сыртқы орбитальды комплекс түзетінін алдын-ала болжауға мүмкіндік бермейді.
Кристалдық өріс теориясы бойынша комплексті қосылыстар-дың магниттік қасиеттерін түсіну үшін, электрондардың жіктел-ген й -орбитальдарға орналасу ретін білу керек.
Электрондардың орбитальдарға орналасу реті жіктелу энергиясы Д мен электрондардың өзара ж9птасу энергияларының Р шамасына
Октаэдрлі және квад- ратты комплекстердегі деңгей шенің жіктелуі
байланысты болады. Егер, лигандтың тудыратын өрісі әлсіз болса, жіктелу энергиясының шамасы электрондардың жүп-тасу энергиясынан аз болады (А<<Р) . Онда барлық сі-орбиталь-дар алдымен бір электронмен, одан соң екінші электронмен тол-тырылады. Егер, лигандтың тудыратын өрісі күшті болса, жік-телу энергиясының шамасы электрондардың жүптасу эне^гия-сынан үлкен болады, (А>Р), онда алдымен төменгі энергиялы орбитальдар, одан соң жоғары энергиялы орбитальдар толтыры-лады. Мысал ретінде үш валентті кобальттың фторокомплексі [СоҒ 6 ] 3 ~ мен аммиакты [Со(ЫН 3 ) б] 3+ комплексіндегі сі-элек- трондардың орналасуын қарастырамыз. Со 3+ ионындағы й -элек-трондарды өзара жүптастыру үшін 251 кДж/моль энергия қа-жет, фторокомплексте жіктелу энергиясы А=156 кДж/моль. аммиакты комплексте жіктелу энергиясы Д = 265 кДж/моль. Яғни, фторокомплексте жіктелу энергиясының шамасы электрон-дардың жүптасу энергиясынан аз, сондықтан фторокомплексте электрондар й г және й у орбитальдарына орналасады. Аммиакты комплексте жіктелу энергиясы электрондардың жүптасу энергия-сынан үлкен, электрондар й г -орбитальдарына орналасады (162-сурет) . Фторокомплексте 4 жалқы электрон бар, ал аммиак-ты комплексте жалқы электрондар жоқ, демек, СоҒ 6 3 ~ көп спинді комплекс, ал Со(ІМНз) б 3+ -аз спинді комплекс. Қарастырылған мысалдан мынадай жалпы қорытынды шығаруға болады. й -деңгейшесін нашар жіктейтін лигандтардың комплекстері көп спинді, ал күшті жіктейтін лигандтардың комплекстері аз спинді болып келеді.
Кіріспе.
XIX ғасырдың аяғында валенттік күштерінің белгілі бір бағыты болатыны ашылды. Бутлеров пен Вант-Гофф, Ле Бель еңбектері заттар молеку-ласының құрылысын танып білуге үлкен көмегін тигізді. Бірақ осыған қарамастан XIX ғасырда атомдардың молекулаға бірігу себебі және валенттіктің мазмұны әлі де белгісіз болып қала берді. Бұл сұрақтарға жауап тек біздің ғасырымызда атом құрылысы анықталғаннан кейін барып табылды. Қазіргі кездегі ұғымдар бойынша химиялық байланыс атомдардың сыртқы электрондық қабаттарының әсерлесуі нәтижесінде пайда болады демек, атомдарды байланыстырат^н күштердің электрлік таби-ғаты бар деп есептеледі.
Химиялық байланыстың үш түрі бар: коваленттік, иондық және металдық байланыс. Бүлардың ішіндегі ең жиі кездесетіні және ең негізгісі - коваленттік байланыс.
Коваленттік байланыс. 1916 жылы американ ғалымы Льюис химиялық байланыстың электрондық теориясын үсынды. Бүл теория бойынша екі атом бір-бірімен екеуіне де ортақ электрон жүбы (қосағы) арқылы байланысады. Льюис теориясы қысқаша былай түжырымдалады.
1. Сыртқы қабатында 2 немесе 8 электроны бар инертті газдар химиялық жағынан өте инертті демек, мүндай газдардың электрондық қабаты өте түрақты. Атомдар молекула қүрып біріккенде ортақ электрон қосағын түзу арқылы өздерінің сыртқы қабаттарын инертті газдардікіндей етуге тырысады.
2. Химиялық байланыс әсерлесуші атомдардың екеуіне де ортақ электрон жүбы аркылы жасалады. Бір электрон жүбын түзу үшін әр атом бір-бір электроннан жүмсайды.
Бір не болмаса бірнеше электрон жүптары арқылы түзілетін химиялық байланыс коваленттік байланыс деп аталады.
Хлор және азот молекулаларының түзілуін қарастырайық. Атомның сыртқы қабатындағы әр электронды бір нүктемен белгілеп, хлор және азот молекулаларының түзілуін мынадай схема түрінде көрсетуге болады. .
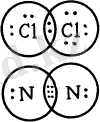
Хлор атомының сыртқы қабатында жеті электрон бар. Хлор молекуласы түзілгенде әр атом бір электроннан берш, ортақ бір электрон жүбы түзіледі. Сөйтіп, молекуладағы әр атомның гыпткы қабаты инертті газдардікіндей оттекке (сегіз электрондык қабатка) айналады. Азот молекуласы түзілгенде үш ортак ектрон косағы пайда болып, молекула қүрамындағы әрбір азот атомының сыртқы қабаты сегіз электрондық қабатқа айналады.
Төменгі схемада Льюис теорйясы бойынша су, аммиак және
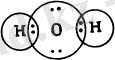
... жалғасы
метан молекулаларынық қүрылыстары келтірілген.
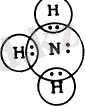
Су молекуласындағы оттек атомы сегіз электрондық қабатпен, ал сутек атомдары инертті газ гелий атомы тәрізді екі электрондық қабатпен қоршалған. Аммиақ және метан молекулаларының құрамындағы сутек атомдары да екі электрондық қабатпен қоршалған.
Оттек - екі валентті элемент, ортақ электрон жүбын түзуге екі электронын жүмсайды. Сутек - бір валентті элемент, ортақ электрон жұбын түзуге бір электрон жұмсайды. Демек, Льюис теориясы бойынша атомның валенттігі ортақ электрон жүп түзуге берген электрон санымен анықталады.
Льюис теориясы жарық көрген кезде электронның толқындық қасиеттері әлі белгісіз болатын. Электронның екі жақтылығы кванттық механикада ескеріледі. Сондықтан химиялық байланыстың қазіргі кездегі теориясы кванттық механикаға негізделген, олар валенттік теориясы деп те аталады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz