Тері және мех шикізатын хроммен өңдеу: хром қосылыстарының алынуы, химиялық қасиеттері және илеу технологиялары


МАЗМҰНЫ
Кіріспе . . . 3 1 Хром қосылыстары, алыну жолдары және олардың қасиеттері . . . 5
2 Үш валентті хром қосылыстарының химиясы . . . 8
3 Хроммен илеудің әдістері және иленген былғары мен мехтың қасиеттері . 14
3. 1 Хроммен илеуге даярлық процессі . . . 14
3. 2 Бір ванналы және екі ванналы илеу . . . 18
3. 3 Хроммен иленген былғары мен мехтын қасиеттері . . . 20
4 Техникалық қауіпсіздік ережелері . . . 21
Қорытынды . . . 23
Қолданылған әдебиеттер . . . 25
КіріспеМенің курстық жұмысымның мақсаты тері мен мех шикізатын өңдеуде қолданатын хром химиялық элементі жайлы ақпарат жинастыру, соның ішінде, жеңіл өнеркәсіп саласындағы киім өңдірісіне қажетті операцияларда хромды және хром қосылыстарын қолдану мақсаттары мен ерекшеліктерін белгілеу болып табылады. Хром қосылыстары жайлы жазбас бұрын, алдымен хром элементі жайлы айта кеткен жөң.
Хром (Chromіum), Cr - элементтердің периодтық жүйесінің V тобындағы химиялық элемент, а. н. 24, а. м. 51, 996. Тұрақты төрт изотобы 50Cr(4, 31%), 52Cr (83, 76%), 53Cr (9, 55%), 54Cr (2, 38%) бар. Олардың ішіндегі маңыздысы жасанды жолмен алынған радиоактивті изотопы 51Cr (T1/2=27, 8 күн ) . Хромды 1797 ж. француз химигі Л. Н. Воклен крокоит минералының құрамынан ашқан. Хром кең тараған элемент. Жер қыртысындағы салмақ мөлшері. 2*10-3%. Өнеркәсіптік маңызды минералы - хромит, оның бай кендері Солтүстік Оралда, Кавказ сыртында, Батыс Қазақстанда кездеседі. Батыс Қазақстандағы кені Ақтөбедегі хром қосылыстары заты мен ферроерітінді затын хроммен қамтамасыз етеді. Оның ішінде Хромтау қаласындағы (Дөң кең байыту комбинаты) Қазақстанға ең үлкен мөлшерде хромды қамтамасыз етеді. Хром - ақ, сұр түсті, қатты, ауыр балқитын металл, балқу t 191˚C, қайнау t 248˚C тығыздығы 7, 14 °грамм/куб сантиметр. Қалыпты температурада фтормен, 600 С-тан жоғары температурада галогендермен, күкіртпен, азотпен, көміртекпен, кремниймен, т. б. көптеген металдармен әрекеттеседі. Оттекпен өте жоғары температурада әрекеттесіп Cr 2 O 3 тотығын түзеді, оның гидрототығы [Cr (OH) 3 ] - амфотерлі. Cульфидтері суда гидролизденеді. Сутекпен әрекеттесуге бейім емес, бірақ оны өзіне сіңіріп алады. Тотығу дәрежелері +1, +3, +6, кейде +1, +4, +6. Қосылыстары күшті тотықсыздандырғыш, тотығу дәрежесі +6 болатын қосылыстары (хром ангридриді CrO 3 , хроматтар) тотықтырғыш. Сұйық қышқылдардан сутекті ығыстырады. Хром кешенді қосылыстар түзуге бейім. Ол құрамда оттек бар қышқылдармен әрекеттесіп нитрат Cr(NO 3 ) 3 ⋅9H 2 O, сульфат Cr 2 (SO 4 ) 3 ⋅18Н 2 О тұздарын түзеді. Хром қолданылуына қарай таза күйінде немесе темірмен қорытпасы - феррохром түрінде (құрамында 60 - 85% Cr) өндіріледі. Оны хром кентастарын тікелей тотықсыздандыру арқылы алады. Хром металдан жасалған бұйымдардың бетін хромдау үшін пайдаланылады. Құрамында хром бар болат таттанбайды, қажалмайды және үйкеліс пен қызуға төзімді келеді. Таза хром өзінің тотығын Cr 2 O 3 алюминотерм. әдіспен, сондай-ақ кейбір тұздарын электролиздеу арқылы алынады. Тотығу дәрежесі +3 болатын хром көптеген тұздар, ашудастар түзеді. Хром-калий ашудасы былғары илеуде, мата өнеркәсібінде, кино пленкасын жасауда қолданады.
1 Хром қосылыстары, алыну жолдары және олардың қасиеттері
Хром оксидтер және басқа элементтермен қосылысы түрінде кездесетін поливалентті метал. Хромның жұмысшыларға әсер етуі әр түрлі өндірістерде: құрал-саймандарға және басқа да металдан жасалған өнімдерді электролиттік хромдау кезінде, теріні илеу үшін және бояу кезінде басытқы үшін хромның қосылыстары қолданылатын тері, тоқыма өнеркәсіптерінде; шыны және форфор өндірісінде, фармацевтика өнеркәсіптерінде, қоспа ретінде хром қосып болат қорыту кезінде және басқаларда байқалуы мүмкін.
Хром қосылыстары: хром оксиді CrO-пирофорлы ұнтақ, негіздік оксид, тұз қышқылында ериді, қыздырғанда хром(3) оксидіне айналады ; Cr 2 O 3 -қиын балқитын күңгірт жасыл түсті ұнтақ, қаттылығы корундқа жақын амфотерлі оксид; CrO 3 - қанық - қызыл түсті кристалды зат, күшті тотықтырғыш, қышқылдық оксид, (хром қышқылын түзеді Н 2 CrO 4 ; гидроксидтері Cr(OН) 2 , Cr(OН) 3
Қолданылуы: хром және оның құймалары қара металлургияда қолданылатын қазіргі жаңа техниканың бағалы легирлеуші элементі. Таттанбайтын болат-18% хром және 8% никелден тұрады. Хром қосылыстарын тері илеуде, бояулар жасауда қолданады.
Хром- 6 топтың элементі. Оның электрондық формуласы:
Сr +24 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
Тотығу дәрежесі: +1-ден +6 -ға дейін.
Табиғатта таралуы. Жер қыртысындағы жалпы мөлшері -0, 03%. Хром әртүрлі минералдардың құрамына кіреді.
Хром - алтыншы топтың қосымша топшасының элементі, тотығу дәрежесі-(+2, +3, +6) .
Табиғатта кездесуі: хром жер қыртысындағы массасы бойынша мөлшері 0, 03 %. Ол көбінесе, қосылыстар түрінде кездеседі. Хромит немесе хромды теміртас FeCr 2 O 4 (Ақтөбе обл) және Cr 2 O 3 хром (ІІІ) оксиді кең таралған. Ақтөбе және Ақсу ферроқұйма зауыттарында өндіріледі. Хром космоста, жұлдызда, метеориттерде бар екені анықталған.
Қасиеттері: күмістей -ақ түсті жылтыр, ең қатты, шыныға сызат түсіретін металл. Хромның беті мөлдір оксид қабықшасымен қапталған, ол өте жұқа, бірақ химиялық өте тұрақты, тіпті қышқылдың өзі қиындықпен бұзады. Осы қабықшаға байланысты хром жемірілуге тұрақты, тіпті ылғал ауадада бұзылмайды. Сұйылтылған қышқылдардың өзі біраз уақыттан кейін ғана әрекеттесе бастайды. Азот қышқылы хромды пассивтейді.
Алынуы: Хромды теміртасты көмірмен қатты қыздырып алады.
FeO*Cr 2 O 3 + 4C = 2Cr + Fe + 4CO
Хромның темірмен құймасы - феррохром
Таза хромды алу
Cr 2 O 3 + 2Al = Al 2 O 3 + 2Cr
Алюминотермия: FeO* Cr 2 O 3 +C 2Cr +Fe + 4CO
Cr 2 O 3 + 2Al Al 2 O 3 + 2Cr
Химиялық қасиеттері:
Хромның беті мөлдір оксид қабыршақпен қапталған. Сондықтан химиялық тұрақты.
4Cr + 3O 2 = 2Cr 2 O 3 жанады
2Cr + 3Cl 2 = 2CrCl 3 шабытты әрекеттеседі
2Cr + 3H 2 O = Cr 2 O 3 + 3H 2 су буымен әрекеттеседі
2Cr + N 2 = 2CrN азотпен әрекеттеседі
2Cr + 3H 2 SO 4 = Cr 2 (SO 4 ) 3 + 3H 2
Хром қосылыстары:
Хром қосылыстарын анықтау:
Барлық хром тұздарының ерітінділерінің түсі бар: Cr +2 -көгілдір түсті, Cr +3 -жасыл күлгін, CrO 4 2- сары, Cr 2 O 7 2- қызыл сары.
Қолданылуы:
- легирлеуші элемент;
- болаттарға қосады;
- қаптамалар жасау үшін;
- бояулар дайындауда;
- тері илеуде.
Хром - ең қатты металл, ауада қорғаныш қабықшамен қапталған. Жемірілуге тұрақты. Қыздырғанда химиялық реакцияға түседі.
Хром тотықтары - хромның оттекті қосылыстары. Маңыздылары: хром тотығы, Cr 2 O 3 - жасыл кристалл, суда, қышқылдарда ерімейді. Техникада хром ангидридін термиялық ыдырату немесе 6 валентті хром қосылыстарын күкірт, көмір, органикалық заттармен тотықсыздандыру арқылы алады. Cr 2 O 3 катализатор ретінде, шыны, керамика бояуын өндіруде, хром алуда, т. б. пайдаланылады. Хром ангидриді, CrO 3 - қызыл кристалл, өте ылғал сіңіргіш, күшті тотықтырғыш, улы. Иод, күкірт, фосфор, көміртек элементтерін тотықтырып, өзі хром тотығына айналады. Хром ангидриді хром қосылыстарына қойыртпалы күкірт қышқылымен әсер ету арқылы алынады. CrO 3 хром тотығын алуда, медицинада, органикалық синтезде, т. б. қолданылады.
2 Үш валентті хром қосылыстарының химиясы
Былғары мен мех өндірісі үшін хромның (III) және (VI) валентті қосылыстары қажет, олардан илеуге қолданылатын қоспалар дайындалады. Хромның (II) валентті қосылыстары комплекстер түзуге бейім. А. Вернердің дәлелі бойынша барлық еритін қосылыстарында хром комплексті ионның ішінде болады. Мысалы, кристал логидрат CrCl з бН 2 О комплексті қосылыс, су молекулалары ішкі сферада орналасып, хроммен байланысқан.
Ішкі сферада иондар, бейтарап малекулалар немесе олар бірге болуы мүмкін. Қосылыстарын қыздырған кезде комплекс біраз өзгереді.
Азот оттегісі бар лигандалармен берік ковалентті байланыстар түзу хромның қосылысына тән. Ішкі сферада хром атомымен байланысқан тек Н 2 О, OH тобынан басқа қышқыл қалдықтары SO, SO комплекс құрамына енеді. Хромның координациялық саны алтыға тен .
Cr(+3) қосылыстары :
Cr3+ MICr(SO4) 2 ·12H 2 O түріндегі қос сульфат құруға бейім болып келеді.
(III) хромгидроксидін аммиакпен хром тұзы ерітіндісінен алады (III) :
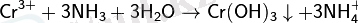
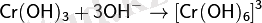
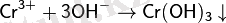
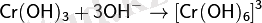 - ерігіш гидрокомплекс
- ерігіш гидрокомплекс
Cr2O3 сілтіде еріткеннен кейін хромит түзіледі:
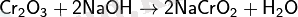
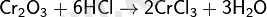
Таза ауада сілтілік еріткеннен кейін: (сары түске боялады)
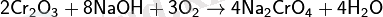
Ішкі сферада бір табиғатты иондар, молекулалар болса, біркелкі комплексті қосылыстар деп аталады
Хромның 3 түрлі комплексі бар:
- Катионды - комплексті ион; он зарядталған
- анионды - комплексті ион, теріс зарядталған
- бейтарап - комплекс ионы, зарядталмаған.
Егер лиганда бір координациялық орын алатын болса, оның координациялық сыйымдылығы да бірге тең болады да, 2 немесе 3 орын алатын болса, мұндай лиганда би, три, яғни полидентатты деп аталады.
Қышқыл қалдығы немесе молекулалар хром атомымен екі жақты байланысатын болса циклдар түзіледі . Мысалы Cr - О ( бес мүшелі цикл ) А. Чутаевтін пікірі бойынша 5 және 6 мүшелі n берік, 4 - мүшелі әлсіз, 5 - мүшел тұрақсыз деп есептеледі.
Хромның кристаллгидраты.
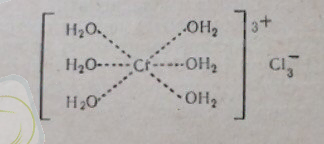
Хромның кристаллгидратын қыздырғанда құрылым комплекстерінің бөлінуі:
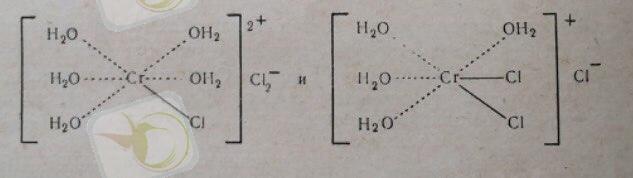
Хромның комплекстік қосылыстарының құрамына және ішікі сфера құрамында иондар немесе неитралды малекулалар, немесе екеуіде болуы мүмкін.
Комплекстің түсінің бұлай өзгеруі тек молекулалардың орын ауыстыруында ғана емес, олардың орналасуына да байланысты. Әркелкі хром комплексінің ішкі сферасындағы топтар немесе молекулалар цис және транс жағдайында орналасады:
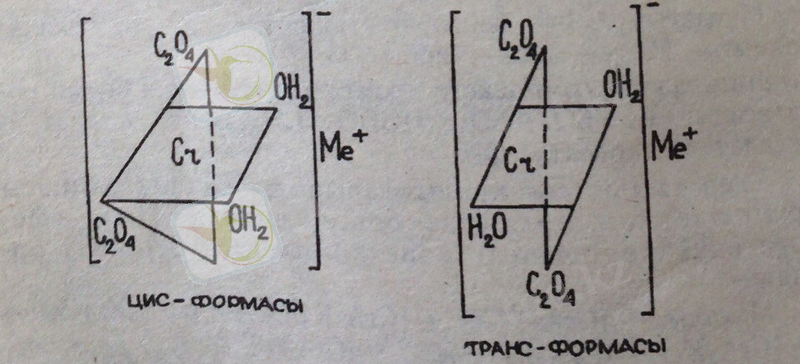
Бұл заңдылық академик И. И. Черняевтің транс -әсерлесуі деп аталады, ол 1926 жылы ашылған. Мысалы, илегіштің белокпен реакциясы транс әсерлесуі арқылы жүреді.
Хром қосылыстарының гидролизі. Хром тұздары ерітіндіде гидролизденеді, нәтижесінде гидроксоқосылыстар немесе хром оксидінін негізгі тұздары түзледі. Қосылып отырған негіз түзілген қышқылды бейтараптайды, тепе - теңдік оң жаққа ауады да хромның негізгі қосылыстары түзіледі. Керісінше қышқыл қосқан кезде гидролиз тоқтайды, тұз бастапқы қалпына келеді. Сусыз хром қосылыстарында гидролиз былай жүреді деп есептеу керек. Тұз ериді, оған су молекулалары қосылады да диссоциация жүреді. Бірақ хромның сусыз қосылыстарының бәрі гидролизденбейді. Тұздын судағы ерітіндісі бейтарап болып келеді . Мұндай қосылыстардын судағы ерітіндісі өте тұрақты, комплекстің ішкі сферасында орналасқан лигандалар су молекулаларымен ауыстырылмаиды, сондықтан мұндай қосылыстар гидролизге түспейді.
Хромнын көпядролы қосылыстары. Екі немесе одан да көп орталық атомдардан тұратын, координациялық топтармен қоршалып, бір - бірімен көпіршелер арқылы байланысқан хром қосылыстары көпядролы деп аталады. Көпіршілер ретінде О, ОН, NH 2 , SO, HCOO, No, CH 3 COO және басқа топтар болуы мүмкін. Хром комплексінің кеңістіктегі формасы таэдр болып келеді. Екі комплекс иондары бір - бірімен екі немесе үш көпіршілер арқылы байланыса алады: көпіршелердің саны үштен артпайды.
Хромның негіздік тұздары ерітіндісінде конденсация және полимеризация, бұл процестер көпядролы қосылыстардың түзілуіне әкеледі. Хром қосылыстарынын конденсациясында ішкі сферадан акво - топтары бөлінеді. Екі орталық атомның ортасында гидроксил тобы пайда болады да, жана комплекс түзіледі. Бұл процесс олификация, екі хром ионына ортақ ал гидроксотоп “ ол " тобы деп аталады. Молекулада хром атомдарының саны көп қосылыс түзетін болса, молекуланың өлшемі үлкейеді, ондай молекула белокпен жылдамырақ байланысады. Бірақ шамадан тыс молекула мөлшері артып кететін болса, оның коллаген құрылымына енуі қиындайды, бұл илеуді ұзартып, тіпті тоқтатып тастауы да мүмкін. Олификация нәтижесінде хромның көпядролы қосылысы түзіледі, илегіш қосылыстардың өлшемі ұлғаяды. Хром молекуласы үлкейген сайын, өзенде фиксация күшейеді. Бұл өлшем негіздікке байланысты. Олификациядан кейін, оксоқосылыс түзіледі, оны старение ерітіндінің ескіруі деп атайды. Оксоқосылыстағы қышқылдар ескіру әсеріне өте төзімді келеді. Хромның ерітіндіде тек негізгі тұздары соқосылыстар түзіп қана қоймай, полимерленеді . Хромның илегіш қосылыстарының өзгеру процесіне көптеген факторлар, атап концен айтканда температура, трация, сақтау уақыты, дайындау тәсілі және басқа да көптеген жағдайлар әсер етеді. Сонымен хром (II) тұздары ерітіндісінде мынадай құбылыстар жүреді: комплексті қосылыстар түзіледі гидролиз жүруінің нәтижесінде негіздік тұздар пайда болып, қышқыл бөлінеді, сонымен катар комплекстің заряды өзгереді, олификация және оляция жүруіне байланысты комплекстің молекулалық салмағы өседі, ерітіндінін қышқылдылығы артады, полимерлену кезінде комплекстің молекулалық салмағы өсіп, дисперсиялығы өзгереді, комплекстің ішкі сферасына қышқыл қалдықтары өтіп, басқа лигандтар сыртқа осы құбылыстың жүруіне көптеген факторлар әсер етіп, комплекстің зарядының өзгеруіне әкеледі.
Хром қосылыстары ерітіндісінің сипаттамасы құрамында гидроксил тобы бар, хромның (III) валентті қосылыстарына ғана илегіштік қасиет тән болып хромнын илегіш тұздарының сипаттамасының бірі негіздік болып табылады, ол хром комплексінің ішкі сферасында гидроксил тобының санымен анықталады.
Хром тұздарының негіздік дәрежесі мен оның саны арасында айырмашылық бар. Бұл айырмашылық мынадан туады. Хромның (II) негіздік сульфатының басқа бос қышқыл да болады. Хром ерітіндісінде хром комплекстерінен негіздік дәрежесі хромен байланыскан он тобының санынa хромның тотықтану дәрежесі, негіздік дәрежесі хроммен байланысқан гидроксил тобының хромның тотықтану катынасының дәрежесін көрсетеді.
Негіздік проценттик хромның тотыктануының дәрежесін анықтағанда, байланысты жалпы дәрежесі мен қышқыл санынын хромен айырмасы, хром комплексіндегі жағдайда тек OH топтарынын чаны деп есептеледі. Мехта талшықтардың жіктелуінің үлкен манызы себебі онда диффузияға кедергі жасайтын қыртыс қабаты сакталған, сондықтан илегіш өтпей қалуы мүмкін. Ісінуі бар коллаген қосылыстардын өзеннің өн талшығына диффузия бәсендейді. Концентрациясының артуы және температуранын жоғарылауы диффузияны жылдамдатуға әсер етеді. Механикалық әсер ету диффузияны тездетеді. Илегіш хром қосылыстарының кенге диффузиясын тексеру үшін, жарғақты ең қалың жерінен кесіп көреді, оның қиындысы хром еткен жерде жасылдау илегіш түске көкке боялады. Хром қосылыстарының белокпен байланысына көптеген факторлар әсер етеді. Оларға илегіш ерітіндінің негiздiлiгi, pН көрсеткіші, хром комплексінің құрамы, концентрациясы температура, бейтарап тұздар, илеу ұзақтығы және басқа да факторлар әсер етеді. Жалпы алғанда хром комплекстерінің өзеңге диффузиясымен байланысуына жоғарыда көрсетілген белгілі бір факторлар тобы әсер етеді.
Хром экстрактысын дайындау реті:
- Дихромат немесе монохромат ыстық суда ерітіледі.
- Ыстық ерітіндіге концентрациялы күкірт қышқылының есептеулі мөлшері жайлап араластыра отырып құйылады.
- Ол ерітіндіге алдын ала ерітілген немесе ұнтақталған тотықсыздандырғыш сақтықпен, өте баяу және аз порциялармен, ерітіндіні араластыра отырып қосылады. Қосу кезінде ерітіндінін, түсі сарғыш - қызғылтан қоңырланып, артынан үш валентті хромның жасыл - көк түсіне көше бастайды.
3 Хроммен илеудің әдістері және иленген былғары мен мехтың қасиеттері
3. 1 Хроммен илеуге даярлық процессі
Хромның негізгі илегіш тұздарын алу үшін, мынадай тұздар: натрий дихроматы Na 2 Cr 2 O 2 2H 2 O, калий дихроматы K 2 Cr 2 O 7 , кейде натрий хроматы (III валентті) Na 2 CrO 4 , калий KCr(SO 4 ) 2 12H 2 O (хром ашудасы) қолданылады.
Хром илегішіне даярлау күшті газ бөліну, ерітіндінің қатты қайнап тасуы және көпіршіктенуімен бірге жүреді. Сондықтан илегіш даярлайтын ыдыстың (реактордың) көлемі, ерітіндінің көлемінен 2-3 есе үлкен болуы керек. Сонымен қатар ауа соратын желдеткіш керек. Дихроматты салмағынан 200-250% мөлшерде көп алынған суда ерітеді. Содан соң реакторға жайлап күкірт қышқылының есептелген мөлшерін құяды. Араластыра отырып, тотықсыздандырғыш ерітіндісін бірте-бірте жайлап құяды. Ерітіндіні үнемі қатты қайнаған күйінде ұстап тұру керек, әйтпесе тотықсыздану реакциясы тоқтап қалуы мүмкін. Егер реактордағы сұйықтық деңгейі жоғары қарай қатты көтеріліп кетсе, онда тотықсыздандырғышты қосуды уақытша тоқтатып, оған аз мөлшерде суық су құю кажет.
Дихроматты тотықсыздандыру кезінде ерітінді бірте-бірте қызғылт-сары түстен лайлы-сары түске ауысады, ал тотықсыздандыру үрдісінің соңында ерітінді хромның негізгі сульфатты комплексі қосылыстарындағыдай жасыл түске ие болады.
Тотықсыздандыру реакциясының аяқталғанын анықтау үшін былай істейді: 20 см 3 20% күкірт қышқылының ерітіндісін сыйымдылығы 150-200 мл шыны ыдысқа өлшеуіш цилиидрмен құяды. Содан кейін осы ыдысқа 50 см 3 крахмал ерітіндісін қосады. Крахмалды қосқан кезде ерітінді көгеріп кетпеуі керек.
Егерде ерітінді көгерсе, оған 0, 01н. натрий тиосульфаты Na 2 S 2 O 3 ерітіндісін бояуы жойылтанға дейін қосады. Содан кейін шыны таяқшамен 2-3 тамшы сыналатын хром илегішін жоғарыда даярланған дихромат бар болса, ерітінді көк түске боялады. Кейде алынған хром илегішінің негізділігі өндірістік талапқа сәйкес келмейді, сондықтан оны өзгертуге тура келеді. Хромды илегіштің негізділігін төмендету күкірт қышқылымен, ал жоғарылату - натрий карбонатымен жүргізіледі.
Илеу барабанынан, ұлу тәріздес ерітінді алатын аспап арқылы илегіш ерітіндінің бір бөлігі рециркуляциялық құбыр жіберіледі. Айналым барабанның әрбір айналғанда ерітіндінің жаңа бөлігі сорылып келіп тұрады. Мәлімет беретін детектерлеу блогы, рецикуляциялық құбыр жүйесіндегі доға тәріздес бөлігінде бекітілген, сондықтан оның өлшенетін камерасында әркашан талданатын сұйық болады. Детектерлеу блогы талданатын сұйықтың сәулеленуін қамтамасыз ететін, сәулеленудің шашырағандығын тіркеу және оны электрлі сигналға өзгертетін құрылғы болып саналады. Өлшейтін камераның бүйір қабырғаларына бекітілген плутоний - 238 ИРИПЛ-3 түріндегі радиоактивті көздің гамма сәулеленуі қалыңдығы 0, 1мм лавсан пленкасымен бөлінген ерітіндінің жазық беткі қабатына бағытталады. Бұл сәулелену талданатын сұйықтығы хромға тән рентген сәулесін қоздырады және біршаманы шашыратады. Екінші сәулелену йодты натрийдің сцинтилляционды кристалына тиеді де, рентгенді квант қуатына, интенсивтілігі пропорционалды жарықтың жарқылдауына мәжбүр етеді. Жарықтың импульстерін электрлі қозғалысқа өзгертуді ФЭУ-85 фотоэлектронды көбейткішімен іске асырады. Квант қуатына пропорционалды электрлі қозғалыстар теңселісі ФЭУ-мен бірге адыңғы күшейткішке түседі, содан соң кабелі бойынша электронды өлшегіш блокқа жеткізіледі, ал ол блок технологиялық жабдықтармен бөлек жерде тұрады.
Электронды өлшегіш блокта электрлі-импульстер сызықты импульс күшейткішімен % күшейтеді және дифференциалды дискриминаторға түседі.
Дискриминатордың біреуі тек сцинттилляцияған импульсты өткізеді, ал екіншісі тек бірінші сәулеленудің шашыраған квантын ғана қабылдайды. Дискрининаторлардың шығатын жерлерді осы сәулеленуге сәйкес келетін санағыш аспаптарымен қосылған.
Санағыштан алынған сәуленің сандары талданатын сынақтағы хром (III) кояцентрациясына пропорционалды. Бұл сан тіркегішке тіркелеп сақталынады және индикация схемасына шығарылады, ал содан соң ұқсас сандар түрінде ЭВМ АСУ ТП-ға, өзі жазатын аспапқа, және цифрлі көрсеткішке беріледі.
"Хром-КРД" аспабы хром илегішінің жұмыс ерітіндісіндегі хромның (III) концентрациясын үздіксіз автоматты түрде бақылау жасайды.
Темірдің хлорлы және сульфатты тұздарымен иленген былғарының жоғары температураның әсеріне және сақтау төзімділігі нашар болды. Осы тұздармен иленген былғарыны ылғалдап қыздырғаннан кейін оның беріктігі кеміп, бірте-бірте бүліне бастайды.
Мұндай құбылыстар бірнеше себептерден болатыны анықталды. Аталған темір тұздары судагы ерітіндіде және белокпен байланысқан кезде де күшті гидролизденеді. Гидролиздену нәтижесінде көп мөлшерде қышқыл бөлініп, темірмен иленген былғарының бұзылуына әкеп соғады. Былғарының бұзылуының тағы бір себебі: ақуыздың тотығуы темірдің тотықсызданып, III валентті илегіш темір қосылысының II валентті илегіш қасиеті жоқ қосылысына айналуынан болады.
Бұл үрдіс былғарыны сақтауға төзімсіз етеді. Хлордың оксид тұздарының гидролизге төзімді болуына, оған құрамында ОН тобы бар органикалық қышқыл тұздарының ерітіндісін немесе органикалық қосылыстар қосу нәтижесінде қол жеткізді. Осының нәтижесінде хлордың III валентті ионы су ерітіндісіне төзімді және темірдің бастапқы тұзына қараганда гидролизге азырақ түсетін және тотығу-тотықсыздандыру реакциясына тұрақты комплекстер береді. Бірақ белокқа темірдің тотықтыру әсерін біржола жойып, ол үрдісті толық тоқтату әлі шешілген жоқ.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz