Осмостық және онкотикалық қысым: изотоникалық коэффициент және гипотоникалық, гипертоникалық және изотоникалық ерітінділер


Қарағанды Мемлекеттік Медицина Университеті
Кафедра: Химия курсы мен фармация
Тақырыбы: «Осмостық және онкотикалық қысым. Изотоникалық коэффициент. Гипотоникалық, гипертоникалық және изотоникалық ерітінділер»
Орындаған:
Тексерген:
Қарағанды 2009ж
Жоспар:
Кіріспе
І. Негізгі бөлім
- Бейэлектролиттер ерітінділері
- Сұйытылған бейэлектролит ерітінділерінің коллигативті қасиеттері
1. 3 Осмос
1. 4 Электролиттер ерітінділері
Қорытынды
Пайдаланылған әдебиеттер
Кіріспе
Қазіргі көзқарас бойынша өмір бейорганикалық және органикалық қосылыстардың сулы ертіндісі болатын мұхиттарда пайда болған. Эволюция нәтижесінде тірі ағзалар өсіп-өзгерген. Олардың көпшілігі судан кетіп, ауаға және суға өткен. Бірақ өсімдіктер мен жан-жануарлар су бесігін тастағанымен, өздерінің ағзаларында құрамында әртүрлі бейорганикалық иондар және органикалық қосылыстар бар сулы ерітінділерді сақтаған.
Ерітінділер туралы ілімнің дәрігерлер үшін ерекше мәні бар, себебі негізгі биологиялық сұйықтықтар - қан плазмасы, жұлын сұйықтығы, лимфа, несеп, тер, сілекей, судағы тұздар, ақсылдар, көмірсутектер, липидтер тірі ағзада ерітінділер күйінде болады.
Дәрілік заттар тек ерітінді немесе ағзада еріген күйге көшкен кезде ғана пайдалы.
Тағам құрамындағы қоректік заттар ағзаға сіңуі үшін ерітіндіге айналуы керек. Тірі ағзадағы биохимиялық реакциялар ерітінділерде өтеді.
Биосұйықтықтар қоректік заттардың (майлар, аминқышқылдары, оттегі) қозғалуына, дәрі-дәрмектік қосылыстарды ұлпаға және дене мүшелеріне тасымалдауға қатынасады, сонымен қатар метаболиттерді (мочевина, билирубин, көмір қышқыл газын жэне т. б. ) ағзадан шығаруға атсалысады. Қан плазмасы жасуша (лимфоцит, эритроцит, тромбоцит) үшін орта болады.
Бейэлектролиттік ерітінділері
Ерітінділер деп кемінде тәуелсіз екі компоненттен тұратын біртекті жүйелерді айтады. Заттардың агрегаттық күйлеріне байланысты ерітінділер былай бөлінеді.
1 Сұйық ерітінділер, мысалы теңіздер, мұхиттардың сулары, техникалық, дәрілік заттар ерітінділері, қан, асқазан шырыны т. б.
2. Қатты ерітінділер, оларға металдар балқымалары, табиғи минералдар жатады.
3. Газды қоспалар, мысалы ауа, карбоген (медицинада тыныс алу және қан тамырларын қозғаушы орталықтарды қоздырушы ретінде қолданылатын СО 2 және О 2 қоспасы) .
Сұйық ерітінділер еріген зат пен еріткіштен тұрады. Еріткіш ретінде су, спирт, бензол, хлороформ, ацетон, эфир т. б. қолданылады. Екі сұйық заттың қайсысы көп мөлшерде алынса, сол еріткіш болып саналады. мысалы, құрамы 95% спирт және 5% судан тұратын ерітіндіде еріткіш қызметін спирт атқарады. Егер газ не қатты зат сұйық затта ерісе, соңғысы еріткіш ретінде саналады, Мысалы, 20°С-та бромды сутектің судағы мөлшері 66, 5% болғанымен су еріткіш ретінде есептеледі, себебі еру кезінде НВг агрегаттық күйі өзгереді (газ күйінен сұйық фазаға өтеді) .
Ерітінділердің түзілуі күрделі физикалық - химиялық кұбылыс, бұл кезде еріген зат молекулалары мен су (көпшілік жағдайда еріткіш) арасында әрекеттесу байқалады. Еріген тұз иондары суда гидратталған. Бұл жайында М. В. Ломоносов былай деген: " . . . тұздың бөлшектері негізгі массадан бөлініп су бөлшектеріне жабысады да, солармен бірге қозғалады.
Ерітінділердегі гидратты қабаттар иондарда ғана емес полярлы бөлшектерде де болады, олардың қатарына маңызды биомолекулалар - көмірсулар, ақсылдар, нуклеин қышқылдары жатады. Қазіргі көзқарас бойынша, жасушадағы су молекуласының 40% құрылымдық су болады, яғңи биомолекуланың гидратты қабатының құрамына кіреді, бұл олардың физикалық-химиялық қасиеттеріне әсер етеді.
Полярлы емес заттарда су ерігенде химиялық қосылыс түзеді, Мысалы, метан сумен құрамы СН 4 • 6H 2 О қосылыс, ал хлор СI 2 • 8Н 2 0 түзеді. Бұл кезде сұйық судың тетраэдрлік кеңістігінде судың өзінде болған сияқты еріген зат молекуласының енуі жүреді. Сұйық суды да ену құбылысы ретінде қарастыруға болады.
Егер берілген температура мен қысымда А заты сұйық В еріткіште ерісе, бұл процесс термодинамңкалық көзқарас бойынша, жүйенің Гиббс энергиясыңың кемуі арқылы өздігінен жүреді.
∆H-T∆S=∆G<0
Еру кезінде энтальпия өзгерісі теріс немесе оң мәнді болады. Газдардың сұйықтықтарда еруі кезінде энтальпия әрдайым теріс мәнге ие (∆Н < 0), бұл процесс экзотермиялық конденсация процесіне ұқсас.
Қатты заттар сұйықтықтарда ерігенде энергияның біраз бөлігі еритін заттың кристалдық торының бұзылып, оның сұйық күйге өтуіне жұмсалады (балқу сияқты эндотермиялық процесс) . Қалған бөлігі еритін заттың сұйықтықтың бүкіл көлеміне бірдей таралуына жұмсалады (булану сияқты эндотермиялық процесс) .
Егер еріткіш пен еритін зат химиялық әрекспеспесе, онда ерудің жалпы энтальпиясы оң мәнді болады. Егер еріткіш пен еритін зат химиялық әрекеттессе онда сольваттар түзіледі, және ДН оң не теріс мәнді болады.
Теңдеуден мынаны байқауға болады егер еру процесі кезінде энтальпия өзгерісі оң мэнді (эндотермиялық) болса, онда міндетті түрде энтропия өседі. Тек осы жағдайда ∆G<0 шарты орындалады. Газдардың сұйықтарда еруі кезінде әрдайым энтропия кемиді (∆S<0), себебі газдардың тәртіпсіздік дәрежесі сұйықтықтарға қарағанда жоғары.
Ерігіштік деп берілген заттың қандай да бір еріткіште еру қабілетін айтады. Сандық түрде ерігіштік берілген температура мен қысымдағы қаныққан ерітіндінің концентрациясымен сипатталады. Ерігіштік еріген А затының жэне ерігіштің В табиғатына, температураға, сыртқы қысымға тәуелді қатты, сұйық газ заттардың сұйықтықтарда ерігіштігі олардың полярлықтарына байланысты. Молекуладағы оң және теріс зарядтардың орталықтары сәйкес келмей, қандайда бір 1 қашықтықта орналасса, онда ол диноль қасиетіне ие болып, полярлы деп саналады. Молекуланың полярлығының өлшемі ретінде диполь моменті (μ) алынады, Ол диполь заряды е мен диполь ұзындығының көбейтіндісіне тең шама
μ=e∙1
Егер сұйықтықты құрайтын молекулалардың диполь моменті μ =5∙10 -31 кл • м аз болса, сұйықтық аз полярлы деп ссептеледі. Жалпы поляр заттар поляр еріткіштерде, ал поляр емес заттар поляр емес еріткіштерде жақсы ериді.
Егер бөлме температурасында (20°С) ' 100 г. еріткіште 10 г. көп зат еритін болса, онда зат оңай ериді деп саналады. Егер бұл көрсеткіш 0, 01-1, 0 г. арасында жатса, онда зат қиын ериді деп саналады.
Егер еріген зат газ, ал еріткіш сұйық (не қатты) зат болса, онда ерітіндінің түзілуі жүйе көлемінің анағұрлым кемуі арқылы жүреді. Осыған байланысты газдардың сұйықтықтарда ерігіштігі қысым артқан сайын өседі.
Еру кезінде жүйе көлемінің өзгерісі (∆V=0) және жылу эффектісі байқалмайтын (∆Н=0) ерітінділерді идеал ерітінділер деп атайды.
Идеал ерітінділерге бейэлектролиттердің сұйытылған ерітінділері жақын. Идеал ерітінділерге идеал газдарга тән термодинамикалық заңдылықтар пайдаланылады. Атап айтқанда, әрбір компоненттің Gт, бос энергиясы теңдеумен көрсетіледі.
G 1 =G 0 +RTinP i
Мұнда Р, компонентінің ерітінді үстіндегі буының қысымы. Ерітінді үстіндегі будың толық қысымын (Р) Дальтон заңымен көрсетеді:
Рі=Рі+Р 2 +Р 3 + . . . +Рі;
Мұнда Р, -ерітінді компоненттерінің парциалды қысымы.
Егер еритін зат суға қарағанда (немесе жалпы жағдайда еріткіш) үлкен ұшқыштыққа ие болса, онда судың буының қысымы есептелінбейді, онда:
Р=Р 2 ° -N5;
мұнда N2 еріген заттың мольдік үлесі, Р 2 ° -таза еріген зат буының қысымы.
Мольдік үлес (№) дегеніміз берілген компонент моль санының ерітіндідегі барлық компоненттердің моль сандары қосындысының қатынасына тең шама.
Еріткіштен және бір ғана еріген заттан тұратын ерітінділерде (бинарлы ерітінді), еріткіш N1 және еріген зат N2 мольдік үлестері тең:
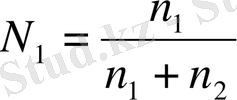
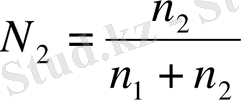
мұнда, n1 және n2 еріткіш және еріген заттың моль саны.
У. Генри (1803 ж. ) мына заңды ашты: тұрақты температурада газдың ерігіштігі (Р с ) берілген сұйықтық көлеміңде онын ерітінді үстіндегі парциалды қысымына (Р, ) тәуелді
Рс=К-Р г
Сұйытылган ерітінділер үшін Р 2 ° орнына тәуелділік коэффициенттік пайдаланылады:
Р=КN 2
Бұл тендеу Генри заңы деген атпен белгілі, ал тәуелділік коэффиценті (атм. Көрсетілген) Генри тұрақтысы деп аталады. Ол еріткіш және еріген зат табиғаттарына, сонымсн қатар, температураға тәуелді. Егер алдыңғы теңдеудегі мольдік үлесті моляльдыққа алмастырса, онда Генри заңы мына түрге көшеді.
P=Km
Мұңда Генри тұрақтысы атм-моль/кг сумен көрсетілген. Молялдық концентрация (т) еріткіштің 1000 грамындағы еріген заттың моль санымен көрсетіледі. Сұйытылғаы сулы ерігінділер үшін мольдік пен молялдық концентрациялар өзара жуық-(С~т) .
Мұнан газдардың судағы ерігіштігі олардың ерітінді үстіндегі парциальды қысымына тура тәуелді екендігі көрінеді, бұл тыныс алу физиологиясы мен газ алмасуды түсіндіруге қажет. Генри тұрақтысын К біле отырып, берілген газдың суда ерігіштігін оңай анықтауға болады.
Қысым артқан сайын газдың суда еруі өседі, сондықтан тереңдікте, мысалы 40 м төмен суда, оттегінің парциальды қысым 6 атм болған кезде, оттегінің ерігіштігі қалыпты жағдаймен салыстырғанда 27 есеге артады (атмосферадағы отгегінің құрамы =21%) .
Бірақ ыңғайлы физиологиялық вариант болып қысымы 1 атм судағы оттегінің мөлшері болып табылады, олай болса 40 м тереңдікте дем алу үшін газдыц қоспалары пайдаланылады, олар атмосферадағы ауадан 27 есе аз оттегіден тұрады. Осы ережеге сүйеніп, бірнеше жүз метр тереңдікке түсуді түсіндіруге болады.
Генри заныңың келесі көрінуі кессон ауруында. Мұның себебі қысым төмендеуінен газ ерігіштігінің кемуіне байланысты үлкен тереңдікте тез көтерілгенде қан плазмасынан бірден ауаның шығуына байланысты. Бұл кезде пайда болатын газ түйіршіктері патологиялық жағдайға, ал кейде қан жүретін түтікшелердің бітелуіне байланысты өлімге әкеледі.
Керісінше, жоғарғы атмосферада қандағы оттегі мөлшерін кемуі тау ауруы деп аталынатын басқа патологиялық жагдайға әкеледі; бұл оттегі жеткіліксіздігіне байланысты. Ағзаның қоршаған газды ортамен арақатынасы су астындағы жүзу физиологиясы мен авиациялық - космостық медицинаның негізгі мәселелері болып табылады.
Генри заңы барлық уақытта орындалмайды, одан ауытқу газ және еріткіш арасындағы химиялық реакцияларға байланысты, мұның биологиялық процестер үшін елеулі мәні бар. Мысалы, көмір қышқылының судағы жоғары ерігіштігі химиялық реакциямен түсіндіріледі:
С0 2 + ІІ 2 0 фн 2 СОз Щ± М + + НСО. Г
Судағы аммиактың күкіртті сутектің және хлорлы сутектің жоғары ерігіштігінің себебі осындай. Оттегі суда нашар ериді, бірақ қанда оте жақсы ериді, себебі гемоглобинмен химиялық байланысады.
Газдың судағы ерігіштігі онда электролит еріген кезде өте төмендейді. И. М. Сеченов газ ерігіштігі мен электролит концентрациясы арасындағы байланысты анықтады:
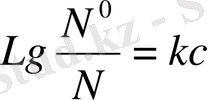
мұнда N және N газдың таза судағы және тұз концентрациясы С ерітіндідегі мольдік үлестері:
к-газ, электролит табиғаттарына және температураға тәуелді тәжірибелік тұрақты.
И. М. Сеченов оттек және көміркышқылының қанда еру заңдылықтарын зерттеген. Олар өте күрделі екен. Мысалы, оттек мөлшері артса онда қанның көмірқышқылын беруі оңайлайды, ал керісінше, көмірқышкылының қысымы артуына байланысты қандағы оттек ерігіштігі артады. Бор эффектісі деп аталатын бұл заңдылықтар кейін түсіндірілді.
Сұйытылған бейэлектролит ерітінділерінің коллигативті қасиеттері.
Коллигативті деп еріген заттың табиғатына тәуелді, тек оның мольдік концентрациясына байланысты касиеттерді айтады.
Сұйытылған ерітінділер үшін мұндай қасиеттерге ерітінді үстіндегі каныққан бу қысымының (қ. б. к. ) төмендеуі, қайнау температурасының жоғарылауы және қату температурасының төмендеуі, осмос қысымы жатады. Коллигативті қасиеттерді зерттеу арқылы еріген заттың мольдік массасын, оныц диссоциациялану не ассоциациялану дәрежелерін анықтауға болады.
а) Ерітінділер буының қысымы. Раульдің 1-ші заңы.
Кез келген сұйықтықтың үстінде сол сұйықтықпен тепе-теңдік күйдегі бу болады. Жабық ыдыстағы судың молекулалары үздіксіз қозғалыста болады. Қарама-қарсы екі процесе булану және конденсация процестері жүріп жатады. Белгілі бір мезетте булану және конденсация процестерінің жылдамдықтары өзара теңеседі. Сұйық өзінің буымен тепе-теңдікке келеді. Тепе-теңдіктегі бу қаныққан бу деп аталады. Қаныққан будың сұйықтық үстіне түсіретін қысымының шамасы қаныққан бу қысымы деп аталады.
Егер ұшқық сұйықтықта ұшпайтын заттың шамалы мөлшерін ерітсек, сұйықтықтың беткі кабатындағы ерітқіш концентрациясы азаяды, осыған байланысты буланып шығатын -молекулалар саны кемиді. Демек, ерітіндінің бу қысымы төмендейді. Идеал ерітінді бетіндегі қандайда болмасын компоненттің қаныққан бу қысымының шамасы және оның салыстырмалы төмендеуін Раульдің 1-ші заңы бойынша анықтауға болады
Ерітінді үстіндегі еріткіштің каныққан бу қысымы Р А оның таза күйдегі бу қысымын Р А ° ерітіндідегі еріткіштің мольдік үлесіне көбейткенге тең.
Р A = Р а N A =Р a °(1-N в )
Мұнда А- еріткішті, және В еріген затты шартты түрде белгілеу, Р А ° таза еріткіштің қаныққан бу қысымы, Р А - ерітінді үстіндегі еріткіштің каныққан бу қысымы, N A - еріткіштің мольдік үлесі, N B - еріген заттын мольдік үлесі.
Бинарлы ерітіндіде:
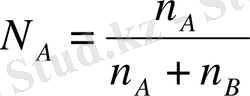
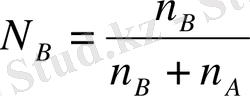
N A +N B =1
n A +n B еріткіш пен еріген заттардың сәйкес моль сандары
теңдеуді еріген заттың мольдік үлесі арқылы шешсек,
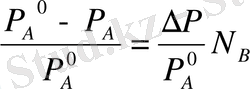
∆Р -Р А ° - Р А - қаныққан бу қысымының төмендеуі; ∆Р /Р А - ерітінді үстіндегі еріткіштің қаныққан бу қысымымың салыстырмалы төмендеуі.
Рауль заңының екінші анықтамасы: Тұрақты температурада ерітінді үстіндегі еріткіштіц қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың мольдік үлесіне тең.
Рауль заңына сұйытылған ерітінділер бағынады, концентрация артқан сайын бұл заңнан ауытқу байқалады. Рауль заңына бағынатын ерітінділер идеал ерітінділер деп аталады.
Ал сұйытылған ерітінділер үшін
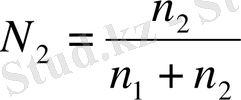
теңдеудің бөліміндегі п 2 санын ескермеуге болады, сонда N2=n2n1
Су үшін 1000 г-да моль саны n1= 1000/18. сонда
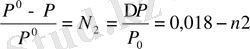
ал n2 -1000г суда5ы еріген заnтың моль саны, яғни
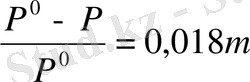
Сұйытылған ерітінділер үшін m~с болғандықтан
∆Р/Р°~ 0, 018 с
Бұл теңдеу ұшпайтын заттардың сұйытылған ерітінділері үшін Рауль заңының қарапайым түрі, мұнда еріген заттар концентрациясын есептеу оңай түрімен-молярлық бірлігінде берілген.
 Ұшпайтын заттар ерітіндісі үшін Рауль заңының негізгі қасиеттері еріткіштің қайнау температурасымен салыстырғанда ерітіндінің қайнау температурасыныи жоғарылауы және таза еріткішпен салыстырғанда ерітіндінің қату температурасының төмендеуі болып табылады. Ерітінділердің бұл қасиеттері коллигативті (немесе өзара байланысты, ұжымдық) деп аталады, себебі олар жалпы себептерге байланысты болады. Еріген зат бөлшектерінің мөлшері (олардың массасы немесе өлшемі емес) осы қасиеттердің пайда болуына әсер етеді. Коллигативті қасиеттердің біреуінің сандық мәнін анықтау басқа шамаларды есептеуге мүмкіндік береді.
Ұшпайтын заттар ерітіндісі үшін Рауль заңының негізгі қасиеттері еріткіштің қайнау температурасымен салыстырғанда ерітіндінің қайнау температурасыныи жоғарылауы және таза еріткішпен салыстырғанда ерітіндінің қату температурасының төмендеуі болып табылады. Ерітінділердің бұл қасиеттері коллигативті (немесе өзара байланысты, ұжымдық) деп аталады, себебі олар жалпы себептерге байланысты болады. Еріген зат бөлшектерінің мөлшері (олардың массасы немесе өлшемі емес) осы қасиеттердің пайда болуына әсер етеді. Коллигативті қасиеттердің біреуінің сандық мәнін анықтау басқа шамаларды есептеуге мүмкіндік береді.
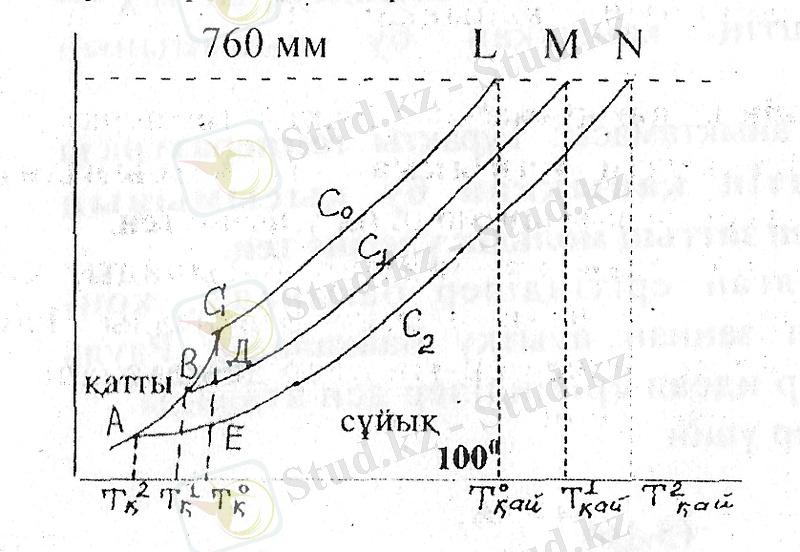
Таза су және әртүрлі концентрациялы су ерітіндісінің фазалық диаграммасы
Ерітіндінің қайнау және қату температурасының концентрацияға байланыстылығын фазалық диаграммамен көрсетеді.
Фазалық диаграмма
Әр түрлі агрегаттық жағдайдагы (бу, сүйық, қатты) кез келген зат бу қысымының температураға тәуелділігін көрсетеді.
суретте таза су және ұшпайтын еріген зат ерітінділерінің әр түрлі концентрациясы (С, және С 2 ) үшін фазалық диаграмма берілген.
Суретте температура өскенде бу қысымы артатындығы көрініп тұр. Жоғарыда көрсетілгендей, ерітінді үстіндегі қаныққан будың қысымы су үстіндегі қысымнан төмен. Сондықтан концентрациясы С, ерітіндінің бу қысымының қисығы таза су үстіндегі қаныққан бу қысымынан төмен орналасады, ал концентрациясы С 2 (С2>С1) ерітіндісінің қисығы одан да төмен болады.
Таза еріткішке қарағанда ерітінді төмен температурада қатады.
Бұл құбылыс техникада және медицина практикасында қолданылады,, бұл үшін арнайы қоспалар-ангидридтер пайдаланылады, олар сулы ерітінділердің қату температурасын төмендетеді. Мұз қатуға қарсылыққа тұздың қолданылуы осыған негізделген.
Лабораториялық практикада сұйық суытқыш қоспалар пайдаланылады, мысалы хлорлы кальцийдің қаныққан ерітіндісі - 55°Сдейін сұйық болады.
Ерітінділердің қату температурасының төмендеуі ерітіндіден еріткішке өткен кезде бу қысымының төмендеуі мен оның концентрациясының артуына байланысты. фазалық диаграммадағы АС қисығы мұздың қаныққан бу қысымының температураға тәуелділігін көрсетеді. С нүктесі мұздың еру температурасына Т қату (судың қату температурасы) жауап береді. СL қисығы таза судың бу қысымының температураға байланыстылығын көрсетеді. ВМ және АN қисықтарының АС қисығымен қиылысу нүктесі таза мұз сублимациясы және әртүрлі концентрациядағы ерітінді буы қисықтарының қиылысу нүктесі болады, олай болса тепе-теңдік қысымындағы ерітінділердегі судың қату нүктесі болады. Суретте көрсетілгендей, ерітінді концентрациясының өсуіне байланысты еріткіштің қату температурасы төмендейді.
Концентрацияға байланысты қату температураларының айырмашылығы ∆Т кату =Т°-Т' түзу байланысты болады, бұл ВСД және АСЕ үшбұрыштарының ұқсастығынан көрініп тұр (идеал ерітінділер үшін қисықтың өте кішкентай бөліктерін АС, ВС, БД және АЕ түзу деп санау қажет) . Сондықтан АЕ/ВД=ЛТ 2 кату /АТ кату =АР2/АР =m2/m.
Ерітінділердің қату температурасында берілген қосылыстың қатты және сұйық фазалары арасында тепе-теңдік орнайды. Сонымен, ерітіндінің қату температурасының төмендеуі мына теңдеумен беріледі;
∆Т кату = Кт ~ Кс
мұнда К-қату температурасының мольдік төмендеуі немесe берілген еріткіштің криоскопиялық тұрақтысы. Оның су үшін мәні 1, 86°С/моль, т-моляльдылық.
К мәнін есептеп табуға болады:
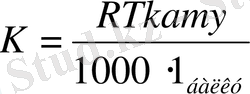
мұнда, R газ тұрақтысы; Т қату -еріткіштің қату температурасы, 1 балку - еріткішің меншікті балқу жылуы.
Суретте судың және ерітінділердің қайнау температурасы L, М және N бу қысымы қисықтарының сыртқы орта қысымы (760 мм) түзуімен қиылысу пуктелерімен анықталынады, себебі сұйықтықтың бу қысымы сыртқы орта қысымына тең болғанда ол қайнайды. Суреттен ерітіндінің кайнау температурасы судың қайнау температурасынан жоғары екендігі көрініп тұр.
ЛТ қату -Т -Т° қайнау температурасының айырмашылығы (ерітіндінің қайнау температурасының жоғарылауы) үшін қату температурасының төмендеуі үшін пайдаланған тұжырымдар жеткілікті. Сондықтан;
∆T қайнау =E∙m≈Ec
мұнда Е-тәуелділік коэффициенті, еріткіштің қайнау температурасының мольдік жоғарылауы немесе еріткіштің эбулиоскопиялық тұрақтысы деп аталады. Оның мәні тек еріткіш табиғатына тәуелді және су үшін 0, 51 °С/мольге тең. Е мәнін есептеп табуға болады

мұнда, К газ тұрақтысы, Т кату еріткіштің қайнау температурасы, 1 бу - еріткіштің меншікті булану жылуы. Сонымен, Раульдің екінші заңын былай тұжырымдауға болады. Ерітіндінің қайнау температурасының артуы немесс қату температурасының төмендеуі еріген заттың моляльдық концентрациясына тура тәуелді.
Рауль заңдары бейэлектролиттердің сұйытылған ерітінділері үшін орындалады.
Ерітіндінің ∆t қату және ∆t қайнау өлшеу арқылы еріген заттың мольдік массасын (М), осмостық концентрациясын, изотонды коэффициентті табуға болады. Бұл әдістер криоскопия және эбулиоскопия деп аталады.
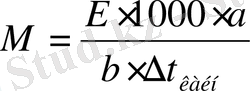
а- еріген зат массасы, в- еріткіш массасы
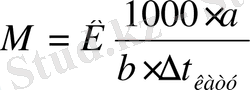
Кейбір еріткіштердіц криоскопиялық және эбулиобкопиялық тұрақтыларының мәні берілген.
Эбулиоскопиялық және криоскопиялық тұрақтылар
Криоскопиялы тұрақтының эбулиоскопиялық тұрақтымен салыстырғанда мәнінің үлкен болуы мұздың меншікті еру жылуының судың меншікті булану жылуынан төмен екендігіне байланысты.
Осмос
Ерітінділердің тағы бір коллигативті қасиеті осмостық қысым, осмос құбылысы әсерінен пайда болады. Осмос бір еріткіште дайындалған кейбір заттың әртүрлі концентрациялы екі ерітіндісі су (немесе басқа еріткіш) өткізетін жэне еріген зат молекулаларын өткізбейтін жартылай өткізгішпеи бөлген кезде байқалады.
Мұндай өткізгіштер немесе мембраналар кейбір бейорганикалық және органикалық материалдардан жасалынады, олар тірі табиғатта жиі кездеседі.
Жасушалық деңгейден бастап тіршіліктің болуы осы мембраналарға байланысты. Мембрана қызметін атқаратын жасуша мен дене мүшелерінің қабықшалары олардың құрам тұрақтылыгын қамтамасыз етеді, биологиялық мембраналар арқылы жасушаның қызметі үшін қажет заттар тасымалданады, олар арқылы тіршілік қалдықтары шығарылады. Сонымен, мембраналар биожүйелердің қажетті құрылымдық бірлігі ретінде саналады. Мембраналар түрлері сан алуан, олардың біреулері су үшін, басқалары - кейбір иондарға, кішкене молекулаларға ғана өтімді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz