Кулонометрлік талдаудың теориясы мен әдістері


Жоспар
Кіріспе
Талдаудың кулонометрлік әдісі ерітінді мен балқымадағы электрохимиялық реакция толық жүруі үшін қажетті электрдің мөлшерін өлшеуге негізделген. Есептеу Кулон заңы бойынша жүргізіледі. Бұл әдіспен талдаған кезде тіпті аз концентрацияның өзі анықталынады, талдауды оңай автоматтандыруға болады. Бұдан аса активті де тұрақсыз реагенттерді пайдалану мүмкіндігі туындайтындықтан, стандартты ерітінді әзірлеу қажетсіз болып қалады. Анықталынатын қосылыстың белгілі мөлшері болатын үлгі бойынша өлшегіш құрылғыны алдын ала тексеріп, өлшемдеп, қалыптастырып алмай-ақ талдау жүргізілуі мүмкін. Кулонометрлік талдаудың реагенті электр тогы болғандықтан, оны қалаған жерге орнатып, алыстан басқаруға, автоматтандыруға болады. Сонымен қатар бұл әдіс өте дәл және оны стандартты сынаманы дайындау үшін пайдаланады.
1. 1. Теориялық негізі
Кулонометрлік талдау кез келген электродтық реакцияға жұмсалатын электр мөлшерін өлшеуге пайдаланылады:
Re - nē Ox
Фарадей заңына негізделіп, электрдің саны бойынша тотықтырғыштың не тотықсыздандырғыштың массасы анықталады:
M
мұндағы М және М эк - эквиваленттің молекулалық массасы, М - мольдік масса, г/моль; I - ток күші, А; t - уақыт, с; n - реакцияға қатынасқан электрондар саны; 96485 - Фарадей саны Кл/моль; Q - электр мөлшері, Кл. Кулонометрлік талдауды жүргізген кезде мына шарттар орындалуы қажет: ток бойынша шығымы 100%-ке тең болатын тек бір ғана электрохимиялық реакцияның жүруі керек; тура кулонометриядағы электрохимиялық түрлену құбылысының соңын немесе кулонометрлік титрлеу кезіндегі табудың тәсілі болу керек; электрохимиялық әрекеттескен заттың массасын есептеу үшін реакцияға жұмсалынған электрмөлшері дәл де сенімді анықтау керек. Амперостатикалық кулонометрия әдісіндегі электрдің мөлшері ток күшінің уақытқа көбейтіндісі ретінде есептелінеді. Потенциостатикалық лонометриядағы талданатын ерітінді арқылы өткен токтың күші (экспотенциалдық заң бойынша) уақыт өткен сайын азаяды. Мұндай жағдайда электр мөлшерін өлшеу үшін интеграторларды немесе кулонометрлерді пайдаланады.
1. 2. Кулонометрлік әдістердің жіктелуі
Кулонометрлікталдауды орындау екі режим жүйесі бойынша жүзеге асады, осыған орай кулонометр екі топқа жіктеледі: потенциостатикалық және амперостатикалық . Потенциостатикалық кулонометриядағы өлшеу тұрақты потенциалда жүргізіледі. Бұл топқа потенциалдың уақыт өтуімен, яғни алдын ала берілген бағдарлама бойынша бір қалыпты тұрақты өзгерісін білдіретін өлшемдерді жатқызуға болады. Амперостатикалық немесе гальваникалық кулонометрия ток күші тұрақты болғанда жүретін құбылыстарға негізделген. Осы екі әдістегі аппаратураның едәуір айырмашылығы болса да олардың кейбір ортақ тетіктері мен буындары бар. Сондай-ақ кулонометрлік анықтамалардың да екі түрі бар: тура кулонометрлік және кулонометрлік титрлеу. Тура кулонометрлік әдісте талданатын зат кулонометрлік ұяшықта тікелей электрохимиялық өзгеріске ұшырайды. Ал кулонометрлік титрлеу әдісінде анықталатын зат әдейі таңдалынып алынған ерітінді - электролит электролиз кезінде кулонометрлік ұяшықта түзіліп титрантпен әрекеттеседі.
1. 3. Тұрақты потенциалдағы кулонометрия
Бұл әдіс берілген потенциал шамасына сәйкес электрлік активті затты анықтау үшін қолданылады. Электролиттік ұяшықтар арқылы өтетін ток тұрақты тұрақты потенциал кезінде тотықсызданушы немесе тотығушы ион концентрациясына тәуелді және реакцияның жүруіне қарай азаяды. Тура кулонометрияда потенциостатикалық әдіс кең қолданылады.
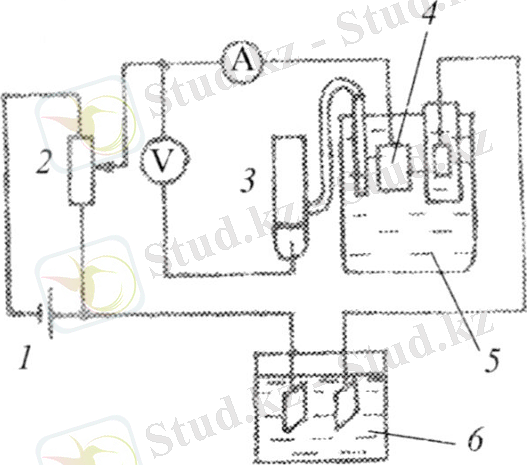
Cурет-1. Кулонометрлік құрылғының принцптік схемасы
Ондай құрылғының принціпті схемасы 1-суретте көрсетілген: тұрақты ток көзінен (1) кернеу бөлгіш (2) арқылы жұмысшы электродтағы (4) кулонометрлік ұяшыққа (5) кернеу беріледі. Салыстыру электродына (3) қатынасты жұмысшы электродтың потенциалы милливольтметрмен немесе потенциаметрмен анықталынып, ток күші амперметрмен бақыланады. Электр мөлшерінің шығыны кулонометрмен өлшенеді. Жұмысшы электродтың тұрақты потенциалын ұстап тұру үшін потенциостаттар П 5848, П 5727 М немесе оларға сәйкес кулонометрлер қолданылады. Кулонометрлік ұяшықтың жұмысшы электроды ретінде платина жолақшасы немесе торы, металл сынабы жиірек, ал алтын, күміс сияқтыларсирек қолданылады. Шыны, көміртегі, графит, тантал, титан, молибден сияқты материалдар тек катод ретінде ғана пайдаланылады. Кулонометрлік талдауларда берілген құрылымдағы ұяшыққа орайласқан барынша беткі ауданы үлкен жұмысшы электроды пайдаланылады және электролит ерітіндісіне толық енгізілуі керек. Жұмысшы және қосымша электродтардың лектродтық кеңістігі не электролиттік не ионалмастырғыш қалақанмен, не кеуек қалқанмен бөлінеді. Салыстру электроды ретінде көбінесе хлоркүмісті немесе каломельді түрі жиі қолданылады және бұлар жалпы көлемдегі жұмысшы электродпен, не жеке кеңістікте орналасады. Зерттелетін реакцияға жұмсалынған электр мөлшері химиялық, электрохимиялық немесе электрондық интегратор көмегімен өлшенуі мүмкін. Кулонометр-интегратордыңіс-әрекеті талданатын ерітінді арқылы қандай ток өтсе, сондай ток тізбекке тізбектеле жалғанғаи интегратор арқылы өтетін принципке негізделген, ол ток өлшенетін және интегралданатын болады. Интегратордағы анықталатын заттың табиғатына, өлшенегін көлеміне, массасына қарай кулонометрлер газ, электрогравиметрлік титрлеу кулонометрлері болып бөлінеді. Газ кулонометрі интеграторлары электродта бөлінген заттың массасын анықтайды. Мысалы, мыс кулонометриясында мыс сульфатының электролизі кезінде түзілген мыстың массасын анықтайды, ал күміс интеграторларында күмістің массасын өлшейді және т. б. Бетінде бөлінген таза мыс (не күміс) сияқты заты бар катодты өлшеу ісін, көбінесе ток күші тұрақты жағдайда осы электродтың өзіндегі металды кулонометриялы анодтаерітумен жиі алмастырады. Металл массасын онын еру уақыты және тұрақты ток күші бойынша теңдеуді пайдаланып есептейді. Ондағы электр мөлшері ток күшін анодты еруге кеткен уақытқа көбейткенге тең:
a= I • t
Потенциостатикалық кулономефияны жүргізгенде тізбектегі ток күші экспоненциалды тәуелділік бойынша кемиді:
I t = 1 o e -kt
мұндағы 1 о және 1t - бастапқы сәттегі және t сәтіндегі ток күші. k - құрамына ұяшық параметрлері мен талдау шарты енетін константа. Электр мөлшері мына интеграл бойынша анықталуы мүмкін:
t e -kt dt
теңдеуден байқағанымыздай, талданатын заттың толық тотықсыздануы (немесе тотығуы) It -> 0 уақыт t -> болғанда болуы мүмкін. Сондықтан теориялық тұрғыда толық алмасады деудің мағынасы жоқ. Бұл шама, мысалы, 99% не соның айналасында болса да жеткілікті. Электролиздің ұзақтығын былай анықтауға болады:
I t /1 o =10 -kt =1/99=10-2; t=2/k,
10 -kt =0, 1/99, 9=10 −3 ; t=3/k.
Тұрақты k-ның мәні электр активті заттың диффузиялық коэффициентіне (D) жұмысшы элекфодтың беткі ауданына (S), талданатын ерітіндінің көлеміне (V), диффузиялық қабаттың қалыңдығына (8), электрод бетінің күйіне және т. б. тәуелді, яғни
К = DS / V8.
Жалпы элекфодтық реакцияға және жұмысшы электродқа түсірілген потенциалға байланысты электрод не катод (онда тотықсыздану реакциясының жүруі), не анод (тотығуы) болуы мүмкін. Мысалы:
Fе 2+ - ē Fе 3+
Бұл реакцияның стандартты потенциалы Е (Ғе"+) = 0, 77 В. Егер жұмысшы электродқа 0, 9 В потенциал берілсе, онда электродта екі валентті темірдін тотығу реакциясы жүреді. Мұндай жағдайда электрод анод болады. Егер осы электродқа 0, 6 В потенциалы берілсе, онда бұл электродта үш валентті темірдің тотықсыздану реакциясы жүріп. Жұмысшы элекфод катод ретінде қарастырылады. Алайда дәл осы потенциалда І 2 - 2е 2I - жүйесі үшін ондағы Е 21- /I 2 = +0, 59. Бұл электродта иодтың ішінара тотығу реакциясы жүреді (жұмысшы электрод - анод) . Ал төрт валентті церий ионы 0, 9 В потенциалда қалай тотықсызданса, ол 0, 6 В потенциалда да солай және әрі толық, әрі тез тотықсызданады. Бұл жағдайда берілген жүйе үшін жұмысшы электрод катод болады. Әрбір қайтымды жүйе үшін электродты потенциалды Нернст теңдеуі бойынша есептейді:
E Ox /Red E ln
мұндағы E - нақтылы жағдайда редокс - жүйенің стандартты потенциалынан өзгешелігі бар формальды потенциалы. Практикалық жағдайда электролизді жүргізу үшін жұмысшы электродтың потенциалдың формальды не стандартты потенциалға қатысты тотықсыздандырғанда одан аздау немесе тотықтырғанда одан артық етіп алады. Мұндағы Е ығысу шамасы, электрохимиялық процестің аяқталу дәрежесімен және қажетті жылдамдықпен анықталынады. Тәжірибеде мұндай ығысудың мәні 90% жүруі үшін бір электрондық процесте 120 мВ (n = 2 болғанда Е = 60 мВ) болатыны тағайындалған. Тәжірибеде нәтижелері потенциостатикалық кулонометрияны жүргізгенде электрлік ұяшықтағы электр активті заттың тиімді аралығын анықтауға мүмкіндік туғызды, бұл 5-200 мг шамасында. Алайда. ұяшық көлемінде мөлтек фаммен алынған зат мөлшері болуы мүмкін. Әсіресе, бүл әдіс радиоактивті немесе сәулеленген заттарды, ядролық қалдықтарды, атомдарды анықтау үшін қажет. Кулонометрлік анықтаудың қателігі 0. 01-3% аралығнында, ол қолданатын қондырғы мен орындаушының кәсіби дәрежесіне байланысты. Бірақ ол талданылатын заттың концентрацітясына тәуелді емес. Потенциостатикалық кулонометрияның басты артықшылығы ол бір ерітіндіде болатын бірнеше құрамдас бөліктерді алдын алмайак оларды біртіндеп анықтау. Мұның негізі-стандартты потенциалдың мәнін және мүмкін болатын процестердің поляризациялық қисығын жазу. Потенциометрлік кулонометрия әдісімен жанама жолмен электр активті емес заттарды да анықтауға болады. Мысалы. электролиз кезінде өзінің валенттілігін өзгертпейтін хлорид иондарын күміс аноды бар кулонометрлік ұяшықта анықтауға болады. Мұндай жағдайда күмісті анодтың эквивалентті еруі журеді, бұдан нашар еритін күміс хлориді түзіледі:
Аg+Cl - AgCl
Сөйтіп, қорғасында анодты пайдаланып, сульфат-ионын анықтауға болады. Сульфат ионының анодта тотықпайтынын, сондықтан да оны анықтаудың жалғыз әдісі осы кулонометрлік әдіс екенін ескертеміз.
Мұнымен қатар, зерттелетін ерітіндіге электр активті затты артығымен қосқаннан кейін электр активті емес заттарды кері кулонометрлік анықтау әдісі де бар. Мысалы, ЭДТА электрактивті емес зат болса да, электрактивті катионмен олардың нақтылы потенциалын өзгерте отырып, берік кешенді қосылыс түзуге қабілетті. Оның концентрациясын анықтауға қажет деген біраз бөлігі мықты кешенді қосылыс түзуге кетеді. Үш валентті темір ионының аралық мөлшерін тиісті потенциал кезінде кулонометрлік жолмен анықтайды да, қосылған және титрленген темірдің (III) айырмасы бойынша ЭДТА-ның құрамын табады. Іс жүзінде электр-генерирленген заттың көмегімен электрактивті емес және шамалы активті ғана көптеген заттарды потенциостатикалық кулонометрмен анықтаудың маңызы ерекше. Бұл әдісті қосымша кулонометрияға жатқызуға болады. Электргенерирленген иондарды қосқанда олар талданатын затпен өте тез әрекеттесуге қабілетті (тотыға не тотықсыздана отырып), электродта тез регенерациялана (тотығу не тотықсыздану арқылы) алады. Осындай өте тез ауысып отыратын тотығу-тотықсыздану реакциялары нәтижесінде талданатын активті емес заттың кулонометрлік тотығуы немесе тотықсыздануы жүреді.
1. 4. Кулонометрлік титрлеу
Бұл әдіс стандартты ерітінді әзірлеуді қажет етпейді, ондағы титрант міндетін электр тогы атқарады. Дәстүрлі титрлеу әдісінде талданатын заттың мөлшері титрлеуге кеткен титрант-реагентінің титрі мен көлем көбейтіндісі бойынша есептелінеді, ал кулонометрлік титрлеуде ізделініп отырған зат мөлшері ток күшімен талданатын затпен өзара әсерлесуші реагентті генерирлеуге кеткен уақыттың көбейтіндісімен есептелінеді. Ток күші тұрақты кезде жүргізілетін қосымша кулонометрия әдісі химиялық әрекеттесуге ұқсас болғандықтан, оның кулонометрлік титрлеу әдісі деп атайды. Іс жүзінде жемісті және сан қайтара қайталанылатын талдаудағы талданатын ерітіндінің электролитке қоссылатын аз бөлігін (аликвоты) титрлегенде, электрактивті затконцентрациясы өзгеріссіз қалатындай етіп қосады. Дәстүрлі титрлеу әдістеріндегі кез келген эквиваленттік нүктені табу тәсілі кулонометриялық титрлеуге де жарамды. Калий хлориді ерітіндісінің платиналық электродта катодтық және анодтық кеңістіктермен бөлінген ұяшықтағы электролизін қарастырайық. Мұндай ерітінділердің электролизі кезінде электродтардың потенциалы электролиттің құрамдас бөліктерінің ыдырау потенциалының мәніне дейін ығысады, яғни электрлік белсенді зат - судың ыдырау потенциалына дейін ығысады. Калий мен хлордың иондары электродтық құбылысқа қатыспайды, өйткені ол үшін олардың өздеріне сәйкес жоғары мәндегідей потенциал қажет. Демек:
анодта 2Н 2 О - 4 О 2 4Н + {\displaystyle 2H_{2}O-4e^{-}\rightarrow O_{2}\uparrow +4H^{+}}
катодта 2Н 2 О + 2 Н 2 + 2ОН - {\displaystyle 2H_{2}O-2e^{-}\rightarrow H_{2}\uparrow +2OH^{-}}
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz