Алкендер (этилендік көмірсутектер): құрамы, изомериясы, алыну жолдары, қасиеттері және полимерленуі


Жоспар:
- Құрамы, гомологтық қатары, изомериясы, номеклатурасы
- Алыну жолдары
- Физикалық қасиеттері
- Химиялық қасиеттері
- Алкендердің полимерленуі
- Жеке өкілдері
- Пайдаланылған әдебиеттер
Қанықпаған көмірсутектер деп молекулаларында өзімен жалғас көміртек атомымен байланысуға екі валенттіктен жұмсаған көміртек атомдары бар көміртексутектерді, яғни қос байланыс түзетін көмірсутектерді атайды.
Этилендік көмірсутектер гомологтық қатарының жалпы формуласы С n H 2n , бұлардың ең бастапқы негізі этилен, СН 2 =СН 2 болады.
Изомерия. Номенклатура.
Осы қатардың структуралық изомериясы қаныққан көмірсутектер катарындағыдай қатардың төртінші мүшесінен басталады, алайда изомерлердің саны анағұрлым көп болады. Көміртек тізбегінің құрылысына байланысты изомерлермен қатар, алкендер қатарында тізбектегі қос байланыстың орнына байланысты структура изомериясы да болады. Бұдан басқа, алкендер қатарында кеңістік (геометриялық) изомериясы цис-транс-изомерия деп аталатын изомерия да болады. Цис-изомерлерде қос байланысты көміртектегі белгілі атомдар (жеке жағдайда бір түрлі) немесе атомдар топтары осы қос байланыстың бір жағында болады, ал транс-изомерлер әр жақта болады:

алкендер қатарындағы геометриялық цис-транс-изомериясының болуы екі көміртек атомдары арасындағы байланыс осі бойынша бос айналуға σ-байланыстың мүмкіндік бермеуіне байланысты. Геометриялық изомердің бір түрінің басқа түрге көшуі тек жоғары температурада, жылылық энергия σ-байланысты нашарлатуға жеткілікті болғанда ғана мүмкін болады, жарық түсіп сәуле энергиясын сіңіргенде немесе σ-байланыстары катализаторлардың әсерінен нашарлағанда болады.
Алыну жолдары.
Алкендер кейбір мұнайларда кездеседі. Бұлар әсіресе Канада мұнайында көп. Мұнайдан таза күйінде С 6 Н 2 -ден С 3 Н 2 б-ға дейін көмірсутектер бөлініп алынған.
1. Алкендер қатарының алғашқы төрт мүшелері таза күйінде техникада мұнай дистилляттарының крекинг өнімдерінін, газ түріндегі бөліктерінен қысыммен немесе төменгі температурада айдау арқылы және кокстау газдарынан (этилен, пропилен) бөлініп алынады.
Кейбір алкендер техникалық мақсат үшін крекинг газдары және басқа өнеркәсіптік көздерден бөлініп алынарлық мөлшерден анағұрлым көп мөлшерде керек, сондықтан бұларды техникада қаныққан көмірсутектерді сутексіздендіру әдісімен алу кеңірек тарап келеді. Бұл процестің катализаторы ретінде әдетте әдейі арналып дайындалған хром тотығы қолданылады:
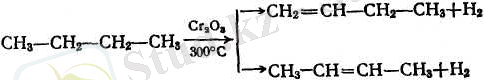
2. Лабораториялық жағдайларда алкендерді алудың ең көбірек қолданылатын тәсілі спирттерді сусыздандыру (суды бөліп алу) :
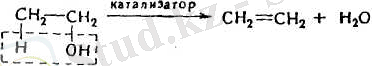
Осы сияқты үзіп алу реакциялары Е и Е 2 символдарымен көрсетіледі (бірінші немесе екінші реттік элиминирлеу реакциялары)
Сусыздандыру катализаторлары ретінде әр түрлі қышқылдар (күкірт, фосфор қышқылдары), қышқыл тұздар (КНSО 4 ) қышқылдар ангидридтері (Р 2 О 5 ), алюминий тотығы, алюминий тұздары және басқалар пайдаланылады.
Спирттің тегіне байланысты сусыздандырудың әр түрлі жағдайларын қолдануды қажет етеді. Әсіресе үшіншілік спирттер онай сусызданады: олар қайта айдау кезінде суды жиі үзіп алады.
Судың үзіліп алыну реті көпшілік жағдайда Зайцевтің қағидасы бойыңша жүреді: су түзілгенде сутек жалғасып тұрған ең аз сутектенген (гидрогенденген) көміртектің атомынан үзіліп алынады. Бұл сутек көбінесе қозғалмалы келеді.
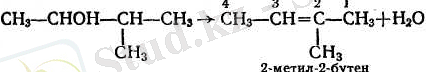
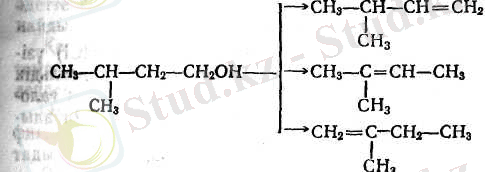
Сусыздандыру процесінде қос байланыстың орын ауыстыруы жиі болады және алынған көмірсутектің құрылысы бұны алуға жұмсалған бастапқы спирттің құрылысына сәйкес келмейді. Мысалы, изоамил спиртін сусыздандырғанда әдетте үш көмірсутектер алынады:
3. Алкендерді галоген туындылардан галогенсутектерін немесе галогендерді үзіп алу арқылы жиі алады.
Моногалоген туындылар сілтілермен әрекеттескенде (дегидрогалогенденуі) алкендер алынады.
Бұл мақсат үшін әдетте КОН немесе NaOH спирттік ерітіндісі қолданылады. Алайда бұл жағдайда жанама реакция да жүре алады - жай эфир түзіледі:
Сондықтан кейде галогенсутекті ұсақталған қатты сілті немесе органикалық негіздердің - диметиланилин немесе хинолиннің көмегімен үзіп алады.
Бүл жағдайда дегидрогалогендеудің бағыты жоғарыда қаралған Зайцевтің ережесіне сәйкес жүреді:
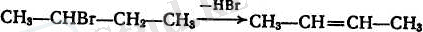
Алкендер алу үшін кейде вицинальдық дигалоген туындылардан галогендер үзіп алу әдісінде пайдаланылады. Қөбінесе бұны мырыш тозаңының немесе жаңқасының су-спирт ерітіндісінін көмегімен пайдаланып жүргізеді:
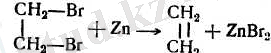
4. Кейбір жағдайларда белгілі құрылысты ацетилендік көмірсутектер құрылысы осылармен сәйкес ол алкендерден гөрі оңайырақ алынады. Осындай жағдайларда алкендерді ацетилендік көмірсутектерді жартылай «селективті» сутектендіру арқылы алады, мысалы паллади катализаторы үстінде:
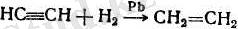
Германия Демократиялық Республикасында өнеркәсіпте этиленді ацетиленнен алады.
5. Соңғы кездері шеткі қос байланысты алкендерді синтездеу үшін Виттиг реакциясы өте жиі қолданылып жүр:

Физикалық қасиеттері. Этилендік көмірсутектер гомологтар қатарының алғашқы төрт мүшелері газдар. 5-тен 17-ге дейін көміртек атомдары бар алкендер - сұйықтықтар. Одан әрі қарай қатты заттар келеді.
Қөміртек атомдары нормальді тізбекті алкендер өздерінің тармақталған тізбекті изомерлерінен гөрі жоғарырақ температурада қайнайды. Қос байланыстың молекуласы ортасына жылжуы қайнау температурасын жоғарылатады. Цис-изомерлер әдетте транс изомерлерден гөрі жоғарырақ темпертурада қайнайды.
Қос байланысты молекуланың ортасына жылжуы балқу температурасын жоғарылатады. Транс-изомерлер цис-изомерлерден гөрі жоғарырақ температурада балқиды.
Алкендердің тығыздықтары бірден кем, бірақ сәйкес парафиндердікінен артық. Гомологтық қатарда тығыздықтары артады.
Алкендердің суда ерігіштігі тіпті аз, бірақ парафиндерге қарағанда көп. Алкендер кейбір ауыр металдардың тұздарының ерітінділерінде комплекстік қосылыстар түзе отырып жақсы еритіндігін ескерте кету керек (мысалы, жартылай хлорлы мыс ерітінділерінде) .
Алкендер үшін инфрақызыл сәулелерді 6-6, 5 және 10- 12 (і (1670-1560 және 1000-830 см~ 1 ) облыстарында іріктеп сіңіруі тән, сондықтан инфрақызыл спектрлер алкендердің құрылысын тағайындауда зор табыспен пайдаланып отыр.
Химиялық қасиеттері. Алкендердің реакциялық қабілетін көрсететін негізгі структуралық элемент болып, бұлардың сәйкес а және я-байланыстарынан тұратын қос байланысы болады. Қос-байланыс σ-байланыстан гөрі берік болғандықтан σ-байланыс үзіліп, қос байланыс орнына екі атомдар немесе атомдық топтардың бірігуі арқылы а-байланысқа оңай айналады. Мұндай бірігу жылдамдығы қосып алатын молекулалардың және қос байланыстық орынбасарларының түріне байланысты ажыратылады.
Сөйтіп, алкендерге көбінесе қосып алу реакциялары тән. Дегенмен, алкендер орын басу реакцияларына қабілетті және кейбіреулері парафиндерге қарағанда анағұрлым жеңіл жүретінін ескеру қажет. Қос байланысты а-орындағы көміртектің сутек атомы көбінесе орын басуға бейімірек келеді.
1. Алкендер катализаторлардың қатысуымен сутекті қосып алады. Катализаторсыз молекулалық сутекті немесе бөлу кезіндегі сутекті бұлар біріктірмейді.
Сутектендіру үшін катализатордағы алкен молекуласының қос байланысы бойынша адсорбциялану қажет болғандықтан, қос байланыстың орынбасарлары неғұрлым кіші болса, алкендер соғұрлым оңай сутектенеді (С. В. Лебедевтің қағидасы) .
2. Алкендер галогендерді оңай қосып алады:
Н 2 С = СН 2 + Вг 2 → ВгН 2 С - СН 2 Вr
Реакцияның жылдамдығы галогеннің тегіне және алкеннің
құрылысына байланысты. Фтор реакцияласқанда тұтану болғанда, йод күн сәулесінде тұтанады. Қос байланыстың орынбасарларының саны көбейген сайын қосып алу реакциясы жеңілдейді бұл орын басушы радикалдардық әсерінен осы байланыстың полюстілігінің үлкеюі бойынша түсіндіріледі.
Галогеннің атомдары радикалдық бойынша біріккенде (әдетте мына схема бойынша алынады: Вг 2 жары > к 2Вг') мүмкін болатын ең тұрақты радикалдарды түзе отырып, ашық тұрған көміртек атомдарының біреуімен қосылады. Мысалы, пропилен болған жағдайда екі радикалдын түзілуі мүмкін:
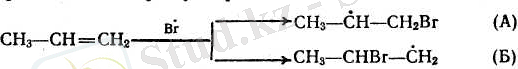
Радикал А оңай түзіледі және тұрақты келеді. Бұл радикалдағы бос электрон 5СН-байланыстардың электрондарымен қосарланып түрады, ал Б радикалдағы бос электрон жалғыз ғана ІСН-байланыстың электрондарымен қосарланған. Бүған тағы қосымша шеткі ашық тұрған көміртек атомының реакцияға қатысуы оңайырақ болады. Радикал А одан әрі галогеннің молекуласымен әрекеттеседі де, галогеннің жақа атомын тудырады (генерациялайды) :
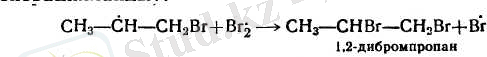
Бірігу иондық механизм бойынша жиі жүреді. Галоген-I нің молекуласы электрондарды өзіне тартып ала және σ-ком-1 комплекс түзе отырып, қос байланысты ысырады. Содан кейін галогеннің теріс ионы бөлінеді. Пайда болған карбондық катионға галогеннің теріс ионы бірігеді:
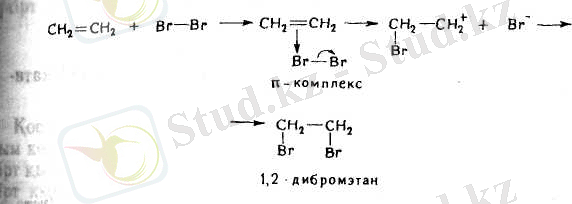
Алкендердің галогендермен реакциясы олардың қоспаларындағы сапасы мен санын анықтау үшін пайдаланылады. Сіңірілген бромның мөлшері бойынша алкеннің қанша екенін, анықтауға болады.
3. Алкендер галогенсутектерді де біріктіреді:
H 2 C = CH 2 + Н - Сl → H 3 C - СН 2 Сl
Галогенсутектердің симметриялы емес алкендерге бірігуі В. В. Марковниковтың ережесіне сәйкес жүреді: қос байланыстағы көміртектердің қайсысында сутегісі көп соған протон немесе сутегі ал сутегісі азына галоген қосылады.
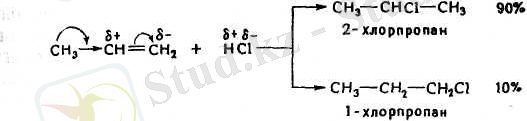
Галогенсутектің бірігуінің бұлай бірыңғай бағыт алуын былай түсіндіруге болады: қос байланысты көміртек атомдарының қасындағы радикалдар электрон бұлтын өздерінен ығыстыратын қабілеті бар (индукциялық эффект тура стрелкамен қосарланатын эффект иілген стрелкамен көрсетілген), осының себебінен қос байланыстың электрондары шеткі көміртек атомына жылжиды да, ол көбірек теріс электрленіп галогенсутектің протонын екінші көміртек атомынан гөрі күштірек тартатын болады. Бұдан басқа, реакцияның бірінші сатысында түзілетін катиондар тұрақтылығының да манызы болады: катион А катион Б-дан гөрі тұрақтырақ, өйткені бұның қосарланатындығы айқынырақ болып тұр (А катионның бос орбитасы бСН-байланыстарының электрондарымен, ал Б катионында 2СН-бйланыстарымен ғана әрекеттесіп тұр.
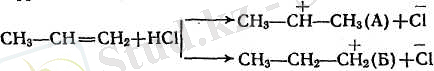
Реакцияның екінші сатысында галогеннің анионын екі катион да қосып алады.
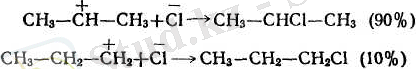
Марковниковтың ережесі галогенсутектердің иондық (гетеролитикалық) механизмі бойынша бірігуінде ғана сақталады. Егерде механизм радикалдық (гомолитикалық) болса, онда галогенсутекті қосып алу кері жүреді (Караштың асқын тотық эффектісі) .
Радикалдық қосып алу мысалы, алкендерді бромдысутекпен асқын тотықтардын немесе оттектің қатысуында әрекеттестіргенде байқалады. Оттектің бромдысутекпен әрекеттесіп, бром-атомын босатады, ал бұлар қос байланысты шеткі көміртек атомына қосылады, өйткені бұл кезде тұрақтылау радикал тузіледі. Пайда болған радикал реакция тізбегін әрі жалғастырады.
→
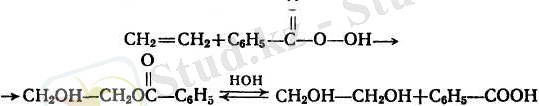
4. Алкендерге гипогалогенит қышқылдарының және олардың эфирлерінің қосылуы да Марковниковтың ережесі бойынша жүреді: теріс электрлі гидроксил көбінесе ең аз сутектенген көміртек атомына қарай жүреді:
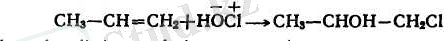
Алкеннің бірігу өнімін алу үшін мысалы, хлорлылау қышқылдың, реакцияға осы қышқылдың дайын ерітіндісін пайдалану міндет емес. Хлормен суды алуға болады. Онда реакция мына схема бойынша жүреді.
Бұл жағдайда реакцияның жүруін мынадай түрде бейнелеуге болады.
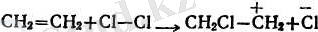
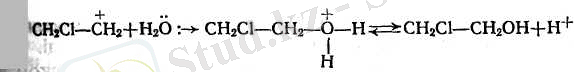
5. Катализаторлардың қатысуымен алкендер суды қосып алып спирттер түзеді. Спирттер алу үшін концентрацияланған күкірт қышқылын сіңірген алкендер жиі пайдаланылады.
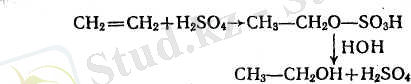
Қос байланыстың радикалдарының саны алкендерде неғұрлым көп болса (қос байланыс көбірек полюстенген болса), күкірт қышқылы соғұрлым оңай сіңеді. Этиленді 96-98%-тік күкірт қышқылы сіңіреді, ал пропилен 75-80%-тік, изобутилен 34-50%-тік қышқылдарды сіңіреді. Осы заңдылықты пайдалана отырып алкендердің құрылысын әр түрлі жолдармен бөліп алуға болады.
Қазіргі кезде алкендерді техникада ұстағышы бар фосфор қышқылымен гидратациялайды.
6. Алкендер ауадағы оттегімен немесе басқа тотықтырғыштармен тотықтырылады. Тотығу реакциясының бағыты реакцияның жағдайына және тотықтырғыштың қандай екеніне байланысты:
а) ауадағы оттегі күміс катализатордын. қатысуында алкендерді органикалық тотықтарға (эпоксидтерге) дейін тотықтырады:
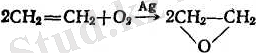
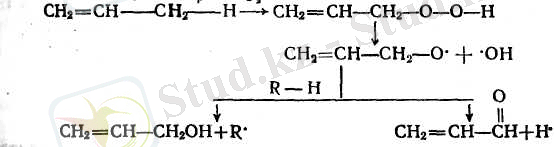
ә) алкендер ауадағы оттегімен катализаторсыз гидроасқын тотықтарды спирттермен карбонильдік қосылыстарды түзете отырып ыдыратады, жылжымалы сутек атомы қос байланыстағы р-байланысты үзіп, әдетте оттектің әсеріне ұшырайды.
б) Калий перманганатының сүйытылған ерітіндісі (Вагнер рейщиясы) немесе катализаторлардың (СгО 3 , О5О* және т. б. ) қатысуындағы сутектің асқын тотығы алкендер мен гликольдер I түзеді. Қос байланыс тұрған орынға екі гидроксил бірігеді.
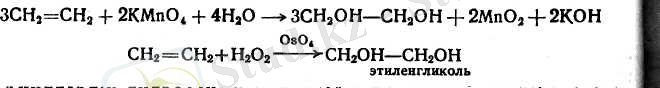
Ацилдердің гидроасқын тотықтары да осылай әрекет етеді.
в) калий перманганаты, хром қышқылы, азот қышқылы концентрациялы тотықтырғыштардың ерітінділерімен әрекеттестіргенде алкендердің молекулаларының қос байланыста тұрған жерінен үзіліп кетондар мен қышқылдар түзіледі:
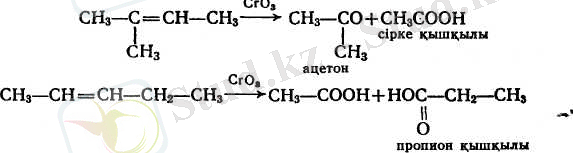
Бұл реакция алкендердің құрылысын анықтауға кеңінен қолданылады. Өйткені түзілген қышқылдар мен кетондардың қандай екеніне қарап, бастапқы қосылыстың қос байланысы мен байланысқан радикалдардың құрамы және құрылысы қандай екені туралы қорытынды жасауға болады.
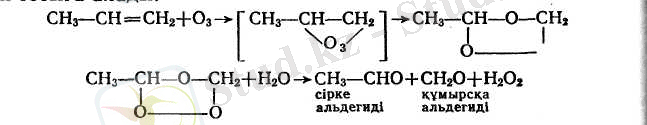
г) алкендердің құрылысын анықтауда өзіне тән тотықтырғыш ретінде пайдаланылады (Гарриестің озондау реакциясы) . Озон тұрақсыз қопарғыш озонидтер түзе отырып, қос байланыс тұрған жерінен бұларды сумен әрекеттестіргенде сутектің асқын тотығы мен карбонильдік қосылыстар түзіледі. Бүл кезде альдегидтер сутектің асқын тотығының әсерінен қышқылдарға дейін тотыға алады:
7. Алкендердің бірігу реакцияларынын ішінде көміртектің тізбегін ұзартып журетін процесс ерекше орын алады. Бұндай процестерге мысалы, фосфор немесе күкірт қышқылы қатысуымен парафиндерді алкендермен алкилдеу жатады.
Осы жолмен изоқұрылысты парафиндер алуға болады, мысалы, жоғары октанды иотор отыны ретінде үлкен маңызы бар изооктан алынады.
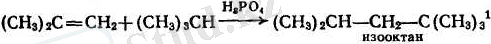
8. Осы кездегі техника үшін алкендердін қайта өзгерулері ең маңыздыларының бірі болып, А. М. Бутлеров ашқан полимерлену реакциясы саналады. Полимерлену деп кішкене молекулалы қосылыстардың (мономерлердің) бір-бірімен өздерінін негізгі валенттіктері арқылы жалғасып үлкен молекулалы қосылыстар түзілу процесін айтады.
Алкендердің полимерлену реакциясы қыздырумен, аса жоғары қысыммен, сәулемен, бос радикалдардың немесе катализаторлардың әсерімен туғызуға болады.
Полимерленудің ең маңызды басты екі түрі бар:
- Сызықтық тізбектік полимерлену. Мұнда өнімдерінің молекулалары тұрақты болмайды жәнеолар бөлініп алынбайды. Реакцияның өнімдері ретінде молекулалық салмағы үлкен заттар болады.
- Сатылы мирациялық полимерлену. Бұл жағдайда реакцияның өнімдері әрбір сатыда бөлек алына алады. Бутлеров изобутиленді күкірт қышқылымен әрекеттестіргенде ең бірінші рет дәл осындай процесті байқаған: диизобутилендер, триизобутилендер және т. б. түзілген.
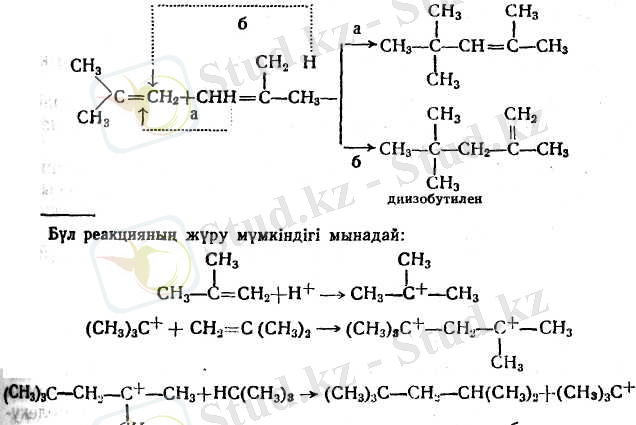
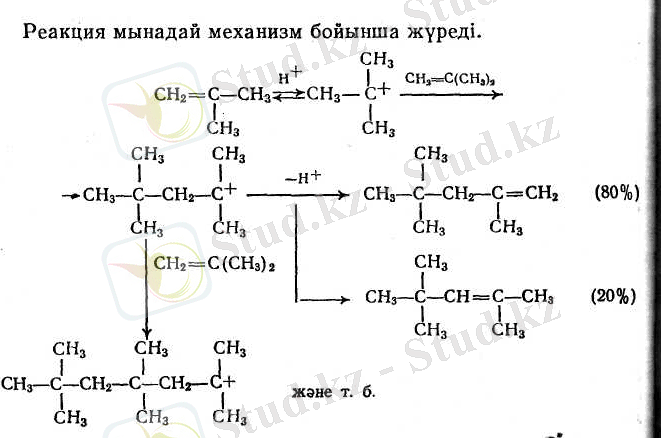
Изооктендердің (диизобутилендердің) қоспаларын сутектендіргенде изооктан түзіледі.
Полимерлену реакциясына дара және мономерлердің аралас заттары қатыса алады. Бұл екінші жағдайда аралас полимерлену (бірлесе полимерлену) туралы айтады.
Полимерленуге бейімділік алкендердін, құрылысына байланысты әдетте қос байланыстың екі жағындағы сутектің радикалдық орнын басуы полимерленуге бөгет болады (кеңістік қиындығы) .
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz