Гомогенді және гетерогенді жүйелердегі химиялық кинетика мен катализ


Жұмыс түрі: Реферат
Тегін: Антиплагиат
Көлемі: 12 бет
Таңдаулыға:
Реферат
Тақырыбы: Су
Жоспар
1. Гомогендi және гетерогендi жүйелердегi химиялық реакциялар. Гомогендi және гетерогендi жүйедегi реакция жылдамдығы. Реакция жылдамдығына әсер ететiн факторлар.
2. Әсерлеушi массалар заңы. Реакция жылдамдығының константасы. Реакция реттiлiгi мен молекулалығы. Активация энергиясы. Вант-Гофор ережесi.
3. Гомогендi және гетерогендi катализ. Каталитикалық процесстер механизмi туралы түсiнiк. Тiзбектi реакция.
1. Химиялық реакциялардың жүру заңдылықтарын зерттеу химияның негiзгi мәселесi. Бiр заттар басқа бiр заттарға айналу кезiнде оларды құрайтын атомдардың электрондық орбитальдары қайтадан топтасқандықтан екi байланыстар үзiлiп жаға байланыстар түзiлiп отырады.
Раекцияның жүру механизмiн, жылдамдығын және сол жылдамдықта әрекеттесетiн заттардың концентрацияларының, температураның, қысымның, катализатордың әсерлерiн зерттейтiн химияның бөлiмiн химиялық кинетика дейдi.
Әр түрлi реакциялар әр түрлi жылдамдықпен жүредi. Кейбiр реакциялар өте жай жүредi, ал басқа бiреулерi өте тез қопарылыс бере жүредi. Бiр реакцияның өзi жағдайларға байланысты әр түрлi жылдамдықпен жүредi. Сөйтiп, химиялық реакцияның жылдамдығын кесiмдi уақыт iшiнде реакцияласушы заттардың концентрациясының өзгеруiмен өлшейдi.
Әрекеттесушi және түзiлетiн заттардың агрегаттық күйiне байланысты химиялық реакциялар гомогендiк деп, ал қатысатын заттар әр түрлi агрегаттық күйде болатын реакцияларды гетерогендiк деп атайды. Гомогендiк реакциялар белгiлi бiр көлемде жүредi және ол реакция жүретiн ыдыстың көлемiне байланысты болады.
Гомогендiк реакцияның жылдамдығы деп белгiлi бiр уақытта реакция жүретiн көлемде әрекеттесетiн заттардың мөлшерiнiң өзгеруiн айтады.
Мысалы; реакцияға қатысатын заттардың концентрациясы 1 моль/л, ал реакция 1 млн жүргеннен кейiн 0, 8 моль/л қалса, 1 млн iшiнде жұмсалған 0, 2 моль/л осы реакцияның жылдамдығын көрсетедi.
Реакцияның орта жылдамдығы белгiлi уақыт аралығы үшiн t 2 -t 1 концентрацияның өзгеруiмен С 2 -С 1 өлшенедi. Оның математикалық көрiнiсi:
Гетерогендiк реакцияларды әрекеттесушi заттар әр түрлi агрегаттық күйде болады да, химиялық процесс көбiне, қатты заттың бетiнде жүредi. Әдетте қатты заттың бетiнде жүретiн негiзгi химиялық реакция тез жүредi де, ал сол реакцияға қатысатын заттардың реакциялық ортаға жеткiзiлуi баяу жүредi, сондықтан көптеген гетерогендiк химиялық реакциялардың жылдамдығы диффузияның жылдамдығына байланысты болады.
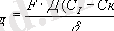
V Д - диффузия жылдамдығы.
Д- диффузия коэффициентi.
Ғ-диф-тың заттық бетi.
С қ -ерiген заттың маңайындағы қаныққан ерiтiндiнiң концентрациясы.
С к -жүйенiң көлемiндегi заттың концентрациясы.
 -диффузия қабатының қалыңдығы.
-диффузия қабатының қалыңдығы.
Қатты заттың бетiндегi негiзгi химиялық реакцияның жылдамдығы әрекеттесетiн заттардың табиғатына, қатты заттың бетiнiң көлемiне, температураға, газ және сұйық заттардың концентрацияларына байланысты болады да, қатты заттың концентрациясына байланысты емес. Мысалы, Мыс (ІІ) оксидi мен сутегiнiң әрекеттесу реакциясын келтiруге болады.
СuO+H 2 =Cu+H 2 O
Бұл реакцияда мыс (ІІ) оксидi және мыс қатты заттар, сутегi мен су, газ тәрiздi заттар. Бұл реакцияның жылдамдығын әрекеттесушi массалар заңына сәйкес былай жазады.
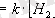
Реакция жылдамдығына қатты заттың концентрациясы әсер етпейтiндiктен теңдеуге мыс (ІІ) оксидiнiң концентрациясы кiрмейдi.
2. Химиялық реакциялардың жылдамдықтарының концентрацияға байланысты артуының мәнiн химиялық кинетиканың негiзгi заңы түсiндiрiп бередi. Бұл заңды Норвег химиктерi К. Гульдберг пен П. Вааге былай қорытындылады.
Химиялық реакцияның жылдамдығы реакцияласушы заттар концентрацияларының көбейтiндiсiне тура пропорционал.
Мыс, гомогендiк реакцияның жалпы түрi:
MA+nC=AC
Бұл реакцияның жылдамдығының математикалық өрнегi мынадай болады:
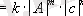
k-жылдамдық константасы.
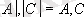 заттардың концентрациялары.
заттардың концентрациялары.
 -стихиометриялық коэффициенттер
-стихиометриялық коэффициенттер
Егер
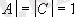 моль/л болса, онда
моль/л болса, онда
 , k-әрекеттесушi зат. Табиғатына және t-тәуелдi өзгередi.
, k-әрекеттесушi зат. Табиғатына және t-тәуелдi өзгередi.
Мыс., СО+Cl
2
=COCl
2
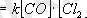
2H
2
+O
2
=2H
2
O
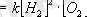
Реакция жылдамдығына әсер ететiн факторлар:
1. Реакция жылдамдығына концентрацияның әсерi. Химиялық реакция тездеу үшiн, реакцияласушы заттардың молекулалары жиi түйiсуi қажет екендiгi анықталады. Түйiсудi жиiлендiру үшiн алдымен реакцияласушы мол екулалардың саныс, демек, концентрациясын өсiру керек.
Мыс., H 2 +J 2 =2HJ
Реакция жылдамдығы 0, 001 мол/млн. Ендi, реакцияласушы заттың бiрiнiң, айталық иодтың концентрациясын 3 есе өсiрдiк, онда иод пен сутектiң молекулаларының белгiлi уақыт iшiнде түйiсу саны үш есе артады, демек, олардың арасындағы реакцияның жылдамдығы да 3 есе артады.
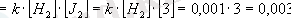
2. Реакцияның жылдамдығына температураның әсерi. Температураның жоғарлауына байланысты химиялық реакцияның жылдамдығы өте көп артады. Реакция жылдамдығына температураның әсерiн жуық мөлшерiн Я. Вант-Гофор ережесi анықтайды:
Температураны 10
 -қа өсiргенде реакция жылдамдығы 2-4 есе артады. Бұл заңның математикалық өрнегi:
-қа өсiргенде реакция жылдамдығы 2-4 есе артады. Бұл заңның математикалық өрнегi:
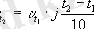
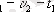 және t
2
температураларындағы реакция жылдамдықтары
және t
2
температураларындағы реакция жылдамдықтары
j-температуралық коэффициент, ол 2, 3, 4 болуы мүмкiн. Мыс., реакцияның температуралық коэффициентi 2-ге тең болып температураны 100 0 арттырғанда реакция жылдамдығы 1024 есе артады.
Химиялық реакциялардың жылдамдығына температура әсерiн швед ғалымы С. Арренустың теңдеуi толығырақ түсiндiредi.
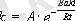
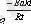 -
реакцияға қатыса алатын активтi энергиясы бар молекулалардың үлесiн көрсетедi.
-
реакцияға қатыса алатын активтi энергиясы бар молекулалардың үлесiн көрсетедi.
А-бiр секундта молекулалар арасында болатын соқтығу.
3. Реакцияның жылдамдығына катализатордың әсерi.
Химиялық реакциялардың жүру жылдамдықтарын арттыру әдiстерiнiң бiрiне катализ жатады. Катализ деп арнаулы заттардың әсерiнен химиялық реакциялар жылдамдығын өзгертетiн құбылысын айтады.
Реакцияның жылдамдығын өзгертетiн, бiрақ реакция нәтижесiнде заттардың құрамына кiрмейтiн заттарды катализаторлар дейдi.
Кейбiр катализаторлар реакция жылдамдығын азайтады, ондай заттарды ингибаторлар дейдi. Бiр катализатор барлық реакциялардың жылдамдығын арттыра бермейдi, тек белгiлi бiр ұқсас реакциялар тобының немесе бiр ғана реакцияның жылдамдығын арттырады.
Реакцияға қатысатын заттардың және катализатордың агрегаттық күйiне байланысты каталитикалық реакциялар гомогендiк және гетерогендiк катализ болып бөлiнедi.
Реакцияға қатысатын заттар мен катализатор бiрдей агрегаттық күйде болса (газ немесе сұйық) болатын каталитикалық реакциялар гомогендiк, ал қатысатын заттар мен катализатор әр түрлi агрегаттық күйде болатын каталтикалық реакцияларды гетерогендiк катализ дейдi.
Мыс., гомогнедiк катализ
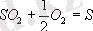
реакциясы өте баяу жүредi, ал
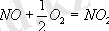 NO
2
-катализатор
NO
2
-катализатор
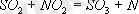 (аралық қосылыс теориясы)
(аралық қосылыс теориясы)
Гетерогендiк катализ (адсорбция теориясы)
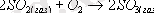
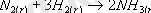
3. Қарапайым химиялық реакция жүру үшiн бiр, екi немесе үш молекула қатысуы мүмкiн. Осыған сәйкес бiр мезгiлде әрекеттесетiн молекулалар санына сәйкес реакциялар бiр молекулалы, екi молекулалы, үш молекулалы болып бөлiнедi. Реакциялардың молекулалығы реакцияға қатысатын молекулалардың ғана санына байланысты болады, ал түзiлетiн заттардың санына байланысты болмайды. Мыс.,
J 2 =J+J (І)
2HJ=H 2 +J 2 (ІІ)
2NO+O 2 =2NO 2 (ІІІ)
Реакцияның ретi кинетикалық теңдеу бойынша анықталады және ол әрекеттесетiн заттар концентрацияларының дәреже көрсеткiштерiнiң қосындысына тең.
Химиялық реакциялардың ретi нөлiншi, бiрiншi, екiншi, үшiншi және бөлшектi болып бөлiнедi. Бөлшектi рет бiрнеше сатылардан тұратын күрделi реакцияларға тән. Нөлiншi реттi реакциялардың жылдамдығы уақыт өткен сайын өзгермейдi. Бiрiншi реттi реакциялардың книетикалық теңдеуi мынадай:
 мыс., J
2
=J+J,
мыс., J
2
=J+J,
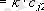
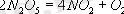
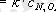
Екiншi реттi реакцияларды мынадай кинетикалық теңдеу сипаттайды.
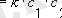
Мыс., H
2
+J
2
=2HJ
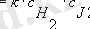 s
s
Жай және күрделi реакциялар
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz