Тотығу-тотықсыздану реакцияларының негіздері, түрлері және теңдеулерін теңестіру әдістері


Тотығу-тотықсыздану реакциялары
Тотығу- жөнінде түсінік
Күнделікті өмірімізде тотығу-тотықсыздану реакциялары жиі ұшырасады. Тірі организмдердің оттеггіні жұтып, көмір қышқыл газын шығаруы немесе керісінше фотосинтез реакциясы, металл бұйымдардың тат басып бүлінуі, тамақ өнімдерінің ашуы, газ, отын, мұнай өнімдерінің жануы бәрі де тотығу-тотықсыздану реакцияларына мысал бола алады. Енді осы тотығу-тотықсыздану реакцияларымен кеңірек танысалық.
Зат құрамындағы атомдардың немесе иондардың тотығу дәрежесі өзгеру арқылы жүретін реакциялар тотығу-тотықсыздану реакциялары деп аталады. Электрондар беріп жіберу нәтижесінде зат құрамындағы атомның немесе ионның тотығу дәрежесінің жоғрылауын тотығу дейді. Мысалы,
Ғе 0 -2е - →Ғе 2+ темір тотықты
Ғе 2+ - е - →Ғе 3+ темір (ІІ) ионы тотықты
Атомдары немесе иондары электроондар беретін заттарды тотықсыздандырғыштар деп атайды. Электрондар беру нәтидесінде тотысыздндырғыш - тотығады.
Мысалы, темір - тотықсыздандырғыш, электрондарын беріп - тотығады.
Электрондар қосып алу нрәтижесінде атомның немесе ионның тотығу дәрежесінің төменндеуін тотықсыздану дейді.
Мысалы, S 0 +2e - = S 2-
Cu 2+ +2e - = Cu
Мұндағы күкірт және мыс иондары электрондарды қосып алып тотықсызданып тұр.
Атомдары немесе иондары электрондар қосып алатын затттарды тотықтырғыштар дейді. Электрондар қосып алу нәтижесінде - тотықтырғыш - тотықсызданады.
Fe 0 +S 0 = Fe 2+ S 2-
Реакция кезінде темір атомы күкірт атомына екі электронын береді. Темірдің тотығу дәрежесі нөлден +2-ге дейін жоғарылап, тотығады. Темір атомы электрондар беретіндіктен тотықсыздандырғыш болып есептеледі. Күкірт атомы темірден екі электрон қосып алып тотығу дәрежесін нөлден-2-ге дейін төмендетеді де, тотықсызданады. Электрон қосып алытындықтан, күкірт тотықтырғыш болып есептелді.
Кез келеген тотығу-тотықсыздану реакциялары жүруі үшін, бұл реакцияға қатысатын заттың біреуі тотықсыздандырғыш, ал екінші біреуі тотықтырғыш боуы керек.
Тотығу-тотықсыздану реакцияларының түрлері
Тотығу - тотықсыздану реакцияларының түрлері өте көп. Тотықсыздандырғыш пен то тықтырғыштың қандай қосылыстардың құрамында болуына және қандай элементтердің тотығу-тотықсыздануына байланысты олар:
- екі түрлі молекулалық қосылыс арасында;
- бір қосылыстағы элементтердің тотығу дәрежелері әртүрлі болып өзгере алатын заттарда;
- қосылыстағы бір элемент әрі тотықтырғыш әрі тотықсыздандырғыш қасиетін атқарған жүйеерде орын алады.
- Екі түрлі молекулалық қосылыс арасындағы тотығу-тотықсыздану реакцияларына мысалдар:
Zn + Cu SO = Zn SO + Cu
Sn +2 Cl 2 + Hg +2 Cl2 ↔︎ Sn +4 Cl 4 + Hg 0
- Бір қосылыстағы элементтердің тотығу дәрежелері әртүрлі болып келеген тотығу-тотықсыздану реакцияларына мысалдар:
NH 4 NO 3 → N 2 O + 2H 2 O
Ni (NO 3 ) 2 = NiO + NO 2 +O 2 0
3) қосылыстағы бір элемент әрі тотықтырғыш әрі тотықсыздандырғыш қасиетін атқаратын тотығу-тотықсыздану реакциялары диспропорциялану деп аталады. Мысалы,
NO 2 + H 2 O = HNO 3 + HNO 2
NaClO→ NaClO 3 + NaCl -1
Маңызды тотықтырғыштар мен тотықсыздандырғыштар
Тотықсыздандырғыштық және тотықтырғыштық қасиет электрон беріп жіберу және қосып алуға негізделгендіктен тотығу дәрежесін - 4 пен+8 аралығында бір қатарға жазалық:
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7 +8
Тотықсыздандырғыштық Тотықтырғыштық
қасиет артады қасиет артады
Тотығу дәрежесінің мәні теріс болып келген тек қана электрон беріп жіберуге бейім элементі бар молекула, ион тттықсыздандырғыш болып табылады.
Тотықсыздандырғыштар қатарына мыналар жатады:
- жай зат металдар:
К - е - → К + ; Ғе - 2е - → Ғе 2+ ;
- жай зат металл еместер сутегі, көміртегі, кремний, яғни электрон беріп жібере алатын атом малекулалар:
Н 2 - 2е - → 2Н +
С - 2е - → С +2 ; С - 4е - →С +4 ;
- электрон беріп жібере алатын иондар:
Sn 2+ -2e - → Sn 4+ Fe 2+ e - → Fe +3
- тотығу дәрежеі теріс немесе оң мәнге қарай жоғарылай алатын күрделі қосылыстар:
N 2 O (N → N → N→ N→ )
HCl (Cl→ Cl→ Cl→ Cl → Cl→ )
NH 3 ( N→ N → N → N → N → N→ )
MnSO 4 (Mn → Mn→ Mn → Mn→ ) .
Тотығу дәрежесінің мәні оң болып келсе және сонымен қатар электрон қосып алуға бейім элементі бар морлекула, ион, бөлшектер тотықтырғыш болып табылады. Олардың қатарына төмендегілерді жатқызуға болады:
- жай зат, металл еместер-оттегі, галогендер, күкірт, озон;
- иондар: Fe3++e-→Fe2+; Sn4++2e-→Sn2+;
- тотығу дәрежесі оң күрделі қосылыстар:
KMnO 4 (Mn +7 → Mn +6 → Mn +4 → Mn +2 → )
KCl (Cl +7 → Cl +4 →Cl +3 → Cl + → Cl 2 0 →)
HNO 3 (N +5 → N +4 → N +3 → N +2 → N + → N 2 0 →)
CrO 3 (Cr +6 → Cr +3 → )
Ag 2 O (Ag + → ) .
Сонымен бірге, электрон қосып рнемесе беріп жібере алатын заттар реакция жүру жағдайына қарай қос түрлі қасиет көрсете береді.
Олардың қатарын асқын тотықтар және тотығу дәрежелері аралық мәнге ие элементі бар молекула, ион, жай заттар жатады.
H 2 O, NO 2, , MnO 2 , P, C, N 2 және т. б.
Тотығу-тотықсыздану реакцияларының теңдеуін құру
Тотығу-тотықсыздану реакцияларының теңдеуін құру үшін тотықсыздандырғыш пен тотытырғышты және олардың беретін және қосып латын электрондарының сандарынн анықтау керек.
Тотықсыздандырғыштың беретін және тотықтырғыштың қосып алытын электрондарының саны олардың реакцияға дейінгі және рекциядан кейінгі тотығу дәрежелерінің өзгеруі арқылы анықталады.
Тотықсыздандырғыш пен тотықтырғыштың коэффициенттерін табу үшін мына ереже қолданылады:
тотықсыздандырғыштың беретін электрондарының жалпы саны тотықтырғыштың қосып алатын электрондарының жалпы санына тең.
Демек, тотықсыздандырғыштың атомдры немесе иондары қанша электрон берсе, тотықтырғыштың атомдары немесе иондары да сонша электрон қосып алуы керек.
Тотығу-тотықсыздану реакцияларының теңдеулерін құруда реакция жүретін орта (қышылдық, негіздік немесе бейтарап) тотықсыздандырғыш пен тотықтырғыртың тотығу дәрежелерінің өзгеруіне әсер ететінін есте сақтау керек. Қышқылдық орта жасау үшін көбінесе сұйытылған күкірт қышқылын, ал негіздік орта жасау үшін калий немесе натрий гидроксидтері ерітінділерін пайдаланады.
Тотықтырғыш, тотықсыздандырғыштар пайдаланылып отырған орта және зат табиғатына қарай әртүрлі деңгейде тотығу дәрежелерін өзгертеді.
Мысалы: тотықсызданған түрі
қышқылдық орта (Н + )
+5е - Mn 2+ түссіз ерітінді
Тотықтырғыш сілтілік орта (ОН - )
MnO 4 2- жасыл түсті ерітінді
ион MnO 4 + е -
бейтарап орта (Н 2 О)
MnO 2 қоңыр түсті тұнба.
+3 е -
қышқылдық орта (Н + )
2H 2 O
Тотықтырғыш +2H + +2 е -
сілтілік орта (ОН - )
+2 е - 2OH -
ион H 2 O 2 бейтарап орта (Н 2 О) 2H 2 O
+2 е -
Ал енді H 2 O 2 өзінен күшті тотықтырғыштармен бірге әрекетескенде тотықсыздандырғыштық қасиет көрсетеді.
Тотықсыздандырғыш қышқылдық орта
H 2 O 2 2H + +O 2
-2
қышқылдық орта
2Cl -
+2 е -
Галогендер сілтілік орта
Cl 2 Cl + + Cl - немесе Cl - + Cl +5
+2 е -
бейтарап орта Cl + + Cl -
Мысалы:
Cl 2 + 2HJ → 2HCl +J 2
Cl 2 +KOH → KClO + KCl + H 2 O
3Cl 2 + 6KOH →KClO 3 + 5KCl + 3H 2 O
Cl 2 + H 2 O → HCl -1 + HCl +1 O
Тотығу - тотықсыздандыру реакцияларының теңдеулерін құру үшін элекетрон теңгеру (электрондық балланс) және ионды-электрондық әдістер жиі қолданылады. Элекрон теңгеру әдісінде тотықтырғыш және тотықсыздандырғыш арасында алынған және беілген электрон сандарын теңгеру арқылы теңестіріледі.
Ионды-электрондық әдісте тотығу және тотықсыздану өзгерістері жеке-жеке жазылып алынады. Сондықтан бұл әдісті, яғни тотығу тотықсыздану құбылыстарын жеке жеке қарастырғандықтан, жартылай өзгеріс әдісі деп те атай береді.
Электрон теңгеру әдісі
Ең бірінші кезекте тотқтырғыштың да тотықсыздандырғыштың да құрамындағы тотығу дәрежесін өзгертетін элемент анықталады. Тотығу дәрежесін молекула бейтараптығын ескере отырып, 6, 4 бөлімде көрсетілгендей етіп анықтайды.
Органиалық қосылыстардағы көміртегі элементінің тотығу дәрежесін анықтау үшін, сутегіден өзге электрлік терістігі төмен элементтердің тотығу дәрежесі пайдалынады.
Мысалы, формльдегидте
O -2
H - C
H
Көміртегі+2, ал құмырсқа қышқылында
O -2
H - C +3
OH -
+3-ке тең тотығу дәрежесін көрсетеді.
Айтқандарымыз түсінікті болу үшін көміртегінің оттегіде жануын қарастырайық. Ол үшін реакция теңдеуін жазып аламыз:
С + О 2 →СО С + О 2 →СО
Бейтарап атом, молекула үшін олардың тотығу дәрежелері нолг тең ендігін ескереміз.
С 0 +
Көміртгі атомы кі немесе төрт элекронын беріп тотыға алады, ал отегі екі элктронды қабылдап тотығу дәрежесін -2-ге дейін өзгертеді, яғни:
С - 2е - → С +2 немесе С - 4е - → С +4
О 2 + 4е - → 2О -2 немесе О 2 + 4е - → 2О -2
Тотықтырғыш және тотықсыздандырғыштағы қосып алған және беріп жіберген электрондар санын көбейткіштерді пайдалана отырып теңестіреміз.
Тотықсыздандырғыш
С - 2е - → С +2 │2 С - 4е - → С +4 │1 тотықты
Тотықтырғыш
О 2 + 4е - → 2О -2 │1 О 2 + 4е - → 2О -2 │тотықсызданды.
Көбейткіш коэффициенттерді тотықсыздандырғыш және тотықтырғыш атомдарына көбейте отырып реакция теңдеуін жазамыз.
С + О 2 =СО С + О 2 =СО 2
Енді, мырыштың тз қышқылымен әрекеттесуін қарастыралық. Ол үшін реакция теңдеуінде әрекеттесуші заттардың ттығу дәрежесін анықтаймыз:
+1-1
Zn 0 + HCl→
Мырыштың тотықсыздандырғыш, ал тұз қышқылындағы сутегі элементінің тотықтырғыш қасиетін ескере отырып, төмендегідей реакция теңдеуін жазамыз:
Zn 0 - 2e - → Zn +2 │1
2H +1 + 2e - → H 2 │ 1
Реакция нәтижесінде тұз және сутегі бөлінетінін жән көбейткіш коэффициенттерді ескере отырып теңдеуді құрамыз:
Zn + HCl= ZnCl 2 + H 2 ↑
Тотығу-тотықсыздану реакцияларының көпшілігі ерітіндіде жүреді және осы ерітіндідегі қышқыл, сілті су молекулалары өзгеріске өзінше әсер етеді.
Енді осы мәселеге тоқталалық.
Электрон теңгеру әдісін ерітінді ортасы қышқылды, сілтілі не бейтарап болғанда пайдалану
Орта қышқылдылығын қышқыл, сілтілігін - исілті ал бейтарап болуын - су малекулаларымен байланыстырады.
Айтқандарымыз түсінікті болуы үшін тікелей мысал қарастырайық.
1-мысал . Қышқылдық ортада калий перманганаты мен күкіртті сутегінің әрекеттесу теңдеуін электрон теңгеру әдісімен теңестір.
Берілген мысалдағы тапсырманы рындау үшін, әрекеттеуші заттрадың формулаларын жазып, тотықтырғыш және тотықсыздандырғышты анықтап тотығу дәрежесінің мәндерін жазамыз:
+1 +7 -2 +1 -2
KMnO 4 + H 2 S +H 2 SO 4 →
Молекуланың электрлі бейтарап екендігінен, мрганецтің тотығу дәрежесі +7, ал күкірттікке -2 екендігін анықтаймыз:
+1(K ) + X (Mn ) + 4* (-2 ) (0 ) =0 X (Mn ) = 8-1=7^
+1 (H ) *2+ X (S ) =0 X (S ) =-2
Қышқылдық ортада марганец тотығу дәрежесін +7-ден +2-ге дейін өзгертетінін ескеріп төмендегідей электрондық теңдік жазамыз:
Mn +7 +5e - →Mn +2
Ал тотықсыздандырғыш күкіртті сутегідегі күкірт, тотығу дәрежесін «-2» ден ең бірінші кезекте «0»-ге онн соң «+2»-ге «+4»- ке өткізе алады. Олай болса, бұл үшін мына теңдік орынды:
S -2 -2e - →S 0
Электрондық теңдеу құрамыз, электронды теңестіреміз:
Тотықтырғыш. Mn +7 +5e - →Mn +2 2 тотықсыздану процесі
Тотықсыздандырғыш S 2- 2e - →S 0 5 тотығу процесі
2Mn 7+ +5S -2 =2Mn +2 +5S 0
Орта - күкірт қышқылы. Күкірт қышқылы 2H + және SO 4 2- иондрынан тұрады. Жүйедегі MnSO 4 және K 2 SO 4 түзеді. Осыны ескеріп, теңдеуді төменлдегідей түрде жазамыз:
2KMnO 4 +5H 2 S + H 2 SO 4 =K 2 SO 4 +2MnSO 4 +5S+
Теңдіктің оң жағында SO 4 - топшасы үшеу, сол жағында біреу. SO 4 -ті теңестіреміз:
2KMnO 4 +5H 2 S + 3H 2 SO 4 =K 2 SO 4 +2MnSO 4 +5S+
Сутегі және оттегі атомдарын санаймыз. Сутегі сол жақта 16, оң жақта жоқ. Осы себепті оң жағына сегіз су молекулаларын қосып жазамыз:
2KMnO 4 +5H 2 S + 3H 2 SO 4 =K 2 SO 4 +2MnSO 4 +5S+8Н 2 О
Тотығу-тотықсыздану реакцияларының жүру бағытын анықтау
Тотығу-тотықсыздану реакцияларын электрондардың тотықтырғышқа беру нәтижесінде жүзге асатындығынан мәлімет алдық.
Ал енді, қатарынан екі тотықтырғыш және бір ғана тотықсыздандырғыш тұрса, онда тотығу-отықсыздану реакцияларының қайсысы жүзеге асуы керекк?
Мысалы, KMnO 4 және K 2 Cr 2 O 7 тотықтырғыштарының ең бірінші қайсысы тотықсыздандырғышпен әрееттесуі керек? Бұл тұрғыдағы сұраққа жауап беру үшін тотығу-тотықсыздану потенциадлдары деген шамадан хабардар болуымыз керек.
Кез-келген затың тотығу-тотықыздану қабілетін сипаттайтын аалған шама анықтама құралдарында арнаулы есте түрінде беріледі. Шартты түрде сутегінің тотығу-тотықсыздану потенциалы нөлге тең деп қабылданады.
Тотығу-тотықсыздану потенциалдарының мәні теріс мәнге ие болып азайған сайын, қарастырылып отырған зат электрон қосып алуға бейім болып, тотықтырғыштық қасиеті арта түседі.
Тотығу-тотықсыздану потенциалдарының мәні оң мәнге артқан сайын, қарастырылып отырған зат электрон қосып алуға бейім болып, тотықсыздандырғыштың қасиеті артады.
Тотығу-тотықсыздану потенциалының мәндерін слыстыра отырып, өзгерістің қайбірі жүретіндігі туралы тұжырым жасайды.
Мысалы қышқылдық ортада KMnO 4 құрамындағы MnO 4 - иондарының тотығу -т отықсыздану потенциаалдары шамамн +1, 52В. Ал K 2 Cr 2 O 7 құрамындағы Cr 2 O 7 2- ионы үшін бұл шама +1, 36В. MnO 4 - ионының тотықтырғыштық қасиеті жоғары екендігін +1, 52 мен+1, 36 шамаларын салыстыра отырып тұжырым жасаймыз. 1, 52В. >1. 36В. болу себепті ең бірінші кезеккте MnO 4 - иондарының тотықсыздануы орын алады. өзгеріс барыснда MnO 4 - концентрациясы да өзгреді және бұл тотығу-тотықсыздану потенциалының мәнін де өзгертеді. Осы өзгерген мән +1, 36-ға жеткенде MnO 4 - иондарымен қоса Cr 2 O 7 2- иондры да тотықсыздана бастайды.
Тотығу-тотықсыздану потенцталының ионконцентрациясына тәуелділігі Нернст теңдуімен беріледі:
Мұндағы
Е 0 - стандартты тотығу-тотықсыздану потенциалы, яғни тотықтырғыш неттықсыздандырғыш концентрациясын 1, 0 моль\л тең болғандағеы потенциал;
С ОХ - тотықтырғыш концентрациясы;
С Red - тотықсыздандырғыш концентрациясы
R-универсалды газ тұрақтысы;
Т - температура, К;
F - Фарадей саны;
z - қарапайым өзгерістің сатысына қатынасатын электрон саны.
Мысалы, қышқылдық ортада тотықсызданатын MnO 4 - иондарының тотығу-тотықсызддану потенциалы төмендегі формул бойынша анықталады:
MnO 4 - +8H + +5e - Mn 2+ +4H 2 O
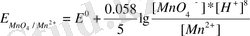
Мұндағы Е 0 - стандартты тотығу-тотықсыздану потенциялы, анықтама құралында келтіріледі, 1, 52В:
0, 058 болса
Тотығу-тотықсыздану потенциалының мәні бойынша ттықсыздандырғыштарды да салыстыруға болады. Бұл жағдайда тотықсыздандрғыштың тотыу-отықсыздану потенциалының мәні теріс болған сайын ол электронды оңай беруге бейім болып тұрады.
Тотықтырғыш пен тотықсыздандырғыштың тотығу-тотықсыздану потенциалдарының айырымы, осы қарастырылып отырған реакция үшін электрлік қозғаушы күш шамасының мәцнін береді және ол ылғи оң шамамен сиптталады. Ал тотығу-тотықсыздану потенциялының мәні оң және теріс таңбаға ие бола береді (Өтелбаев 1-том)
Тотығу-тотықсыздану реакция теңдеулерін А. Гарсиа әдісі бойынша теңестіру
Тотығу-тотықсыздану реакцияларын теңестіру үшін кеңінен қолданылатын әдістердің бірі - А. Гарсиа әдісі. Ол өзінің қарапаймдылығымен тиімді. Оның көмегімен тотығу дәрежелерін анықтау қиын жағдайларда немесе бір элемент бірнеше тотығу дәрежелерін көрсететін жағдайларда да реакция теңдеулерін теңестіруге әбден болады.
Бұл әдістің мәні мынада: химиялық реакцтяның қаңқасын алдымен екі жартылай реакцияға бөлу керек. Олардың біріне тотықтырғыш пен одан түзілген өнімдер кіруі тиіс, ал екіншісіне тотықсыздандырғыш пен одан шыққан өнімдер кіруі керек. Қажет болғанда немесе орта ролін атқаратын басқа заттардың формулаларын қосып жазуға болады. Әр реакцияны жеке-жеке теңестіріп, одан кейін екі жартылай реакция теңдеулерін біріктіріп, қажетті реакция теңдеуін алуға болады.
Жартылай реакцияны теңкестірудің өзіндік ерекшеліктері бар. Алдымен, оттек пен сутектен басқа барлық элементтердің атомдарының саны теңесіріледі. Қажет болса теңдеудің оң жағына немесе сол жағна су молекулаларын қоса отырып, сутек атомдрын теңестіреміз. Сонда теңестірілмеген тек оттек атомдары ғана болады. Оны теңестіру үшін оның жетіспеген атом санын өзіміз қосамыз. Мұндай шартты оттек атомдарын нақты оттек атомдарымен шатастырмас үшін олардың астын сызып қоюға болады, мысалы
Біз біресе қосып, біресе алып отырған шартты отек атомдарының
Иондық реакцияларды теңестіргенде бұған қоса зарядтарды теңестіруіміз керек. Ол үшін қышқыл ортада Н + иондарын, ал сілтілік ортада ОН - иондарын қосамыз.
Жартыай реакцияны теңестіргенде «атомаралық» оттектің орнына реакцияға қатысатын заттардың құрамында бар кез келген басқа элементтерді H, Cl, S, т. б. пайдалануға болады.
Енді А. Гарсиа әдісі түсінікті болуы үшін мысалдар келтірейік:
1-мысал:
As 2 S 3 +HNO 3 +H 2 O → H 2 AsO 4 + H 2 SO 4 +NO
Жартыай реакциялар: As 2 S 3 + H 2 O → H 3 AsO 4 + H 2 SO 4
HNO 3 → NO
Бінші жартылай реакцияға As 2 S 3 және оның құрамына кіретін элементтерден түзілген өнімдер H 2 AsO 4 және H 2 SO 4 кіреді. Олардың құрамына Р және О атомдары кіреді. Олар қайдан келуі мүмкін? Оттек және сутек атомдары судың құрамында бар. Олар судан келуі мүмкін. Сондықтан теңдеудің сол жағына су молекулаларын қосамыз.
Екінші жартылай реакция тотықтырғыш HNO 3 және оның өзгерісінің өнімі NO кіреді.
Жартылай реакцияларды кәдімгі әдіспен теңестіреміз.
Бірінші жартылй реакцияны қарастырамыз. Мышьяк және күкірт атомын теңетіру үшін H 2 AsO 4 алдына 2 және H 2 SO 4 алдына 3 коэффициенттерін қоямыз:
As 2 S 3 +H 2 O →2 H 2 AsO 4 +3H 2 SO 4
Енді сутек атомдарын теңестіреміз. Ол үшін теңдеудің оң жағына қосылып жазылған су молекулаларының алдына 6 коэффициентін қоямыз:
As 2 S 3 +6H 2 O →2 H 2 AsO 4 +3H 2 SO 4
Бұдан кейін теңеспей қалған тек оттек атомдары ғана. Теңдеудің оң жағында 20 оттек атомдары, сол жағында тек 6 оттек атомдары ғана бар. Оны теңестіру үшін теңдеудің оң жағына 14 шартты оттек атомдарын қосамыз:
As 2 S 3 +6H 2 O+14О →2 H 2 AsO 4 +3H 2 SO 4
Енді екінші жартылай реакцияны қарастырайық. Мұнда сутек атомынан тұратын өнім жоқ. Сонда реакцияға қатынасатын азот қышқылының құрамындағы сутек атомдары қайда кетті? Реакция өнімдерінің ішінде азот қышқылының құрамына кіретін элементтерден тұратын су молекулалары бар. Олай болса, теңдеудің оң жағына су молекулаларын қосып, әр элементті теңестіре теңестіруді бастаймыз:
HNO 3 → NO + H 2 O
Азот атомдарының саны екі жақта да бірдей, сондықтан оны теңестіру қажет емес. Сутек атомдарының санын теңестіру үшін HNO 3 формуласының алдына 2 коэффициентін қоямыз.
2HNO 3 → NO + H 2 O
Бұл кезде азот атомының балансы бұзылады. Балансты қалпына келтіру үшін NO алдына 2 коэффициентін қоямыз.
2HNO 3 → 2NO + H 2 O
Енді теңеспеген тек оттек атомдары ғана қалды. Оларды теңестіру үшін теңдеудің оң жағына 3 шартты оттек атомдарын қосамыз:
2HNO 3 → 2NO + H 2 O + 3О
Теңестіргеннен кейін жартылай реакциялар төмендегідей болады:
As 2 S 3 +6H 2 O+14О →2 H 2 AsO 4 +3H 2 SO 4
2HNO 3 → 2NO + H 2 O + 3О
Енді шартты оттек атомдары бойынша баланс құрамыз. Ол үшін бірінші теңдеудің әр мүшесін 3 - ке, ал екінші теңдеудің әр мүшесін 14 - ке көбейтеміз.
As 2 S 3 +6H 2 O+14О →2 H 2 AsO 4 +3H 2 SO 4 3
2HNO 3 → 2NO + H 2 O + 3О 14
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz