Органикалық химияның теориялық негіздері және көмірсутектер: алкандар мен алкендер


2-БӨЛІМ. ДӘРІС КЕШЕНІ
1-БӨЛІМ. ОРГАНИКАЛЫҚ ХИМИЯНЫҢ ТЕОРИЯЛЫҚ НЕГІЗДЕРІ
Глоссарий (анықтама, сөздік)
Изомерлер - құрамы бірдей бірақ кеңістікте орналасу әртүрлі қосылыстар;
Индукциялық эффект - өзара тікелей байланысып тұрған атомдар арасындағы әсер;
Мезомерлік эффект - өзара тікелей байланысып тұрмаған атомдар арасындағы әсер, көміртегі атомы sp 2 , sp гибридтелу жағдайында болған кездегі атомдар арасындағы әсер;
Гомолитикалық- сыртқы электрондық ажырау құблыстары бірдей (симметриялы) бөліну, нәтижесінде дара электроны бар активті бөлшек - радикалдың түзілуі;
Гетеролитикалық- сыртқы электрондық ажырау әртүрлі (симмериялы емес) бөліну, нәтижесінде иондардың түзілуі;
Электрофильді бөлшек- оң зарядты бөлшек;
Нуклеофильді бөлшек - теріс зарядты бөлшек.
Функционалды топ - қосылыстың белгілі топ атомдары және сол топ заттардың маңызды қасиеттерін көрсетеді.
Алмасу реакциялары - айырылып, бір байланыс түзіп және сол жерге ескі атом тобының орнын жаңасы келіп басу реакциясы.
Қосылу реакциялары - екі атом тобы немесе атом қос байланыстың үзілген жеріне қосылу реакциясы
Бөліп алу реакциялары (элиминдеу ) -екі σ - байланысын бір π - байланысымен ауыстыру
Рентгенография - органикалық қосылыстарды рентген сәулесінің көмегімен зерттеу.
Ациклді қосылыстар - ашық көмірсутегі тізбегі күйіндегі заттар.
Карбоциклді қосылыстар - көмірсутегі атомдарының сақиналы тізбек күйіндегі қосылыстар.
Көмірсутек қаңқасы - көміртегі атмдарының тізбегі
Қаныққан көмірсулар - сутегіге бай, сутегі және галоген атомдарын қосып ала алмайды.
Қанықпаған көмірсутектер - қосып алуға бейім.
Изомер - молекулалық массасы және құрамы бірдей, бірақ физикалық және химиялық қасиеттері әртүрлі заттар
Крекинг - жоғары температура немесе қысымның көмегімен бөлу.
1-тақырып. Органикалық химия пәні. А. М. Бутлеровтың құрылыс теориясы
Дәріс мақсаты: органикалық қосылыстардың қасиеті мен құрылысын байланыстыратын жалпы заңдар және заңдылықтарды беру, органикалық реакциялардың типтері мен механизмдерінің маңызын ашу.
1. Органикалық химия пәні
2. А. М. Бутлеровтың құрылыс теориясы
3. Изомерлер, олардың жіктелуі
4. Органикалық реакциялардың типтері мен механизмдері
Органикалық химия - бұл, көміртегінің қосылыстары, олардың құрылысы, қасиеттері, алыну жолдары және практикалық қолданылуы қарастырылатын, химия ғылымының бөлімі. Құрамына көміртегі кіретін қосылыстарды, органикалық қосылыстар деп атаймыз. Көміртегіден басқа, олардың құрамында ылғи да сутегі, сондай-ақ жиі кездесетін - оттегі, азот және галогендер, сирек кездесетін - фосфор, күкірт және басқа да элементтер болады. Бірақ көміртегінің өзі және оның кейбір қарапайым қосылыстары, көміртегі (ІІ) оксиді, көміртегі (ІV) оксиді, көмір қышқылы, карбонаттар, карбиттер және тағы да басқа қосылыстары сияқты, қасиеттерінің сипаттамалары бойынша неорганикалық қосылыстарға жатады. Органикалық қосылыстар - бұл көмірсутектер (көміртегі мен сутегінің қосылыстары) және олардың туындылары. Көміртегі элементінің ерекше қасиеттеріне байланысты, органикалық қосылыстардың түрлері сан алуан. Қазіргі уақытта синтетикалық және табиғи органикалық заттардың 20 миллионнан аса түрлері белгілі, сондай-ақ олардың саны күннен күнге артуда. Қосылыстардың органикалық және бейорганикалық болып бөліну критерииі ретінде олардың элементтік құрамы алынады.
Органикалық қосылыстарға құрамында көміртегісі бар химиялық заттар жатады, мысалы:
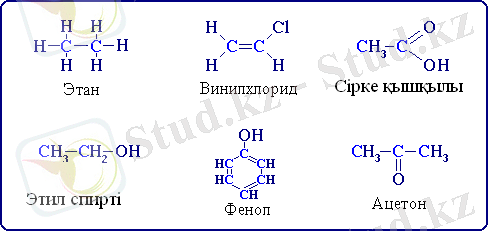
Органикалық қосылыстар бейорганикалық қосылыстардан бірнеше ерекшеліктермен айырылады:
- көбінде барлық органикалық қосылыстар жанады немесе тотықтырғыштармен қыздырғанда СО2бөліп, оңай ыдырайды (бұл белгіге қарап зерттелетін заттың органикалық қосылысқа жататындығын анықтауға болады) ;
- органикаық қосылыстардың молекулаларында көміртегі Периодтық жүйедегі кез келген элементпен байланыса алады;
- органикалық молекулаларда тізбекпен жалғанған көміртегі атомдарының тәртібі сақталады (ашық немесе тұйық) ;
- көптеген органикалық қосылыстардың молекулалары тұрақты иондарға диссоцияланбайды;
- органикалық қосылыстардың реакциялары өте баяу жүреді және де көбінесе аяғына дейін жүрмейді;
- органикалық қосылыстардың ішіндеизомерия құбылысыкеңінен тараған; органикалық заттардың фазалық ауысуы өте төмен температурада жүреді. А. М. Бутлеровтіңатом құрылысы және химияық байланыстың табиғаты туралыэлектрондық (квантохимиялық) көзқарастар және химиялық құрылыс теориясының негізіндедамыған органикалық химияның негізі болып ОРГАНИКАЛЫҚ ҚОСЫЛЫСТАРДЫҢ ҚҰРЫЛЫС ТЕОРИЯСЫ саналады. Дамыған құрылыс теориясы органикалық қосылыстардың химиялық, кеңістіктік және электрондық құрылысына қарап, олардың негізгі химиялық және физикалық қасиеттерін болжауға мүмкіндік береді. Құрылыс теориясы органикалық химияның үлкен нақтылық материалының систематизациялауда және қарастыруда маңызды орын алады, сондай-ақ қажет қасиеттері бар заттарды алуға кеңінен мүмкіндіктер береді.
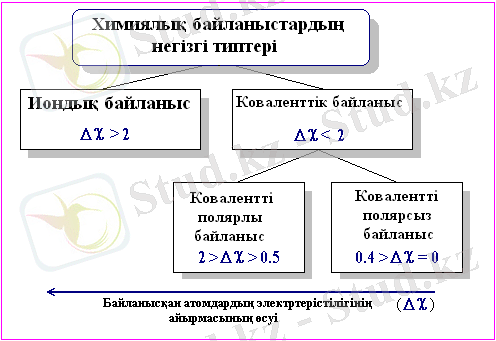
Химиялық байланыстардың негізгі типтері
Бір бірінен электрондық құрылысы мен байланысқан атомдардың әсерлесу механизмімен айырылатын химиялық байланыстардың негізгі типтері болып,
коваленттік
және
иондық
байланыстар саналады.
Байланыс типі көбінесе байланыс түзуге қатысатын элементтердің электртерістілігінің (∆χ) түрлілігімен анықталынады:
∆χ = χ А − χ В ,
мұнда χ А және χ В - А және В атомдарының электртерістілігі.
Органикалық реакциялардың классификациясы
Органикалық реакциялардың классификациясын барлық реакцияларға ортақ белгілердің негізінде жүргізеді: бастапқы және соңғы өнімдердің құрылысы мен құрамы; әрекеттесетін бөлшектердің тотығу дәрежелерінің өзгеруі; реакцияның жылулық эффектісі; оның айналулығы және т. б.
Органикалық реакциялар өте жиі келесідей белгілерге байланысты жіктеледі:
- Реакцияның соңғы нәтижесі бойынша (бастапқы және соңғы өнімдердің құрылысын салыстыру негізінде) ;
- Элементар реакцияға қатысқан бөлшектердің минималды саны бойынша;
- Әрекеттесетін молекулалардың ковалентті байланыстарының үзілу механизмі бойынша. Көпдеңгейлік реакциялардың типі ең баяу өтетін деңгей бойынша анықталады. Классификацияның әртүрлі әдістері жиі бір-бірімен сәйкес келеді.
Өзін өзі бақылау сұрақтары:
- Органикалық химия пәні нені оқытады?
- А. М. Бутлеровтың құрылыс теорисы, оның негізгі қағидалары қандай?
- Гибридтелу типі
- Химиялық байланыстар, ковалентті байланыстардың үзілуі
- Химиялық реакциялардың типтері мен механизмдері
Силлабус соңындағы негізгі әдебиеттер тізімінен 1-18 әдебиеттерді қарастыруға болады.
2-тақырып. Қаныққан көмірсутектер . Алкандар
Дәріс мақсаты: Қаныққан көмірсутектердің құрылысы, номенклатурасы, изомериясы, алынуы, физикалық және химиялық қасиеттерін түсіндіру
- Алкандар. Алкандардың электрондық құрылысы
- Номенклатурасы мен изомериясы
- Алыну жолдары
- Физикалық және химиялық қасиеттері
- Қолданылуы
Қаныққан көмірсутектер (Алкандар, парафиндер) .
Қаныққан көмірсутектер деп молекулаларындағы әрбір көміртек атомдары өзімен көршілес көміртек атомымен байланысуға бір ғана валенттігін жұмсап, қалған бос валенттіктері (көміртектермен байланысуға жұмсалмаған) сутекпен қаныққан көміртек пен сутектің қосылыстарын атайды. Барлық көмірсутек атомдары sp 3 - күйінде болады.
Қаныққан көмірсутектер жалпы фолмуласы C n H 2n+2 . Бұл қатардың негізі - метан.
Тарихи
атауы
Рационалды
атауы
Систематикалық
атауы
СН 3 -СН-СН 3
СН 3
СН 3
СН 3 -СН-С-СН 3
СН 3 СН 3
Триметилизопропил
метан
Номенклатурасы.
Алу тәсілдері.
Қаныққан көмірсутектерді табиғи газдардан фракциялы айдау арқылы немесе мұнайдың бензиндік фракциясынан бөліп алуға болады немесе көмірді сутектендіргенде алынатын көмірсутектері қоспасынан, сонымен қатар көміртек тотығынан және көміртек қос тотығынан да алуға болады.
Лабораторияда алу жолдары.
1. Қанықпаған көмірсутектерді гидрлеу арқылы:
+H 2 (Ni)
СН 2 =CH 2 → CH 3 -CH 3
2. Галоген алкиндерді тотықсыздандыру арқылы:
+H 2
СН 3 -СН 2 I → CH 3 -CH 3
HI
3. Көміртек атомдар саны аз қаныққан көмірсутектер алудың ең маңызды синтетикалық реакциясы натрийді галоген туындыларымен әрекеттестіру болып табылады. Ол Вюрц реакциясы деп аталады:
C 2 H 5 I+2Na+IC 2 H 5 → C 2 H 5 -C 2 H 5
NaI
4. Метал натрийді галоген туындылармен әрекеттестіргенде натрийалкилдер оңай түзіледі, олар одан әрі галогеналкилдермен әрекеттеседі. Шорыгин реакциясы:
C 2 H 5 I+2Na → C 2 H 5 Na+NaI
C 2 H 5 Na+C 2 H 5 I
5. Электролиз арқылы анодта аниондар бос радикалдар түзе отырып, ыдырағанда, олар өзара бірігіп, күрделірек қаныққан көмірсутектер молекуларына бірігеді. Ол Кольбе синтезі:
CH 3 -COONa → CH 3 -COO - +Na +
декорбоксилдеу
CH 3 -COO - → CH3
-е, -СО 2
CH 3 +CH 3 \ → C 2 H 6
6. Көміртек қаңқасын қысқарту арқылы Дюмо реакциясы:
СH 3 COONa+NaOH → CH 4
-Na 2 CO 3
Физикалық қасиеттері.
Қаныққан көмірсутектердің физикалық қасиеттері, басқа органикалық қосылыстар сияқты, олардың құрамы және құрылысымен ажыратылады.
Нормаль тізбекті көмірсутектердің гомолгтық қатарында бастапқы төрт мүшелері қалыпты температурада - газдар одан кейін сұйықтықтар келеді, С 16 Н 34 бастап қатты заттар болып келеді.
Гомологтық қатарда қайнау температурасы өсіп отырады, солай болған жағдайда жақын гомологтардың қайнау температурасының айырымы үнемі кемиді. Нормаль тізбекті көміртек атомдарының изомерлері тармақталған тізбекті изомерлерге қарағанда жоғары температурада қайнайды. Бұл молекулардың сұйық күйінде өз ара шамалы әрекеттесумен сипатталады: негізгі тізбектен шыққан тарамдар молекулардың жақындауына кеңістіктік бөгет жасайды. Тармақталған тізбекті көмірсутектері комплексті қосылыстар түзуге, мысалы мочевинамен бейімділігі аз екеніне көңіл бөлу керек. Сондықтан нормаль изомерлерді тармақталған құрылысты изомерлерден мочевинамен комплекстер түрінде бөліп алуға болады.
Қаныққан көмірсутектер гомологтары қатарында балқу температурасы баяу артады. Бұл кезде қаныққан көмірсутектер жұп және тақ гомологтардың екі қатарын түзеді. Жұп гомологтардың балқу температурасын әдетте тақ гомологтардан болады.
Қаныққан көмірсутектердің тығыздығы алғашқыда жылдам, содан кейін баяулап 0, 78 шамасына дейін артады.
Қаныққан көмірсутектер - полюстенбеген және қиын полюстенетін заттар. Олардың судағы ерігіштігі өте аз.
Қаныққан көмірсутектердің гомологтық қатары сандық өзгерістердің түпкілікті түрде сапалық өзгерістерге айналу заңын жақсы дәлелдейді. Шынында да бірдей атомдар топтарының жиналуы гомологтық айырым СН 2 - қосылуы әр уақытта жаңа көмірсутектің пайда болуына әкеп соқтырады. «Химияны заттардың сандық құрамдары өзгерту әсерінен туып отыратынын сапалық өзгерістер тұрғысындағы ғылым деп атауға болады - дейді Энгельс»
Химиялық қасиеттері.
С-С байланысының ажырау энергиясы көмірсутектердің байланысынан аз бола тұрса да көбінесе қаныққан көмірсутектерге орын басу реакциясы тән. Себебі СН байланыста реагент әсеріне оңай түседі және де радикалдық механизм бойынша жүреді.
1. Гологендеу реакциясы. Сутек атомдарының орнын галогендердің басуы қаныққан көмірсутектерге тән реакциялардың бірі.
hυ
СН 4 +CL 2 → CH 3 CL+HCL
2. Нитрлеу реакциясы. Көмірсутектердегі сутек атомдарының орнын нитро топ баса алады. Парафиндерді концентрациялы азот қышқылы немесе азот қышқылы мен күкірт қышқылының қоспасы тотықтырады. Бұлар сұйытылған азот қышқылымен ғана қыздыру кезінде нитрленеді Ол Коновалов реакциясы деп аталады:
140 0
CH 4 +HONO 2 → CH 3 -NO 2
-HOH
3. Сульфирлеу реакциясы. Парафиндер коцентрациялы күкірт қышқылымен қиын реакцияласады. Қалыпты температурада күкірт қышқылы оларға әсер етпейді. Қыздырғанда тотықтырғыш ретінде әсер етеді. Дегенмен, түтіндейтін күкірт қышқылы жоғарғы парафиндермен реакцияласып сульфоқышқылдар береді:
СН 4 +HOSO 3 H → CH 3 SO 3 H
-HOH
4. Изомерлену реакциясы:
AL 2 O 3
CH 3 -CH 2 -CH 2 -CH 3 → CH 3 -CH-CH 3
CH 3
5. Жану реакциясы:
CH 4 +2O 2 → CO 2 +2H 2 O
Қолданылуы.
Қаныққан көмірсутектердің бірінші қатары - метан - табиғи газдың және мұнайдың қосалқы газының негізгі құрм бөлігі болады. Метан өнеркәсіп және тұрмыстық газ ретінде кеңінен пайдаланылады. Негізінен химиялық жолмен ацитиленге газ күйесіне фтор және хлор туындыларға қайта өңделеді.
Этан этиленге қайта өңделеді. Пропанмен бутанның қоспасы отын ретінде пайдаланылады. Соңғы кездерде бұл көмірсутектер және де изопентан өздеріне сәйкес пропилен, дивинил және изопрен алуға да пайдалынатын болды.
Жоғары сұйықтық және қатты парафиндер отын, майлауға арналған материал ретінде, қатты парафин, озокерит және т. б. түрінде пайдаланылады.
Өзін-өзі бақылау сұрақтары:
1. Алкандар. Алкандардың электрондық құрылысы
2. . Номенклатурасы мен изомериясы
- Алыну жолдары
- Физикалық және химиялық қасиеттері
- Қолданылуы
Негізгі әдебиеттер: 1-5
Қосымша әдебиеттер: 8-16 әдебиеттер.
3-тақырып. Қанықпаған көмірсутектер. Алкендер.
Дәріс мақсаты: Қанықпаған көмірсутектердің құрылысы, номенклатурасы, изомериясы, алынуы, физикалық және химиялық қасиеттерін түсіндіру
1 . Алкендер. Алкендерд»ң электрондық құрылысы
2. Номенклатурасы мен изомериясы
- Алыну жолдары
- Физикалық және химиялық қасиеттері
- Қолданылуы
Қанықпаған көмірсутектер (Алкендер, олефиндер) .
Қанықпаған көмірсутектер деп молекулаларында өзімен жалғас көміртек атомымен байланысуға екі валенттіктен жұмсаған көміртек атомдары бар көміртексутектерді, яғни қос байланыс түзетін көмірсутектерді атайды.
Этилендік көмірсутектер гомологтық қатарының жалпы формуласы С n H 2n , бұлардың ең бастапқы негізі этилен, СН 2 =СН 2 болады.
Изомерия. Номенклатура.
Осы қатардың структуралық изомериясы қаныққан көмірсутектер катарындағыдай қатардың төртінші мүшесінен басталады, алайда изомерлердің саны анағұрлым көп болады. Көміртек тізбегінің құрылысына байланысты изомерлермен қатар, олефиндер қатарында тізбектегі қос байланыстың орнына байланысты структура изомериясы да болады. Бұдан басқа, олефиндер қатарында кеңістік (геометриялық) изомериясы цис-транс-изомерия деп аталатын изомерия да болады. Цис-изомерлерде қос байланысты көміртектегі белгілі атомдар (жеке жағдайда бір түрлі) немесе атомдар топтары осы қос байланыстың бір жағында болады, ал транс-изомерлер әр жақта болады:

олефиндер қатарындағы геометриялық цис-транс-изомериясының болуы екі көміртек атомдары арасындағы байланыс осі бойынша бос айналуға σ-байланыстың мүмкіндік бермеуіне байланысты. Геометриялық изомердің бір түрінің басқа түрге көшуі тек жоғары температурада, жылылық энергия σ-байланысты нашарлатуға жеткілікті болғанда ғана мүмкін болады, жарық түсіп сәуле энергиясын сіңіргенде немесе σ-байланыстары катализаторлардың әсерінен нашарлағанда болады.
Алу тәсілдері.
Олефиндер кейбір мұнайларда кездеседі. Бұлар әсіресе Канада мұнайында көп. Мұнайдан таза күйінде С 6 Н 2 -ден С 3 Н 2 б-ға дейін көмірсутектер бөлініп алынған.
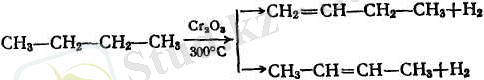
1. Олефиндер қатарынық алғашқы төрт мүшелері таза күйінде техникада мұнай дистилляттарының крекинг өнімдерінін, газ түріндегі бөліктерінен қысыммен немесе төменгі температурада айдау арқылы және кокстау газдарынан (этилен, пропилен) бөлініп алынады.
Кейбір олефиндер техникалық мақсат үшін крекинг газдары және басқа өнеркәсіптік көздерден бөлініп алынарлық мөлшерден анағұрлым көп мөлшерде керек, сондықтан бұларды техникада қаныққан көмірсутектерді сутексіздендіру әдісімен алу кеңірек тарап келеді. Бұл процестің катализаторы ретінде әдетте әдейі арналып дайындалған хром тотығы қолданылады:
2. Лабораториялық жағдайларда олефиндерді алудың ең көбірек қолданылатын тәсілі спирттерді сусыздандыру (суды бөліп алу) :
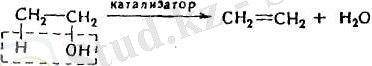
Осы сияқты үзіп алу реакциялары Е и Е 2 символдарымен көрсетіледі (бірінші немесе екінші реттік элиминирлеу реакциялары)
Сусыздандыру катализаторлары ретінде әр түрлі қышқылдар (күкірт, фосфор қышқылдары), қышқыл тұздар (КНSО 4 ) қышқылдар ангидридтері (Р 2 О 5 ), алюминий тотығы, алюминий тұздары және басқалар пайдаланылады.
Спирттің тегіне байланысты сусыздандырудың әр түрлі жағдайларын қолдануды қажет етеді. Әсіресе үшіншілік спирттер онай сусызданады: олар қайта айдау кезінде суды жиі үзіп алады.
Судың үзіліп алыну реті көпшілік жағдайда Зайцевтің қағидасы бойыңша жүреді: су түзілгенде сутек жалғасып тұрған ең аз сутектенген (гидрогенденген) көміртектің атомынан үзіліп алынады. Бұл сутек көбінесе қозғалмалы келеді.
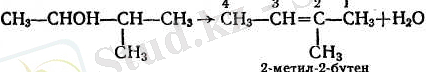
3. Олефиндерді галоген туындылардан галогенсутектерін немесе галогендерді үзіп алу арқылы жиі алады.
Моногалоген туындылар сілтілермен әрекеттескенде (дегидрогалогенлеүі олефиндер алынады.
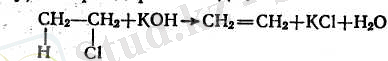
Олефиндер алу үшін кейде вицинальдық 1 дигалоген туындылардан галогендер үзіп алу әдісінде пайдаланылады. Қөбінесе бұны мырыш тозаңының немесе жаңқасының су-спирт ерітіндісінін көмегімен пайдаланып жүргізеді:
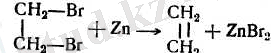
4. Кейбір жағдайларда белгілі құрылысты ацетилендік көмірсутектер құрылысы осылармен сәйкес олефиндерден гөрі оңайырақ алынады. Осындай жағдайларда олефиндерді ацетилендік көмірсутектерді жартылай «селективті» сутектендіру арқылы алады, мысалы паллади катализаторы үстінде:
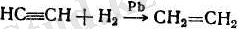
Физикалық қасиеттері. Этилендік көмірсутектер гомологтар қатарының алғашқы төрт мүшелері газдар. 5-тен 17-ге дейін көміртек атомдары бар олефиндер - сұйықтықтар. Одан әрі қарай қатты заттар келеді.
Қөміртек атомдары нормальді тізбекті олефиндер өздерінің тармақталған тізбекті изомерлерінен гөрі жоғарыраіқ температурада қайнайды. Қос байланыстың молекуласы ортасына жылжуы қайнау температурасын жоғарылатады. Цис-изомерлер әдетте трансизомерлерден гөрі жоғарырақ темпертурада қайнайды.
Қос байланыстың молекуланың ортасына жылжуы балқу температурасын жоғарылатады. Тракс-изомерлер цис-изомерлерден гөрі жоғарырақ температурада балқиды.
Олефиндердің тығыздықтары бірден кем, бірақ сәйкес парафиндердікінен артық. Гомологтық қатарда тығыздықтары артады.
Олефиндердің. суда ерігіштігі тіпті аз, бірақ парафиндерге қарағанда көп. Олефиндер кейбір ауыр металдардың тұздарының ерітінділерінде комплекстік қосылыстар түзе отырып жақсы еритіндігін ескерте кету керек (мысалы, жартылай хлорлы мыс ерітінділерінде) .
Олефиндер үшін инфрақызыл сәулелерді 6-6, 5 және 10- 12 (і (1670-1560 және 1000-830 см~ 1 ) облыстарында іріктеп сіңіруі тән, сондықтан инфрақызыл спектрлер олефиндердің құрылысын тағайындауда зор табыспен пайдаланып отыр.
Химиялық қасиеттері. Олефиндердің реакциялық қабілетін көрсететін негізгі структуралық элемент болып, бұлардың сәйкес а және я-байланыстарынан тұратын қос байланысы болады. қос-байланыс σ-байланыстан гөрі берік болғандықтан σ-байланыс үзіліп, қос байланыс орнына екі атомдар немесе атомдық топтардың бірігуі арқылы а-байланысқа оңай айналады. Мұндай бірігу жылдамдығы қосып алатын молекулалардың және қос байланыстық орынбасарларының түріне байланысты ажыратылады.
Сөйтіп, олефиндерге көбінесе қосып алу реакциялары тән. Дегенмен, олефиндер орын басу реакцияларына қабілетті және кейбіреулері парафиндерге қарағанда анағұрлым жеңіл жүретінін ескеру қажет. Қос байланысты а-орындағы көміртектің сутек атомы көбінесе орын басуға бейімірек келеді.
1 Олефиндер катализаторлардың қатысуымен сутекті қосып алады (53 бет) . Катализаторсыз молекулалық сутекті немесе бөлу кезіндегі сутекті бұлар біріктірмейді.
Сутектендіру үшін катализатордағы олефин молекуласының қос байланысы бойынша адсорбциялану қажет болғандықтан, қос байланыстың орынбасарлары неғұрлым кіші болса, олефиндер соғұрлым оңай сутектенеді (С. В. Лебедевтің қағидасы) .
2. Олефиндер галогендерді оңай қосып алады:
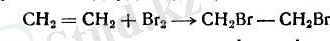
Реакцияның жылдамдығы галогеннің тегіне және олефиннің
құрылысына байланысты. Фтор реакцияласқанда тұтану болғанда,
1
иод күн сәулесінде тұтанады. Қос байланыстың орынбасарларының саны көбейген сайын қосып алу реакциясы жеңілдейді Бұл орын басушы радикалдардық әсерінен осы байланыстың полюстілігінің үлкеюі бойынша түсіндіріледі. _.
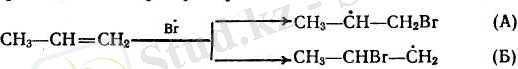
Галогендер олефиндерге радикалдық немесе иондық механизм бойынша біріге алады.
Галогеннің атомдары радикалдық бойынша біріккенде (әдетте мына схема бойынша алынады: Вг 2 жары > к 2Вг') мүмкін болатын ең тұрақты радикалдарды түзе отырып, ашық тұрған көміртек атомдарының біреуімен қосылады. Мысалы, пропилен болған жағлайла екі радикалдын түзілуі мүмкін:
Галогенсутектердің симметриялы емес олефиндерге бірігуі В. В. Марковниковтың ережесіне сәйкес жүреді: қос байланыстағы көміртектердің қайсысында сутегісі көп соған протон немесе сутегі ал сутегісі азына гологен қосылады.
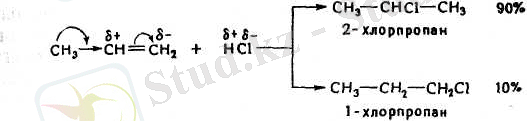
Галогенсутектің бірігуінің бұлай бірыңғай бағыт алуын былай түсіндіруге болады: қос байланысты көміртек атомдарының қасындағы радикалдар электрон бұлтын өздерінен ығыстыратын қабілеті бар (индукциялық эффект тура стрелкамен қосарланатын эффект иілген стрелкамен көрсетілген), осының себебінен қос байланыстың электрондары шеткі көміртек атомына жылжиды да, ол көбірек теріс электрленіп галогенсутектің протонын екінші көміртек атомынан гөрі күштірек тартатын болады. Бұдан басқа, реакцияның бірінші сатысында түзілетін катиондар тұрақтылығының да манызы болады: катион А катион Б-дан гөрі тұрақтырақ, өйткені бұның қосарланатындығы айқынырақ болып тұр (А катионның бос орбитасы бСН-байланыстарының электрондарымен, ал Б катионында 2СН-бйланыстарымен ғана әрекеттесіп тұр.
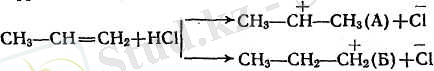
Реакцияның екінші сатысында галогеннің анионын екі катион да қосып алады.
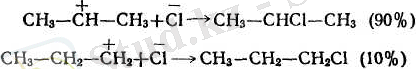
Марковниковтың ережесі галогенсутектердің иондық (гетеролитикалық) механизмі бойынша бірігуінде ғана сақталады. Егерде механизм радикалдық (гомолитикалық) болса, онда галогенсутекті қосып алу кері жүреді (хараштың асқын тотық эффектісі) . _.
1. Алкендер. Алкендердің электрондық құрылысы
2. . Номенклатурасы мен изомериясы
- Алыну жолдары
- Физикалық және химиялық қасиеттері
- Қолданылуы
Негізгі әдебиеттер: 1-5
Қосымша әдебиеттер: 8-16 әдебиеттер.
4-тақырып. Алкиндер. Алкадиендер .
Дәріс мақсаты: Алкиндардың электрондық құрылысы, номенклатурасы мен изомериясы, алыну жолдары, физикалық және химиялық қасиеттері, қолданылуы
1. Алкиндер. Алкадиенднр. Алкиндердің электрондық құрылысы
2. Номенклатурасы мен изомериясы
- Алыну жолдары
- Физикалық және химиялық қасиеттері
- Қолданылуы
Алкиндер.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz