Гендік инженерия негіздері, трансгендік ағзалар және медицина-фармациядағы қолданылуы мен биоқауіпсіздік


ОҢТҮСТІК ҚАЗАҚСТАН МЕМЛЕКЕТТІК ФАРМАЦЕВТИКА АКАДЕМИЯСЫ
Биохимия, биология және микробиология кафедрасы
СӨЖ
Тақырыбы: Гендік инженерия негіздері. Трансгендік ағзалар, медицинамен фармацияда қолданылуы.
Орындаған: Темірбек Н.
Тобы: 102 «А» МПД
Қабылдаған: Есиркепов М.
Шымкент 2015ж.
Жоспар:
І Кіріспе
І І Негізгі бөлім
- Гендік инженерия
- Трансгендік ағзалар
- Фармация мен медицинада қолданылуы
ІІІ Қорытынды
Пайдаланылған әдебиеттер
Гендік инженерия
Гендік инженерия - молекулалық және клеткалық генетиканың қолданбалы саласы. Белгілі қасиеттері бар генетикалық материалдарды In vitro жағдайында алдын-ала құрастырып, оларды тірі клеткаға енгізіп, көбейтіп, зат алмасу процесін өзгеше жүргізу. Бұл әдіспен организмдердегі генетикалық информацияны көздеген мақсатқа сай өзгертіп, олардың геномдарын белгіленген жоспармен қайта құруға болады.
Гендік инженерия ол функционалдық активті генетикалық құрылымдарды рекомбинаттық ДНҚ молекулалары түрінде қолдан құрастыру. Гендік иженерияның мәні жеке гендерді бір организмнен алып басқа организмге көшіру. Бұған рестриктаза мен лигаза ферменттерінің ашылуы мүмкіндік туғызады. Рестриктазалар ДНҚ молекуласын белгілі жерлерден жеке үзінділерге қиып бөлшектейтін ыдыратушы фермент. Қазір ДНҚ молекуласын бір-бірінен өзгеше 120 жерінен үзетін 500-ден астам рестриктазалар анықталған. Алынған полинуклеотид бөлшектерінінің комплементарлық немесе жабысқыш ұштарын ДНҚ лигазасы - бір-біріне желімдеп реттеп жалғасытырып қосады. Осы ферменттердің көмегімен бір ДНҚ молекуласынан қажетті ген бөлініп алынып, басқа ДНҚ молекуласын үзінділерімен құрастырылып рекомбинанттық, яғни жаңа будан ДНҚ жасалады.
Одан кейін рекомбинанттық ДНҚ бірнеше әдістермен тірі клеткаға енгізіледі. Жаңа геннің экспрессиясы өтеді де клетка сол ген белгілейтін белокты синтездей бастайды. Сонымен, клеткаға рекомбинанттық ДНҚ молекуласы түрінде жаңа генетикалық информация енгізіп, ақырында жаңа белгісі бар организмді алуға болады. Бұндай организмді трансгендік немесе трансформацияланған организм деп атайды, себебі организмдер өзгеріп басқа қасиетке ие болуын трансформация дейді.
Сөйтіп, гендік инженерияның дамуына негіз болған молекулалық биология мен молекулалық генетиканың мынадай жетістіктері:
1. рестректазалармен лигазалардың ашылуы;
2. генді химиялық және ферменттерді қолдану арқылы синтездеу әдісі ;
3. бөтен генді клеткаға тасымалдаушы векторларды пайдалану;
4. бөтен генге ие болған клеткаларды таңдап бөліп алу жолдарының ашылуы.
Алғашқы рет рекомбинаттық ДНҚ 1972 жылы АҚШ та Стенфорд университетінде П. Бергтің лабораториясында жасалған. Онда проберка ішінде үш түрлі микроорганизмнің ДНҚ-лары - лямбда фагтің және шек таяқшасы бактериясының ДНҚ фрагменттері мен маймылдың онкогендік вирусының толық геномы қосылған еді.
Өсімдіктердің гендік инженериясы саласында бірінші жұмыстар In vitro өсірілетін клеткалармен 1980 жылы жүргізілген. 1983 жылы алдымен күнбағыстың трансгендік каллусы, кейін сол каллустан табиғатта мүлдем болмаған санбин өсімдігі алынды.
Санбин деген ол геномында бұршақтың белогі фазеолинді кодтайтын гендері бар күнбағыс өсімдігі еді.
Гендік инженерия гендерді тасымалдау тәсілі ретінде болашақта екпе өсімдіктердің селекциясының тиімді аспабы бола алады. Қазіргі кезде гендік инженерия алғашқы қадамдарын басып, екпінді дамып келеді.
Гендік инженерияның әдістемелік негізі жарықтың мезофилл клеткаларының немесе каллус ұлпасының протопластары болады. Жаңа генетиканың информацияға ие болған протоплаты өсіріп одан регенерант өсімдігін алуға болады. Генетикалық трансформация үшін сомалық клеткалардан басқа тозаң клеткалары, жұмыртқа клеткасы қолданылады. Сонымен, In vitro өсірілетін клеткаларға гендік инженерияның әдістерін қолданып, өсімдіктің бағалы белгілері бар негізінде жаңа формаларын құруға болады.
Гендік инженерияның жұмысы мынадай кезеңдерден тұрады:
1. басқа организмге көшірілетін құрылымдық генді алу;
2. оны вектордың құрамына енгізу, яғни рекомбинанттық ДНҚ жасау;
3. рекомбинанттық ДНҚ-ны организм клеткасына тасымалдау;
4. организм клеткаларда бөтен ДНҚ-ның экспрессиясын талдау;
5. геномы өзгерген жеке клеткалардан регенерант нәтижесін алу.
Гендерді тасымалдайтын векторлар
Бөтен генді клетка ішіне тасымалдап алып баратын арнаулы ДНҚ молекуласын вектор деп атайды. Оған мынадай талаптар қойылады:
1. өз алдына репликациялану, яғни клетка ішіне бөтен генді алып кірген соң клеткамен бірге немесе өзалдына көбейе алатын болуы керек; немесе вектор клетка хромосомасының құрамына еніп, онымен бірге ұрпақ клеткаларға беріліп отыруы керек;
2. трансформацияланған клеткаларды анықтау үшін оның ерекше генетикалық белгілері болуы керек;
3. құрамында рестриктазалар үзе алатын нуклеотидтер тізбегі болуы керек және репликацияға қабілетін жоғалтпауы керек;
4. векторға орналастырылған бөтен ген оның атқаратын қызметін бұзбауы керек, ал вектор болса, ол да енгізілген геннің ішінде дұрыс реттеліп жұмыс істеуін қамтамасыз ететін болуы керек;
5. вектордың көлемі кішігірім болуы керек.
Генетикалық инженерия туындау кезінен бастап ғалымдар қоғамда кейбір зерттеулердің қауіптілігіне назар аудартты. Мұндай қорқыныштын туындаған қауіпсіздік пікір 1974 жылы айтылған болатын. Кейін бірнеше сәтті эксперименттен соң in vitro әдісі арқылы рекомбинантты молекуланың ДНҚ алынды. П. Берг бастаған әйгілі молекулярлы биологтар тобы гендік инженерия эксперименттерін жүргізуді шектеуге шақырды. Айтылған пікір екі жақты болды. Алдымен рекомбинантты ДНҚ молекулаларының зертхана сыртында немесе өнеркәсіп орнында шынымен жасушалардың «жоғалып» кетуі ескертілсе, сонымен қатар адам және жануарлар ағзасына келтірілетін зиян бақылаусыз концентрацияда өте жоғары екендігі айтылды. Екіншіден клондалған ДНҚ фрагментіндегі құрылымы мен қызметі туралы білімнің жетіспеушілігі, оларды реципиентті жасушаға енгізгенде олар қалаған затымызды ғана емес, одан да басқа қауіпті (токсиндер, онкоген) өнімдерді синтездеу ықтимал.
1975 жылы бұл мәселелер Халықаралық конференцияларда сөз болды, онда рекомбинантты ДНҚ молекулаларын алу сұрағына тоқталды. Онда биологиялық әр аумағын зерттейтін ғалымдар (медициналық микробиологтар, бактериальді генетиктер, эпидемиологтар, биохимикиер, ботаниктер, даму биологтар т. б. ) және заңгерлер, ақпарат көздерінің мүшелері, мемлекеттік және жеке өнеркәсіп иелері қатысты. Конференцияға қатысушылар гендік инженерия әдісімен жүретін эксперименттер жалғасуы керек деп шешті, бірақ белгігленген ережелер мен ұсыныстарды сақтауы қажет. Бұл ережелер келесі жылдары Англия, АҚШ, Франция мен басқа елдерде жасалынды. Олар бірнеше рет қайта қаралып, жеңілдіктер ұсынылды, себебі жинақталған мәліметтер олардың шектен тыс қаталдығын дәлеледеді, әсіресе дәстүрлі зертханалық штаммдармен жұмыс істеуге қатысты.
Генотипке әсер ету адам, өсімдік, жануарлар мен қоршаған орта үшін қайта қалпына келмес өзгерістерге ұшыратуы мүмкін. Бақылаудан шығып кеткен немесе арнайы дайындалған генетикалық агенттер, тіршілікті жоятын, әдейілеп қолданылуы оларды биологиялық қару деп қарауға құқық береді.
Дамыған елдерде азық-түлік сапасын бақылау оның шығаруына дейін жүзеге асады, ал дамушы елдерде - шыққаннан кейін.
Трансгенді өнімдердің шығуына тыйым салудан жеңілген кей ұйымдар енді оларға арнайы маркировка берілуін талап етіп отыр. ТМД елдерінде биоқауіпсіздік туралы заң қабылдауды - «Гендік-инженерия әрекеті аумағында мемлекеттік бақылау жүгізу туралы».
Қазақстанда гендік-инженерия өнімдері мен препараттарын маркілеу жөніндегі келісім шартқа қол қойды.
Генетикалық модифицирленген микроорганизмдерді қолдануға байланысты қатерді бағалау. Барлық микроорганизмдар адам үшін патогендік көзқарас тұрғысынан төрт қатерлі топқа бөлінеді:
1. қауіп тобы: адам ауруын қоздырмайтындар
2. қауіп тобы: олар мен кім жұмыс жасап отырғандарда ауру тудырады. Алайда микробтра жалпы алғанда азконтагиозды (мысалы, E. coli, Mycoplasma pneumoniae, адам папилома вирусы) .
3. қауіп тобы: адамда ауру тудырады және олармен жұмыс жасушаларға да қауіп тудырады. Қоғамда тарап кету қауіпі бар, бірақ алдын алу шаралары да бар. (Bacillus anthracis, Mycobacterium leprae, АИВ)
4. қауіп тобы: олармен жұмыс жасушаларда ауру тударады, қоғамда тарап кету қауіпі бар, алдын алу шаралары жоқ. (мысалы - геморрагиялық безгек вирусы) . 2-4 топтары патогендік микроорганизмдар біріктіреді. Топтың нөмірі қауіп түрін анықтайды және қорғаныс шараларын да қамтамасыз етеді. Бұл деңгей үшін GLP ( Good Laboratory Practice) ережелер міндетті. Модифицирленген генетикалық микроорганизмдерді ұстау деңгейін анықтау үшін « Генетикалық модификацияны халықаралық бақылау камитетінің ережелері» (1993) бар.
Арнайы кесте бойынша вектор типі анықталады (өз бетінше мобилизденуші - өз бетінше хромосомаға тіркелуші, нашар мобилизденуші немесе мүлдем мобилизденбеуші) екеуі де түзілуші векторды керек етеді.
Иесінің түрін де есепке алады (жабайы, әлсіз, ауксотроф), промотор астында трансгенді құрылымды кіргізуші түр (максималды экспрессиялы, күшті, әлсіз, арнайы-сайт, дефектілі) және өнімдердің қатерлілігі (улы заттар, БАВ бұзушы әсері бар, аз бұзушы әсерлі, мүлдем әсерсіз, ДНҚ кодталмайтын бірізділігі) .
Биотехнологияның тағы бір өрісі, ол биоинженерия әдістерін қолданып медицинада арзан әрі қол жетімді, экономикалық жағынан тиімді дәрілік препараттар мен вакциналар алу болып табылады. .
Гендік инженерия ол функционалдық активті генетикалық құрылымдарды рекомбинаттық ДНҚ молекулалары түрінде қолдан құрастыру. Гендік иженерияның мәні жеке гендерді бір организмнен алып басқа организмге көшіру.
Биотехнология ғылыми-техникалық прогресстің қуатты қозғаушы күші болып келе жатыр. Биология ғылымының сонғы жылдардағы жетістіктері, әсіресе молекулалық биология мен клеткалық биология саласында, биотехнологияның қалыптасуы мен дамуының теориялық және әдістемелік негіздері болды. Сонымен қатар, биотехнология биологиялық процестермен объектілерді пайдаланып экономика жағынан маңызды заттарды (антибиотиктер, витаминдер, ферменттер, амин қышқылдары, белоктар, нуклеотидтер, стероидтар, алкалоидтар, интерферон, гормондар, вакциналар, моноклондық антиденелер, биопестицидтер, биогаз т. с. с. ) шығаратын өндірістің ерекше бір саласы болып қалыптасты. Демек, азық-түлік, фармацевтикалық, химиялық өнеркәсіптері мен ауыл шаруашылығының болашақта дамуы биологиялық технологияларсыз мүмкін емес.
Биологиялық қауіпсіздік - адамзаттың ең басты міндеттерінің бірі.
1975 жылы биоқауіпсіздік туралы Халықаралық конференцияда (Асиломар, Колифорния) рекомбинантты ДНҚ молекуласы экспериментінің негізгі қағидасы қабылданды.
Биологиялық және физиологиялық қауіпсіздікті таңдау нақты бір гендік инженерлік экспериментке байланысты. Клондалушы ДНҚ тазалығы, сипаттамасы, ұзындығы және т. б. қасиеттеріне қарай анықталады.
Қазіргі уақытта гендік инженерия жоспары 1996 жылы қабылданған заңмен қадағалынады. Олар екі түрге бөлінеді - «жабық» немесе «ашық» жүйеде жүретіндер. Жабық жүйелі жұмыстарда гендік-инженерия ағзаларымен қоршаған орта арасында химиялық, биологиялық, физикалық барьер бар. Ашық жүйеде мұндай контакт ашық түрде жүзеге асырылады (мысалы, генді-инженерияның көкеністерді культивирлеуі) .
Жабық жүйедегі жұмыстар қатерлі деңгейіне қарай төрт топқа бөлінеді:
1. Жұмыс адам денсаулығына зиянын келтірмейді. Қауіпсіз шаралары патогенді емес микроорганизмдермен жұмыс істегенмен бірдей.
2. Жұмыс адам денсаулығына шамалы қауіп төндіреді. Қауіпсіздік шаралары белгілі бір жағдайлардағы патогенді микроорганизмдермен салыстырғандай.
3. Жұмыс адам денсаулығына біршама қатер туғызады. Қауіпсіздік шаралары инфекциялық аурулардың жұғуы ықтимал микроорганизмдермен жасаған жұмыс кезіндей.
4. Жұмыс адам денсаулығына едәір қауіп туғызады. Қауіпсіздік шаралары өте қатерлі аурулар тудыратын микроорганизмдермен жұмыс жасағандай.
Жұмыс кезінде биологиялық агенттердің қоршаған ортаға, адамға таралуын тоқтататын және дене бітімін қорғау үшін арнайы құралдармен қондырғыларды құрастыру мен қолдану қажет. Бұл шаралар өз сипаттамасына қарай көптеген жылдар бойы медициналық, микробиологиялық және вирусологиялық зертханаларда қауіпті микроорганизмдермен жұмыс істегендегі қауіпсіздікпен бірдей. Физиологиялық қорғаныстың минимальді (ф1) деңгейі (арнайы қорғаныс құралынсыз жасалатын жұмыс) қауіпсіз микроорганизмдермен жұмыс жасағанда қолданылады. Төменгі (Ф2) деңгей биоматериалдарды (рекомбинантты ДНҚ) арнайы бокстер мен герметизациялық ыдыстарға қатаң бөліп сақтау арқылы жүзеге асады. Орташа (ф3) деңгей физиологиялық қорғаныстың қатерлі объектілермен жұмыс жасағанда қажет. Ол бүкіл зертхананы герментизациялау арқылы жасалады, бірақ органдардан бөлінбейді. Адам денсаулығына, өсімдік, жасушаларға өте қауіпті микроорганизмдермен жұмыс істегенде жоғары (ф4) деңгейі физиологиялық қорғаныс болуы керек. Мұнда зертхананы толығымен бөліп изоляциялайды.
Биологиялық қорғаныс үшін құрастырылып отырған рДНҚ потенциалды қатерінің үш деңгейі қарастырылған. Б1 (ең әлсіз қорғаныс) E. coli К-12 жасушаларын қолданғанда және конъюгативті плазмид пен бактериофаг негізінде алынған векторларды қолдануға пайдаланады. Б2 деңгейі клондалушы ДНҚ фрагменттері, қоршаған ортаға көшуінің 10 -ден болған жағдайда қамтамасыз етіледі. Б3 деңгейі вектор жасушасының Б2 типінің жүйесін қолданғанда, жануарларда сыналған немесе табиғи экологиялық жағдайда апробацияланған кезінде қолдануды көздейді.
Биологиялық және физиологиялық қауіпсіздікті таңдау нақты бір гендік инженерлік экспериментке байланысты. Клондалушы ДНҚ тазалығы, сипаттамасы, ұзындығы және т. б. қасиеттеріне қарай анықталады.
Трансгендік ағзалар
Трансгенді немесе трансформацияланған ағзалар деп - геномында бөтен ген бар өсімдіктерді, микроағзаларды, вирустарды, жануарларды айтады.
Трансгенді жануарлар алу трансгеноз әдісі арқылы іске асады. Ал, трансгеноз дегеніміз - генді бір биологиялық жүйеден басқа жүйеге жаңа белгілері бар организмнің формасын алу үшін жасанды жолмен тасымалдауды айтамыз.
Трансгенді ағзалар әр түрлі биологиялық активті биотехнологиялық заттарды синтездеу және бағалы белгілері бар жануарлардың жаңа тұқымдарын алу үшін қолданылады. Трансгеноз әдісімен бөтен генді эукариоттық жыныс клеткаға енгізіп, оның жұмысын бақылау арқылы генетикалық инженерияның көптеген мәселелерін айқындауға болады, өйткені мұнда трансгенді эмбрионның жатырдағы даму ерекшеліктерін зерттеу мүмкін болады. Тасымалданған гендер (трансгендер) генетикалық аппаратымен құрылымды ірі функциялы байланысқандықтан бұл процесс жағдайындағы генетикалық рекомбинацияға әкеледі. Трансгеноз жұмысы көпжақты және бірнеше сатылардан тұрады. Алдымен, екі пронуклеус стадиясындағы зиготаларды алу керек. Бұл үшін синхронды овуляция уақытылы қолдан ұрықтау немесе шағылыстыру керек, осыдан кейін белгілі уақыт өткеннен соң зиготаларды хирургиялық жолмен алуға болады. Трансгеннің клетка ДНҚ-мен байланысатын белгілі орны болуы керек, алайда, көптеген зерттеулер оның хромосомасының әр түрлі бөліктерімен байланысатынын дәлелдейді. Трансгеннің иесінің геномымен байланысуы кездейсоқ жүретін болса, онда ол хромосоманың гетерохраматинді бөліктеріне еніп, инактивизацияланып кетеді. Бұдан бөлек хромосома бөлігімен байланысқан трансгеннің активтілігі клеткалық ДНҚ-ң реттеуіш элементтеріне промотор, энхансер және силансерлерге-байланысты болуы да мүмкін. Трансгенді жануарлар алудың қолданбалы бағыттары үшін егеуқұйрықтың соматотропин генін тышқанның геномына енгізу тәжірибесінің маңызы зор.
Трансгенді жануарларды алу
Басқа геномға белгілі бір геномнан алынған немесе жасанды түрде құралған синтезделген гендерді экспертменталды тасымалдау - трансгеноз деп аталады. Геномына бөгде гендер енгізілген жануарлар трансгенді деп аталады. Трансгенді жануарларды алу технологиясы қазіргі кезде жақсы жолға қойылған. Клонданған гендерді жұмыртқа клеткаларына немесе алғашқақы сатыдағы эмбриондарға енгізудің бірнеше әдісі табылған. Бөгде ген реттеушісіне байланысты әртүрлі ткандарда қызмет атқарады. Мысалы, егерде тасымалданған генге, оның қайдан алынғанына байланыссыз қалыпты жағдайда бауырда қызмет атқаратын тышқан генінің реттеушісін жалғаса, онда көшіріп орнатылған ген трансгенді жануардың бауырында жұмыс атқарады.
Трансгенді жануарлар алу үшін рекомбинантты гендерді микротүтікше және микрокапиллярлар көмегімен ұрықтанған ооциттің пронуклеусіне енгізу әдісі кең қолданылады. Трансгеноз әдісі арқылы трансгенді тышқандар алу жақсы зерттелген. Мұның басты себебі болып тышқан ооциттері цитоплазмасының мөлдір болуы саналады. Басқа жануарлардың, соның ішінде малдың ооациттері мөлдір емес, сондықтан рекомбинантты ДНҚ-ны пронуклеуске енгізу өте күрделі және қиын іс. Трансгеноз жұмысы көпжақты және бірнеше сатылардан тұрады. Алдымен, екі пронуклеус стадиясындағы зиготаларды алу керек. Бұл үшін синхронды овуляция уақытылы қолдан ұрықтау немесе шағылыстыру керек, осыдан кейін белгілі уақыт өткеннен соң зиготаларды хирургиялық жолмен алуға болады. Алынған зиготаларға бөтен ДНҚ-ны енгізбестен бұрын, оны in vitro жағдайында әр түрлі әдістер мен тәсілдер арқылы сақтау керек. Енгізу кезінде вазелин майының астында арнайы ерітіндінің тамшысына орналасады, бұл сұйықтықтың кеуіп кетуінен сақтайды. ДНҚ-ны зиготаға енгізу үшін диаметірі 0, 5-2 мкм арлығындағы ең аз дегенде 10-" мл ДНҚ-ны зиготаға микраскоптан бақылап енгізеді. Микроинъекциядан кейін екі сағатқа жетпей жарамды зиготаларды алдын ала арнайы дайындалған аналық-рецепиенттерге тасымалдайды. Бұл кезеңде де зиготалардың көп мөлшері зақымданады. Аяғында трансгенді жануарлардың шығуы 1%-ке тең болады. Алайда мұның өзі трансформация және трансдукциямен салыстырғанда өте жоғарғы көрсеткіш болып саналады.
Демек, кез келген генге реттеуші элемент тауып, оның қалауы бойынша, қай органда жұмыс істейтінін алдын ала жоспарлауға болады. Бұл бағытта болашағы зор әдістер-микроинъекция мен мембрана инженериясы болып табылады. Бастапқы ұрықтанған бір клетка кезінде оған бөтен ген енгізсе, ол өсіп жетілген организмнің барлық клеткаларында болады. Осылай тышқанның ұрықтанған аналық клеткасына адамның самототропин генін енгізу арқылы алып тышқан алынды. Осылай сәйкес гормонды малдардың да ұрықтанған аналық клеткасына енгізіп, олардың да ірі түрін өсіруге болады.
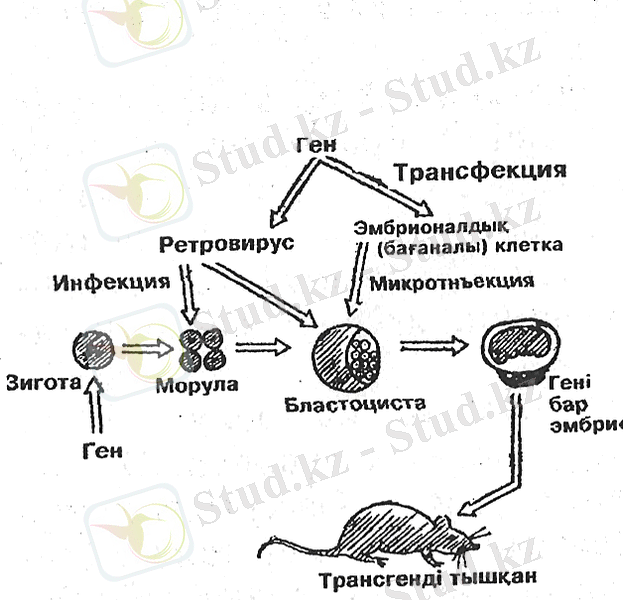
Жануарлардың генетикалық аппараттарына гендерді тасымалдау.
Р. Хаммер және Г. Брем қызметтестерімен адамның өсу гормонын микроинъексиялау арқылы трансгенді үй қояндарының көжектерін алды. ВИЖ-дің биотехнология лабораториясында ірі қара малдың Өсу гормонын енгізу арқылы трансгенді қоян алынған және ол ген жаңа организмде жұмыс істеген (Л. К. Эрнст және басқалары)
Трансгенді шошқалар, адамның өсу гормонын инъекциялау негізінде, Р. Хаммердің (1985) және г. Бремнің (1986) лабораториясында алынды. Бұл шошқалардың кейбіруінің қанының плазмасында адам гормонының жоғарғы деңгейде екені анықталған.
Ірі қара малмен жұмыс істегенде, пронуклеустарды көру үшін ДНҚ ға ерекше флуоресценттік бояу қолданады және зиготалардың центрифугуралайды. 1987жылы сүт-етті бағыттағы алғашқы трансгенді бұзау алынды. Австралияда дүние жүзінде алғаш рет трансгенді қойлар алынды. Мұндай қойлар екі-төрт жасында осы тұқымға жататын құрбыларына 1, 5 есе ауыр болған. Ғалымдардың айтуы бойынша, жуық арада жүн өсіретін, ауруға қарсы тұратын гендерді де қойларға трансплантациялауға болады. Трансгенді қойлардың сүтінен қан ұйытатын факторды өндіру биотехнологиясы жете зерттелуде.
Мамандардың айтуы бойынша, трансгенді ауылшаруашылық малдары - ХХІ ғасыр тірі биотехнологиялық фабрикасы болуы керек, олар экологиялық жағынан қауіпсіз, ең ірісін жасап, оларды басқа тірі клеткаларға таза енгізуді айтады, құнды белок препараттарын өндіретін негізгі көз болуы тиіс. Бүгін оның іргетасы қаланып және әдістемелік негіздері жасалынған, тек осы ғылыми-техникалық жетістіктерді ауыл-шаруашылық малдарымен істелетін жұмыстармен ұштастыру солардың деңгейіне жеткізу керек.
Генді алудың үш әдісі бар: табиғи генді тікелей бөлу, химиялық және ферменттік синтез. Бірініші әдісте табиғи генетикалық арнайы ферменттердің көмегімен қажет ген кесіліп алынды. Бұл әдістің елеулі кемшіліктері бар. Біріншіден, ДНҚ-дан қажет генді танып, кесе алатын ферментті таңдап алу қиын. Фермент генді әрқашанда нақты шекарасында емес, әр қлы үзеді: не геннің екі жағынан артық нуклеотидтерді үзуі не түгел үзбеуі мүмкін, мұндай ДНҚ фрагменттерінің қызметі жеткіліксіз, сондықтан оларды пайдалану мүмкін болмайды. Екіншіден, эукориоттық органаизм геномының экзон-интрондық құрылысы, олардың гендерін бактерияларға енгізгенде функциялық тұрғыдан қиындақ туғызады, өйткені бактериялық клеткада сплайсинг процесі өтпейді. Үшіншіден, егер ген барлық ДНҚ-ның аз ғана бөлігін құраса, онда оны бөлу мен анықтауда елеулі қиындықтар пайда болады. Сондықтан бұл әдіс негізінен гнетикалы эксперименттер талабына сәйкес вирус пен бактериялардың генін бөлуде қолданылады.
Берілеген нуклеотидтер тізбегі бойынша ДНҚ синтездеу әдісін 1969 жылы индия ғалымы Х. Г. Корана ұсынған болатын. Ашықты тРНҚ-сының гені осылай синтезделді. Алдымен, ұзындығы 5-12 нуклеотидтерден тұратын ДНҚ-ның қысқа фрагменттері синтезделді, онан соң олар лигаза әсерімен бір бірімен қосылды. Қазіргі уақытта Х. Г. Корана өндеген методология бірқатар жасанды гендерді синтездеу үшін қолданылады. Осындай жолмен адамның инсулин және интерферон, адамның және жануарлардың - энкефалин және бардикинин гормондарының функциялы гендері синтезделді. Қазіргі кезде гендерді автоматты синтездейтін приборлар құрастырылды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz