Галогендер (VIIA топ): жалпы сипаттамасы және хлордың химиялық қасиеттері


ГАЛОГЕНДЕР
VIIA топ элементтеріне жалпы сипаттама
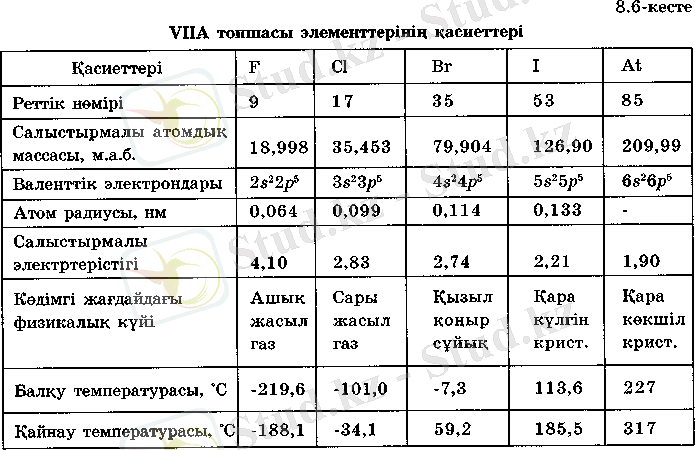
Галогендерге фтор, хлор, бром, йод және астат жатады. Алғашқы төрт элемент табиғатта әртүрлі қосылыстар түрінде кездеседі. Астат тек жасанды жолмен 1940 ж. алынды, радиоактивті (жартылай ыдырау периоды 8, 3 сағ) . Галоген топшасындағы әлементтер қасиеттері жағынан ұқсас, сондықтан оларды бірге карастыруға болады. Тек фтордың басқаларынан біраз айырмашылығы бар. Галоген атомдарының сыртқы қабатындағы электрондық конфигурациясының формуласы ns 2 np 5 , яғни сыртқы қабатта 7 электрон бар. Сондықтан да галоген атомдары инертті газ секілді тұрақты электрондық конфигурация құру үшін жетіспеген бір электронды қосып алуға бейім келеді. Демек, галогендер - күшті тотықтырғыштар. Оның ішінде фтордың тотықтырғыштың касиеттері басым. Галогендердің кристалдық торы молекулалық типті (кесте) .
Ядро зарядтары өскен сайын галоген атомдарының радиустары артады, өйткені энергетикалық деңгей саны жоғарылайды. Соңдықтан электртерістік фтордан йодқа қарай төмендейді, сонымен катар бейметалдық касиеттері де әлсірейді. Ең күшті бейметалдық қасиеттер фторда, ең әлсіз бейметалдық қасиеттер йодта байқалады.
 Галогендер түз түзіл тікелей металдармен әрекеттеседі. Сондыктан да олар - "тұз түзушілер" деп аталған. Сутек және оттек сияқты, галогендер де екі атомды молекулалар Г
2
түзеді. Н
2
және О
2
молекуласынан ерекшелігі, галоген молекулалары тұрақтылығы төмендеу.
Галогендер түз түзіл тікелей металдармен әрекеттеседі. Сондыктан да олар - "тұз түзушілер" деп аталған. Сутек және оттек сияқты, галогендер де екі атомды молекулалар Г
2
түзеді. Н
2
және О
2
молекуласынан ерекшелігі, галоген молекулалары тұрақтылығы төмендеу.
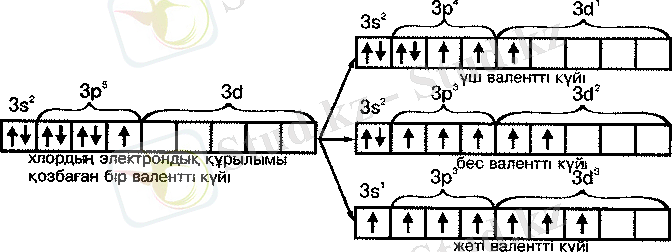
сурет. Хлор атомының валенттік мүмкіндіктері
Мысалы, С12 молекуласы квант жарыгының өсерінен атомдарға оңай ыдырайды. Галоген молекуласының атомдарға жеңіл ыдырауы - олардың жоғары химиялық белсенділігін көрсетеді. Сондықтан табиғатта галогендер бос күйінде емес, негізінен, металл галогенидтері түрінде кездеседі.
Фтордьщ баска галогендерден басты айырмашылығы - оның бос орбиталі жоқ. Сондықтан фтор тек бір валентті. Қалган галоген атомдарының сыртқы кабатында бос d-орбиталы болгандыктан хлор, бром және йод 1 валенттіктен баска 3, 5 және 7 валенттіктерді де керсете алады (сурет) .
Галоген атомдары енжар газдар сияқты тұрақты электрон-дық конфигурация құруға жетпей тұрған бір электронды қосып алуга бейім келеді. Демек, галогендер - күшті тотықтыргыш-тар. Галоген молекуласының атомдарга оңай ыдырауының се-бебі - олардың белсенділігі жоғары болғандықтан, топта фтор-дан йодқа қарай электртерістік төмендейді және бейметалдық қасиеттері әлсірейді.
ХЛОР
Периодтық жүйедегі орны және атом құрылысы.
Хлор VIIA топ элемент!.
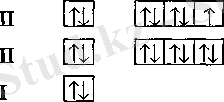
Оның электрондык формуласы:
Графиктік формуласы:
Хлор және оның ең маңызды қосылыстарының қасиеттері 8-сыныпқа ар-напған химия оқупығында қарастырылған.
Табиғатта кездесуі. Алғаш рет хлорды 1774 ж. півед химигі К. Шееле тұз қышкылымен МпО2-ге эсер етіп алды.
Хлордың белсенділігі жоғары болгандыктан, табигатта тек ко-сылыс түрінде кездеседі (жер кыртысындағы үлесі 0, 2%) .
Хлордың маңызды косылыстары - остузъшемесе натрий хлориді NaCl, калий хлориді (сильвин) КС1, магний хлориді MgQ2, карналлит KCl-MgCl2-6H2O, сильвинит KCl-NaCl және т. б. минералдар. Хлор тірі организм ұлпаларының қүрамына кіреді, мысалы, адам организмін-дегі оның мелшері 0, 25%-ке тең (масса бойынша) .
Физикалық қасиеттері. Хлор - сары жасыл түсті, өткір иісті, ауа-дан 2, 5 есе ауыр газ. Балқу температурасы -101°С, қайнау темпера-турасы -34, ГС. Судың бір көлемінде 2, 5 көлем хлор ериді. 0°С кезінде хлор сумей кристалгидраттар С12-яН2О түзеді.
Химиялық қасиеттері. Хлор - белсенді элементтердің бірі. Бірак фторга Караганда химиялық белсенділігі төмен. Бұл хлордың пе-риодтык жүйеде үшінші периодта орналасуымен түсіндіріледі. Күн сәулесінің әсерінен хлор сутекпен копарылыс түзе әрекеттеседі:
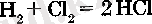
Сурьма ұнтагыхлор атмосферасында өздігінен сурьма (V) хлоридін түзе жанады:
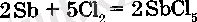
Хлормен барлық металдар тікелей реакцияға түсе алады. Тотьн-у дөрежесі әртүрлі болатын металдар хлормен өрекеттескенде жоғары тотыгу дәрежесін көрсетеді:
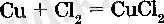
Алдын ала қыздырылған темір ұнтаіы хлорда темір хлоридін FeCl3 түзе жанады:
Хлормен қыздырылған натрий белсенді өрекеттеседі:
Хлордың биохимия л ық рөлі ионы маңызды биологиялық рөл атқа-рады. Олар кейбір ферменттердің бел-сенділігін арттырады, асқазан сөліндеп протолиттік ферменттердің әсері үшін қолайлы орта туғызады, жасуша мем-бранасы арқылы иондардың ағынын қамтамасыз етеді, осмостық тепе-тең-дікті ұстап тұруға қатысады.
Натрий хлориді - көптеген суда еритін дәрілер жасайтын физиологиялық ері-тіндінің (0, 9%-тІк) негізі.
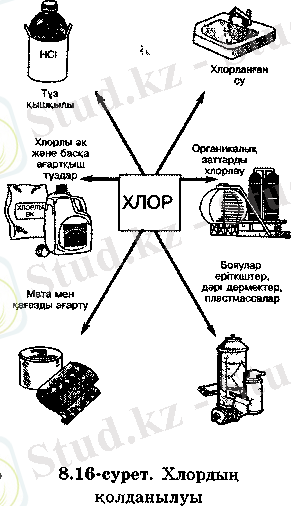
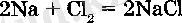
Хлордыңқолданылуы. Хлор өнеркәсіпте кеңінен қолданылады.
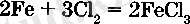
Ол маталарды ағартуда, арартқыш әк, тұз қышкъілын алуда, сондай-ак ауыл шаруашылыры зиянкестеріне карсы күресте пайдаланатын заттарды алуда, ауыз суын тазалауда крлданылады (8. 16-сурет) . Кө-міртек (IV) хлориді, дихлорэтан СН2С1-СН2С1 сиякты органикалык косылыстардың хлор туындылары көп қолданылады. Олардың кей-біреулерін пластикальщ масса (полихлорвинил), синтетикалық тал-шьщ, синтездік көксагыз (каучук), жасанды тері және т. б. алуда пайдаланады. Хлорды улаңдырғыш заттар алуда да колданады: фосген СОС12; иприт (C2H4C1) 2S; хлорпикрин CC13NO2 және т. б.
Алынуы. Лабораториялык жагдайда хлорды тұз қыніқылынан оган өртүрлі тотықтыргыштармен өсер ету аркылы алады:
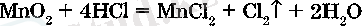
Осыған ұқсас тұз қышкылына басқа тотықтыргыштармен (КМпО4, КСЮд, СаОС12 және т. б. ) эсер ету аркылы да хлор алады:
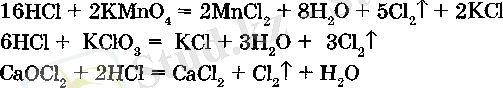
Өнеркәсіпте хлорды тұз қышқылы тұздарыньщ ерітінділерш немесе балқымаларын электролиздеп алады:
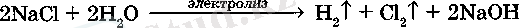
Хлорсутек, тұз қышқылы және хлоридтер. Хлорсутек НС1 - түссіз газ, ауадан ауыр. Судың бір көлемінде 500 көлемге жуык хлорсутек ериді. Оның судагы ерітіндісі тщз цышцылы деп аталады.
Концентрациялы күкірт қышкылы мен натрий хлоридін өрекеттестіру арқылы хлорсутекті алуга болады:
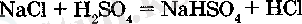
Қайнатқанда NaHSO4 натрий хлоридіне эсер етіп, Na2S04 және HC1 түзе әрекеттеседі:
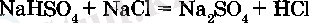 ^
^
Бірак та бүл өдіс қымбатка түседі (күкірт қышкылының піыгымын кажет етеді), ал алынган хлорсутек аса таза болмайды.
Қазіргі кезде хлорсутекті синтездік жолмен, ягни хлор агынында сутекті жагу аркьілы алады:
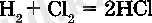
Алынған хлорсутекті суда еріткенде, күшті кышкылдар катарына жататын тұз кышқылы түзіледі.
Тұз қышқылы электрохимиялық кернеу қатарында сутекке дейін орналаскан металдармен, оксидтермен және көптеген металдардың гидроксидтерімен әрекеттеседі, сонымен катар кейбір тұздардың ерітінділерімен алмасу реакциясына түседі:
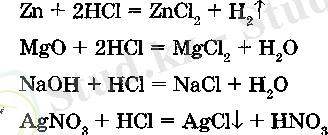
Тұз қышқылының тұздары. Тұз қышкылының тұздары хлоридтер деп аталады. Олардың көпшілігі суда ериді, тек күміс, қорғасын, бір валентті сынап және мыс хлоридтері ерімейді. С1~ иондарының Ag+ иондарымен әрекеттесуі кезінде AgCl түнбасының түзілуі - хлор ионына сапалык реакция болып табылады. Тұз кышқыльшың маңызды тұздарына - натрий, калий, мырыш, кальций тұздары және т. б. жатады.
Натрий хлориді немесе ас тцзы тамақ онеркөсібінде колданылады, сондай-ақ хлор, натрий, тұз кышкылы, натрий гидроксиді, сода және т. б. алуда негізгі шикізат болып табылады.
Калий хлориді- маңызды минералды тыңайтқыпі.
Мырыш хлоридініц ерітіндісін теміржол шпалдарына сіңіріп ші-руден сақтау үшін, совдай-ақ дәнекерлеу кезінде пайдаланады.
Кальций хлориді - суытқыш қоспа дайындауга кджет. Сусыз СаС12 газдарды кептіру үшін колданылады.
Хлор белсенді элементтер қатарына жатады. Ол қалыпты жағдайда көптеген металдармен қосылады. Хлор қалыпты жағдайда сутекпен баяу әрекеттеседі, ал жарықта немесе қыздырганда жарылыс бере жүреді, бұл реакцияның тізбекті механизмімен түсіндіріледі.
Хлорсутек - тұншықтырғыш иісті, суда жақсы еритін түссіз газ. Суды ерітіндісі түз қышқылы деп аталады. Түз қышқылы-ның көптеген тұздары (күміс, қорғасын, бір валентті сынап және мыс тұздарынан басқа) суда жақсы ериді.
Хлорид иондарының күміс иондарымен әрекеттесу кезінде AgCl түнбасының түзілуі, хлор иондарына сапалық реакция болып табылады.
ХЛОРДЫҢ ОТТЕКТІ ҚЫШҚЫЛДАРЫ
Галогендердің баска жай заттардан ерекшелігі оттекпен тікелей өрекеттесуге түспейді, себебі оттек пен галогендердің әлектртерістік мәндері жақын. Галогендердің оттекті косылыстары қосымша жолдармен алынады. Хлор суда ериді. Хлордыц судагы ерітіндісі хлор суы деп аталады. Бірақ хлорды суда еріткенде, оның шамамен 1/3 бөлігі сумен өрекеттесіп, екі кышқыл - туз цьшщылын НС1 және хлорлылау цышцылын НСЮ түзеді:
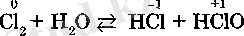
Хлордың суда еруі қайтымды процесс болгандыктан хлор суы - хлор газы, тұз және хлорлылау кышқылының ерітінділерінің кос-пасынан түрады.
Хлордың сумен өрекеттесу реакциясы өздігінен тотығу-тотык-сыздану немесе диспропорциялану реакциясына жатады.
Хлорлылау қышқылы НСЮ өте әлсіз және ерітіндіде түрақсыз. Молекулаішілік тотыгу-тотьщсыздану реакцияларының нөтижесінде ол біртіндеп сутек хлоридіне және оттекке ыдырайды:
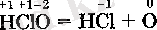
Бұл кезде реакциялык қабілеті жоғары атомдык оттек болінеді. Сондыктан жаңа дайындалган хлор суы - күшті тотыктыргыш, ол сондай-ак кейбір реакцияларды жүргізгенде хлор козі ретінде крлда-нылуы мүмкін.
Хлор күйдіргіш натр ерітіндісімен хлорлылау қышкылының түздарын (гипохлорит) және натрий хлоридін түзе өрекеттеседі:
Мынадай
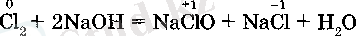 жагдайларга коңіл аудару қажет. Егер хлордың суда еру процесі кайтымды болса, хлор сілтіде еріген кезде тепе-теңдік толығымен оң жақка ығысады. Мұны реакция нөтижесінде қышқыл емес, олардың тұздары және аз диссоциацияланатын косылыс - судың түзілуімен түсіндіруге болады.
жагдайларга коңіл аудару қажет. Егер хлордың суда еру процесі кайтымды болса, хлор сілтіде еріген кезде тепе-теңдік толығымен оң жақка ығысады. Мұны реакция нөтижесінде қышқыл емес, олардың тұздары және аз диссоциацияланатын косылыс - судың түзілуімен түсіндіруге болады.
Газтектес хлор кальций гидроксидімен де (сондірілген өк) хлорлы немесе агартпцыш әктпі түзіп әрекеттеседі, негізгі кұрамдьщ бөлігі СаОС12 тұзы болып
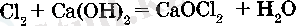 табылады:
табылады:
Осылай хлорлы әкті - тұз және хлорлылау қышқылының аралас тұзы түрінде қарастыруга болады.
Хлорлы өк - хлордың өткір иісі бар ак ұнтақ, күшті тотық-тыррыш. Оны маталарды, қагаздарды агартуда дезинфекциялаушы зат ретінде қолданады. Хлорлы әктің бұл қасиеттері ауада СО2 және ылғал өсерінен мына реакцияның жүруімен түсіндіріледі:
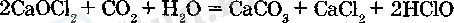
Бүл реакцияның жүру себебі хлорлылау қышқыл көмір қыш-қылына қарағанда әлсіз, демек, түздарынан ыгыстырылады. Түзілген НС1О жогарыда айтылғандай атомдық оттек түзе ыдырайды, ол хлорлы өктің тотықтырғыш, агартқыш және дезинфекциялагыш қасиеттеріне себепші болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz