Идеал газдар мен олардың қоспалары: Клапейрон теңдеуі, парциалды қысымдар және жылусыйымдылық


Идеал газ
Идеал газ - бөлшектерінің өзара әсері ескерілмейтін газдың теориялық моделі.
 Ол классикалық идеал газ және кванттық идеал газ болып ажыратылады. Классикалық идеал газдың қасиеттері классикалық физика заңдарымен - Клапейрон теңдеуімен, сондай-ақ оның дербес түрлері Бойль - Мариотт заңы және Гей-Люссак заңымен сипатталады. Классикалық идеал газ бөлшектерінің энергиясы Больцман үлестірілуіне сәйкес болып үлестіріледі. Жеткілікті дәрежеде сиретілген реал газдар классикалық идеал газдың моделімен жақсы түсіндіріледі.
Ол классикалық идеал газ және кванттық идеал газ болып ажыратылады. Классикалық идеал газдың қасиеттері классикалық физика заңдарымен - Клапейрон теңдеуімен, сондай-ақ оның дербес түрлері Бойль - Мариотт заңы және Гей-Люссак заңымен сипатталады. Классикалық идеал газ бөлшектерінің энергиясы Больцман үлестірілуіне сәйкес болып үлестіріледі. Жеткілікті дәрежеде сиретілген реал газдар классикалық идеал газдың моделімен жақсы түсіндіріледі.
Газдың температурасы төмендеген немесе оның тығыздығы артқан кезде идеал газ бөлшектерінің толқындық (кванттық) қасиеттері елеулі рөл атқара бастайды. Бүтін санды спинді бөлшектерден құралған кванттық идеал газдың қалпы (күйі) Бозе - Эйнштейн статистикасымен, ал жарты бүтін санды спинді бөлшектерден құралған кванттық идеал газдың қалпы (күйі) Ферми - Дирак статистикасымен сипатталады.
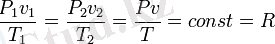
мұндағы R - меншікті газ тұрақтылығы. Мұндағы шамалар мына бірлікте: Р - Н/м2, v - м3/кг; Т - К, R - Дж/(кгК) . Теңдеу біртекті газдардың қалай болса солай алынған санына m арналғанын, басқа түріндегі теңдеуін пайдалана отырып жазуға болады:
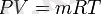
Бұл теңдеу, идеалды газдарға арналған Клапейрон-Менделеев теңдеуі деп аталады. Мейлі, М газдың молярлы массасы, кг/моль, өлшенеді.
Авогадро заңы бойынша, идеалды газдың 10-3 көлемі - қандай да химиялық құрамындағы р және t бірдей кезінде, дәл өзі болады. Белгілі, қысым кезінде р0 = 101, 33 Па (760 мм. сын. бағ. ) және температурада T0=273, 16К (нормалы физикалық күйде), газ көлемі 10-3 моль кезінде, Vm = 22. 4116 м3. р0, Vm, Т0 және M=m мәндерін теңдеуіне ауыстырып қойып табамыз:
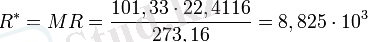 Дж/(моль*К)
Дж/(моль*К)
Мұндағы R* барлық газдар үшін бірдей және оны, эмбебапты газ тұрақтылығы деп атайды. Сонымен:
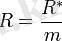
Идеалды газдар қоспасы
Жылулықты қолданатын машиналардың жұмыстық денесі ретінде, әртүрлі газдардың қоспасын қолданады.
Олар үшін, Rқос болуы қажет. Әрбір құрамды бөлікке кіретін қоспалар, қоспаның толық көлемімен толады, бірақ, онда олар өзінің парциалды қысымында болады:
Дальтон заңы бойынша
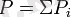
Газды қоспаның т массасы үшін, дұрысында дәл осындай түріндегі теңдеу түрі:
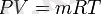
Бірақта, меншікті газ тұрақтылығы R, мұндағы қоспалар құрамына байланысты және бір және сол газдар қоспалары, олардың құрамдары өзгерген кезде, әртүрлі мәндерінде болады.
Қоспалардың, меншікті газ тұрақтыларын былай анықтайды. Қоспалар п, әртүрлі құрамды бөлікті газдардан тұрғандағы, әрқайсысының m1, m2, m3, . . . , mn массасында болғанда, қоспа массасын, мына түрінде шешеді:
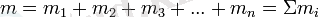
Жеке құрамды (газдар) парциалды қысымдарды Р1, Р2, Рз, …, Рn деп белгілейді. Газды қоспалардың, жеке газдардағы парциалды қысымы ұғымындағы қысым сол санында, сол көлемде және сондай температура кезінде, қоспа жағдайымен бірдей болуы тиіс. Сондықтан, біртекті газдар үшін мына теңдікте жүреді
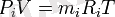
Мұндағы Рi, mi, Ri - қаралып отырған газды қоспалардың парциалды қысымы, массасы, меншікті газ тұрақтылығы; V, T қоспаның көлемі мен температурасы.
Газды қоспаның әрбір құрамды бөлігіне жағдай теңдеулерін жазамыз:
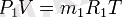
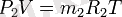
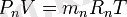
Осы теңдіктердің оң және сол бөліктерін мүшелеп қосып, табамыз:
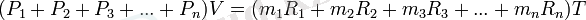
m1R1 + m2R2 + m3R3 + . . . + mnRn = mR деп белгілеп табамыз.
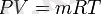
Мұндағы:
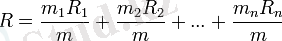
Газ қоспаларының техникалық көрсеткіштерін, сонымен қатар, оның көлемдік құрамының көмегімен жиі анықтайды, оны анықтау былай қабылданған. Қоспа қысымы Р мен Т температурасы кезіндегі, әрбір қоспаның құрамды бөлшектерін жеке түрінде қарастырамыз. Сонымен, құрамды бөлшектердің парциалды көлемдері V1, V2, V3, , . . . Vn жағдай теңдеуіне сәйкес, қатаң түрде белгілі мәндерде болуы тиіс:
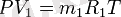
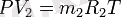
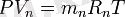
Осы теңдеулерді қосып мүшелеп табамыз:
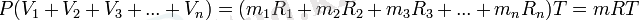
Сонымен газды қоспа үшін PV=mRT, онда:
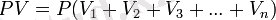
немесе:
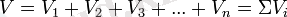
Формула газ қоспасының көлемдік құрамын анықтау негізіне жатады. Одан
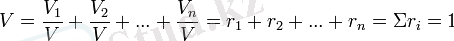
Идеалды газдар және олардың қоспаларының жылусыйымдылығы
Денелердің жылу сыйымдылығы дегеніміз, оның температурасын 1°К өзгертуге арналған, қажетті жылу санын айтады. Заттардың санына байланысты, мына меншікті жылу сыйымдылығын пайдаланады: С - массалы жылу сыйымдылығы, бір килограмм массаның Дж/(кгК) жатуы; МС - молярлы жылу сыйымдылығы, 1 мольдың Дж/(к мольК) жатуы;
С’ - көлемдік жылу сыйымдылығы, 1 м3 Дж/(м3К) нормалы жағдайда жатуы:
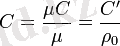
P=const кезіндегі, массалы жылу сыйымдылығы, Ср - белгілейді және оны изобарлы деп атайды, ал V=const кезіндегісін Cv - белгілеп және оны изохорлы деп атайды. Ср және Cv аралық байланысын Майер теңдеуі арқылы беріледі:
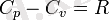
Молярлы жылу сыйымдылығы үшін Майер теңдеуі, мына түрде болады:
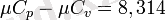
8, 314 - әмбебапты газ тұрақтылығы, кДж/(к мольК)
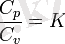
K - адиабаттар көрсеткіші.
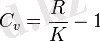
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz