Белоктардың құрылысы мен қасиеттері: құрам, жіктелуі, кеңістіктік құрылым және түсті реакциялар


Ж о с п а р:
І. Кіріспе:
- белоктардың жалпы сипаттамасы, физикалық және химиялық қасиеттері
- белоктардың жіктелуі, құрамы.
ІІ. Негізгі бөлім:
- белоктың құрлысы
- белоктарға түсті реакциялар
Қорытынды:
- белоктардың биологиялық маңызы мен олардың табиғатта таралуы
Кіріспе
1. Белоктардың жалпы сыпаттамасы және физикалық
- химиялық қасиеттері
Академик В. И. Вериадскийдің есебі бойынша жер жүзіндегі тірі организмдердің салмағы 10 т. тең екен. Ал осы барлық тірі организмдердің негізгі құрамда бөлігі белок. Тіршілік ету процестерін зерттеу жұмыстары олардың өмірінде нуклеин қышқылдарының белоктардың жаңаруы, күрделілігі, шексіз әр-түрлілігі, маңыздылығының ерекше кеңдігін көрсетті. Ф. Энгельс өзінің "Табиғат диалектикасы" еңбегінде өмір дегеніміз - белокты денелердің өмір суру тәсілі, яғни организмдегі зат алмасудың қоршаған ортамен тығыз байланысы деп жазды. Басқаша айтқанда белок - барлық тірінің материалдық негізі болса, ал олардың тіршілік ету тәсілі - өмір болып табылады.
Белоктардың "белок" деп аталуы олардың тауық жұмыртқасы белогының қайнап денатурацияланған кезде - ақ тығыз массаға айналуынан шыққан. Оның басқаша аты протеин - бірінші; маңызды латын сөзінен алынған. Бұл атты Голландия ғалымы Ж. Мульдер берген.
Белоктардың тірі организмдер үшін алатын орны:
1. Белок - генетикалық ақпаратты жеткізуге қолданылатын молекулалық құрал. Белоктардың маңызды қызметтерінің бірі олар түзу сызықтық РНҚ-дағы генетикалық хабарды үш өлшемдік яғни кеңістіктік хабарға айналдыратын химиялық материал болып табылады, Ал бұл үш өлшемдік, яғни кеңістіктік хабар тірі организмдердің макромолекулалық, субклеткалық компоненттеріне тән. Міне, белоктардың бір осы қасиетті ғана, олардың қаншалықты маңызды екендігін көрсетеді.
2. Белок - күрделі заттардың жай қарапайым заттарға дейін тотығуына қатысатын және жәй заттардан күрделі заттардың түзілуіне қатысатын фермент.
3. Белок - адам организмін микробтардан, ауру туғызушы агенттерден сақтайтын антидене.
4. Актин, миозин сияқты белоктар бірімен-бірі АТФ-тың қатысуымен әрекеттесіп, бұлшықеттердің жиырылуы сияқты қызмет.
5. Көптеген белоктар инсулин, глюкагон, гипофиздің тропты гормондары сыртқы ортаның әсеріне сәйкес, тірі организмдегі процестерді реттеп отырады.
6. Белоктардың бір тобы - гемоглобин, қан плазмасаның белоктары альбумйн, глобулин тасымалдау қызметін атқарады. Сонымен белоктар тіршілік етудің: ас қорыту, тітіркену» өсу , көбею, қозғалу сияқты барлық құбылыстарына қатысып, тірі организмнің тіршілігінің көзі болып табылады.
Белоктардың әлементтік құрамы:
Бұлардан басқа Р/2°/о - ке дейін, Cu, Mn, Fe, Co, т. б. элементтер кездеседі. Белоктардың молекулалық салмағы 12-13000 - нан жәй белоктарда бірнеше миллионға дейін күрделі белоктарда жетеді.
Сондықтан белоктардың молекулалық салмағын анықтау көптеген қиындықтар туғызды. Жәй заттардан молекулалық салмағын анықтауға қолданып жүрген классикалық физикалық-химиялық әдістер, белоктардың ерекше қасиеттеріне сәйкес, олардың молекулалық салмағын анықтау үшін жарамсыз болды. Тек қана XIX ғасырда ультрацентрифуганың жасалуына сәйкес ультрацентрифугалық әдіс дами бастады. Осы әдіс арқылы центрден тепкіш күшке байланысты белоктардың тұнбаға түсу жылдамдығының әртүрлілігіне сәйкес, олардың молеқулалық салмағын дәл анақтауға, мүмкіндік туды. Қазіргі кезде бұдан басқа гельфидатрация электрофорез әдістері де қолданылады
2. Белоктардың жіктелуі, құрамы.
Белоктардың кеңістіктегі орналасуына сәйкес глобулярлы және фибрилді деп 2-ге бөлінетіндігі жоғарыда айтылып кетті. Ал, биологиялық қасиеті мен қызметіне сәйкес белок молекулаларын төмендегідей топтарға бөледі.
1. Белок - ферменттер белоктардың ең үлкен тобы
2. Белок - гормондар инсулин, гипофиздің гормондары, вазопрессин, окситоцин.
3. Иммундык белоктар антиденешіктер, қанның - глобулині
4. Транспорттық белоктар қанның гемоглобині, қан сары суының белоктары.
5. Жиырылғыштық функция бұлшықеттің актомиозині.
6. Құрылымдық белоктар клетка мембранасының белоктары т. б.
7. Артықша белоктар сүтінің казеині, жұмыртқа белогы химиялық құрылысының ерекшелігіне сәйкес белоктарды жәй протеиндер және күрделі протейдтер деп екі топқа бөледі. Жәй белоктар, яғни протеиндер тек амин қышқылдарының қалдығынан тұрады. Жәй белоктардың қатарына, табиғатта кеңінен тараған - глютэлин және проламин өсімдік белоктары, қанның альбуминдері мен глобулиндері адам мен жануарлар организмінде, гистондар мен протаминдер ядролық белоктар, колла-гендер мен кератиндер белок тәрізді заттар немесе протеиноидтар т. б. жатады.
Күрделі белоктардың қатарына құрамында полшептидтік тізбектен басқа нуклеин қышқылдары, көміртегі, гем, фосфор қышқылы, металл иондары сияқты белоктық емес компоненттері бар белоктар жатады. ХРОМОПРОТЕИДТЕР- түсті белоктар. Олардың құрамында пептидтік тізбектен басқа белоктық емес компонент - гем болады. Хромопротеидтердің қатарына: хлорофилл - өсімдік протеиді. Құрамында Мg ионы бар, күн көзінің әсерімен С02 және HgO молекулаларынан глюкоза түзуге қатысады; қан гемоглобині - құрамында Ғе ионы бар, ГЕМОГЛОБИН /гемопротеид/ - қан эритроцитінің құраданда болады. Қанның жалпы массасының 800 г тең, немесе 13-16 °/о/. Гемоглобин оттек молекуласын тірі организмнің әрбір клеткасына жеткізіп, ал клеткалардан тіршілік ету процестерінің соңғы заты болып табылатын көмір қышқыл газын алып кетеді. Гемоглобиннің молекулалық салмағы - 65000. Ол 96 °/о глобин белогы мен 4°/ о гемнен тұрады.
Гемоглобиннің түрлік ерекшелігі, оның бірінші реттік құрылысымен анықталады. Адамның өсуімен дамуы кезінде, амин қышқылының құрамына сәйкес физикалық-химиялық қасиеттері әртүрлі болатын гемоглобиннің бірнеше түрі түзіледі. Мысалы, НаР - ұрықтық гемоглобин /эмбриональды/, НвГ-фетальда гемоглобин жаңа туған нәрестенің гемоглобины, НвА-қалыпты гемоглобин - яғни ересек кісінің гемоглобины.
Гемоглобиннің құрамындағы амин қышқылдарының эквивалентті емес алмасуының нәтижесінде аномальды гемоглобиндер түзіледі. Мұндай гемоглобиндер бірінен-бірі тек қана физикалық-химиялы қасиеттері жағынан ғана емес ИЭН, электрофоретикалық қозғалғыштығы, олар биологиялық қызметі жағынан да ерекшеленеді, яғни өздеріне тән биологиялық қызметін атқара алмайды, 30-ға жуық аномальды гемоглобиннің түрі белгілі HbS , HвC, НвД, НвҒ т. б.
Орақ тәрізді клеткалық анемия, біздің елімізде өте аз кездеседі, ал малярия ауруы дамитын Африка, Азияның Оңтүстік шығысында елдерде көп кездеседі, себебі Нв малярия плазмодиясын қабылдамайды, -сондықтан бұл макроорганизмдердің адамның молекулалық деңгейде қорғанышы болып табылады. Аномальды гемоглобиндердің оттегін байланыстыру қабілеті нашар сондықтан көбінесе анемия ауруы дамиды. Бұл науқастың түрін гемоглобинопатия деп атайды. Заттың молекулалық аурулар дейді. Гемоглобинопатия осы молекулярлы аурулардың қатарына жатады.
Гемоглобиннің маңызды туындыларының қатарына оксигемоглобин жатады (НвО2), Оттек гемоглобиннің геміндегі Ғе2 ионына координациялық байланыс арқылы байланысады. Ғе + екі валентті, күйінде қалып, өзінің валенттігін өзгертпейді. Мұндай гемоглобинді оксигенделген гемоглобин деп атайды. HeOg -тотыққан гемоглобин деп aтауғa болмайды.
Гемоглобиннің СО - ны байланыстыру қабілеті өте жоғары болғандықтан, СО-мен байланысқан гемоглобин оттекті байланыстыра алмайды, соңдықтан CO- газымен уланған кезде, организмге оттек жетіспегендіктен өлім каупы тез туады. Ал NO - азот тотығымен, нитробензолмен уланған кезде гемоглобин метгемоглобинге дейін /НвОН/ тотығады. Меетемоглобинде Ғе үш валентті, өкпеден жасушаларға оттегін жеткізу қабілеті нашарлап метгемоглобинемия ауруы пайда болады. Улану дәрежесіне қарай метогемоглобинемия да өлім қаупін туғызуы мүмкін.
Гемоглобин туындыларының сандық мөлшерін анықтаудың ең сенімді қолы, олардың сіңіру спектрлерін зерттеу спектрлік әдіс.
Гликопротеиндер- құрамында белоктық компоненттерден басқа көміртектік компоненттер болатын күрделі белоктар. Көміртектік компоненттерге: манноза, галактоза, фукоза, гексозоаминдер, глюкурон қышқылы, нейрамин және сиал қышқылдары жатады.
Гликопротеидтердің биологиялық қызметі өте зор :
1. Қорғаныштық тіректік, дәнекерлегіш қызметі буын сұйықтықтары, шеміршек, сіңір, сүйек, кілегей, эпидермис т. б.
2. Жасушалардың өткізгіштігін қамтамасыз ету, суды ұстау,
3. Иммундық қызметі қанның топтары, актиденелер, грипп вируотарын байланыстыру.
4. Қанның ұюына кедергі жасау /гепарин/.
5. Са - сіңіру және шеміршектің сүйекке айналуына қатысу.
6. Гормондар гипофиздің тропты гормондары.
7. Қан тамырларының серпімділігін қамтамасыз ету атеросклероздық өзгерістер.
8. Транспорттық және қорлық қызметі трасферрин = Fe, церуллоплазмин Сит. б. - Гликопротеидтердің белоктық бөлімі негізінен белок тәрізді заттардың қатарына жататын коллагеннен тұрады.
Гликопротендтерді екі топқа бөледі:
1. Қышқыл гликопротеидтер - мукоидтер, мукогтротеидтер.
2. Нейтральды гликопротеидтер немесе жәй гликопротеидтер /40 °/о дейін гексозоаминдерден тұрады.
I. Қышқыл гликопротеидтерді - мукопротеидтерді хондромукоидтар /шеміршекте/, остеомукоидтар /сүйекте, овомукоидтар/, жұмыртқа белогы, муциңдер /сілекейде, кілегей қабатында/ деп бөледі. Қышқыл гликопротеидтердің көмірсулық компоненті белокпен тығыз байланысқан байланысқан қышқыл мен хондроитин күкірт қышқылынан тұрады.
Гиадурон қышқылы - / N - ацетилглгакозамин - р , р -глюкуронил/, м. с. 10° дальтон.
Тұтқырлығы өте жоғары, көздің шыны тәрізді денесінде, буынарылық сұйықтарда, клеткааралық желімдеуші заттардың құрамында болады.
Белоктың құрамы
Белоктың негізгі құрамында:
көміртек - 50-55 %
оттек- 21-24 %
азот - 15-18 %
сутегі - 6-7 %
күкірт - 0, 3-2, 5 %
гистондар
протоаминдер фосфопротеидтер проламиндер липопротеидтер глютелиндер металлопротеидтер
протеиноидтер склеропротеидтер
ферментгер
Белокгар өте күрделі жоғарғы полимерлі затгар. Оларды құрайтын мономерлер - амин қышқылдары бір-бірімен жалғасып полипептид береді, осы полвпептадтердің бірігуінен белок молекуласы пайда болады. Әр организмнің өзіне тән белогы болады. Неміс ғалымы Абдер Гальден былай деген "егер 32 әріптен канша сөз жасауға болса, 22 амин қышқылдарынан сонша белок молекуласын жасауға болады".
3. Белоктардың химиялық құрылысы.
Элементтік құрамының қарапайымдылығына қарамастан- барлығы 5 элемент - С 2 0 5 , Н, 5 белоктр өте күрделі полимерлік қосылыстар. Белок макреморлекулалары қарапайым амин қышқылдарынан тұрады.
1871 жылы. Н. Н. Любавин сүт белогы-казеиннің ас қорыту сөлінің қатысуымен ферменттік гидролиз амин қышқылдарына ыдырайтындарын ашты.
1931-1902 жылдары Ә. Фишер белоктардың қышқылдың /25°/о HgSO немесе 30°/о НСІ қатысуымен 10-96 сағат ішінде қыздырғанда гидролизге түсетіндігін ашты, міне, осы уақыттан бастап белоктан химиялық құрамын анықтау барысында жүйелі жұмыстар істеліне бастады.
Қазіргі кезде белок ыдырауының сілтінің және ферменттің қатысуымен жүретін жолдары да белгілі. Бұл әдістердің әрқайсысының өзінің кемшіліктері мен жетістіктері бар. Сондықтан белок құрамын анықтауда осы үш әдіспен алынған нәтижелерді біріктіріп барып қорытынды жасайды. Белоктың ыдырауынан түзілетін амин қышқылдарын (ионалмасу) хроматография, электрофорез әдістерімен әрі қарай зерттейді.
Амин қышқылдары - белок молекулаларының құрамды бөлігі. Олар -органикалық қышқылдардың аминді туындылары болып табылады.
Оларды төмендегідей топтарға бөлуге болады:
I. Ациклді, яғни циклді емес амин қышқылдары 14 амин қышқылы. Бұл амин қышқылдарының өзі а/моноаминді монокар- бон қышқылдары 8 амин қышқылы -лей, і-лей, вал, т. б;
б/ диаминді монокарбон қышқылдары /4 амин қышқылы - орнитин, лизин, аргинин, гидроксилизин в/ моноаминді дикарбон қышқылдары /2 амин қышқылы - аспарагин, глютамин қышқылдары/ болып бөлінеді.
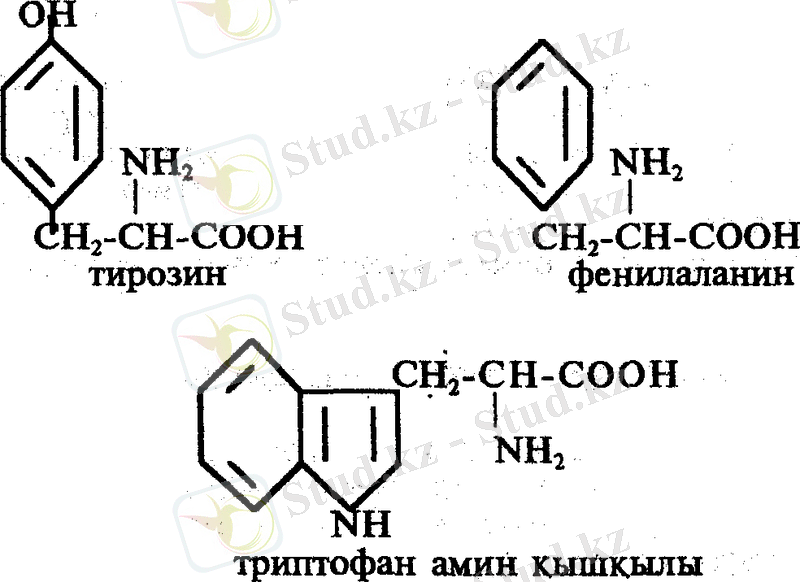
ІІ. Циклді амин қышқылдарына 4 амин қышқылы жатады, бұлар да 2 топтан тұрады: а/ гомоциклді - 2 амии қышқылы /фенилялакин, тирозин/; б/ гетероциклді - 2 амин қышқылы трифтопан, гистидин.
Ш. Иминоқышқылдар -2 /оксипролин, пролин
Физикалық қасиеттері. Барлық табиғи амин қышқылдары түссіз, кристалды заттар, көбінесе дәмсіз, кейбір амин қышқылдарының дәмі бар , тек қана глициннің дәмі тәтті. Амин қышқылдарының судағы ерітінділері нейтралды, әлсіз қышқылдық жәнә әлсіз сілтілік қасиет көрсетеді. Белок құрамындағы барлық амин қышқылдары оптикалық активті заттар /глициннея басқасы/ және қатарына жатады.
Амин қьшқылдарының бұл қасиеттері белоктарға да тән. Әрбір амин қышқылының амфиион түзетін рН-ы болады.
2. Амин қышқылдары бір амин қышқылының - СООН тобының
және екінші амин қышқылының - NHg тобының есебінен су молекуласын бөліп шығарып, пептидтік байланыс арқылы өзара байланысын пептид түзеді. Белоктардың І-ші реттік құрылысының өзгеруі амин қышқылдардың орнын өзгертуі олардың қасиетінің күрт өзтеруіне әкеп соқтырады.
Белоктардың- мұндай қасиеті медецинада кеңінен қолданылады. Мысалы, әртүрлі жануарлардан бөлініп алынатын инсулин, АКТ, вазопрессин, окситоцин сияқты табиғаты белоктық гормондар, адамдарды әртүрлі аурулардан емдеу үшін қолданылады. Белоктардың І-ші реттік құрылысын зерттеу бірнеше кезеңнен тұрады:
1. Шеттегі амин қышқылдарын анықтау ол үшін карбоксипептидаза ферменті - С - шеттегі амин қышқылын бөліп алу үшін ал 2, 4 - динитрофторбензол - N шеттегі амин қышқылын бөліп алу үшін қолданылады.
2. Пептидтік тізбекті қысқартып, әрі қарай амин қьшқылдық құрамын- анықтау үшін белокты пепсинмен тирозинмен фенилаланиннің арасындағы байланысты трипсинмен аргинин мен лизиннің арасындағы байланысты түзу үшін өңдейді.
3. Осы жолдармен түзілген пептидтердек амин қышқылдары бірін-бірі жабатын пептидтік карталарды қарастырады, сонын соң полипептидтік тізбектегі амин- қьшқылдарының орналасу орнын анықтайда.
Полипептидтік тізбектің кеңістіктегі орналасуы. Белоктардың биологиялық қасиетің жоғалтуы ферментік немесе гормондық активтіл-ігін жоғалтуы қарапайым қыздыру кезінде-ақ- байқалады. Бірақ қыздыру кезінде олардың І-ші реттік құрылысының өзгеріссіз қалатындығы анықталды, яғни белоктардың өздеріне тән қасиеті қызметі олардың кеңістікте орналасуына тәуелді.
Белоктардың кеңістіктегі құрылысы рентген көмегі арқылы анықталған Полинг, Кори, I960. Ренлтен арқылы құрылымдық анализдің қортындысы бойынша полипептидтік тізбек кеңістікте спираль түрінде орналасады.
Кейбір полипептидтік тізбектер жоғарыда көрсетілген кіші спиральдардан басқа қадамы үлкен, екінші- реттік спираль түзеді. Оның түзілуіне полипептидтік тізбекте радикадцарының сутектік байланыс. түзуге қабілеті төмен серик, изолейцин, треонин, глютамий, аспарагин, лизин, аргинин, глицин сияқты амин қышқылдары себеп болада.
Белоктар құрылысының соншалықты күрделілігі олардың биосинтезі кезінде қателіктің мүмкіндігінше аз болуына, генетикалық материалды үнемді қолдануға, белок суббірліктерінің - өз бетінше жиналуын реттеуді жеңілдетуге мүмкіндік береді.
Сонымен, белоктардың молекуласы кеңістікте ерекше орналасатын термодинамикалық тұрақты, биологиялық активтілік көрсететін активті конформация деп аталатын құрылыстан тұрады. Белоктардың екінші, үшінші , төртінші реттік құрылыстары, олардың бірінші реттік құрылысына, амин қышқылдарының полипептидік тізбектегі орнына, санына тікелей тәуелді.
Белок молекулаларының жоғары құрылымдарын зерттеу, медицина үшін өте қажет, себебі белоктардың ферменттік антигендік активтілігі осы құрылымдардың өзгеруіне байланысты. Ал ферменттердің, антиген, антидеиелердің активтілігінің өзгеруі организмде физиологиялық, патологиялық өзгерістерге әкеп соқтырады. Белоктардың кеңістіктегі орналасуын рентгенқұрылымдық анализдің полярографиянық электрофорез, оптика, хромотография спектрометрид әдістерімен комплексті зерттеуге болады. Белоктардың коллоидтығы - оның макромолекулалық құрылысына тәуелді. Белоктардың судағы ерітіндісі гидрофилді коллоидтық қасиет көрсетеді және олардың ерітіндісінде Тиндаль конусын беретін "сәулені шашырату" құбылысы байқалада. Белоктар жартылай өткізгіштік қабілеті бар мембраналардан өте алмайды. Белоктардың бұл қасиетін оларды төменгі молекулалы қоспалардан тазарту үшін қолданады.
Сонымен диализ, тұздардың көмегімен тұнбаға түсіру сияқты белоктардың қасиеттері, оларды қоспадан тазартуға, бірінен - бірін ажыратуға мүмкіндік беріп, ғылыми және практикалық жұмыстар да маңызды орын алады.
Өте жоғары температура, күшті қышқылдар тұнбаның суды сің іргіш қасиеті күшті заттармен ұзақ уақыт бірге болуы, белоктардың денатурациясына, яғни олардаң ерігіштік қасиетінің қайтып қалпына келмеуіне, биологиялық қасиеттерінің жойылуына әкеп соқтырады.
4. Белоктарды тұнбаға түсіру реакциялары
Белоктарға түсті реакциялар
1. Биурет реакциясы. Бұл реакция арқылы белоктардың құрамындағы пептидті байланысты ашады. Пептидтер сілтілі ортада мыс иондарымен күрделі комплексті қосылыстар түзуге қабілетті келеді.
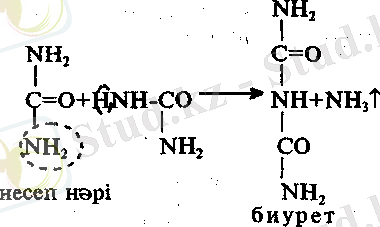
Жұмыс барысы: Пробиркаға несеп нәрінің аз мөлшері алынып, балқығанша қыздырылады. Балқу кезінде аммиак бөлініп шығады. Пробиркадағы кристалды затты салқындаған соң, суда ерітіл NaOH және CuSO 4 ерітінділерінен 2-3 тамшыдан қосамыз. Қоспаның күлін түске боялуы биуреттің түзілгендігін көрсетеді.
1. Осындай биурет реакциясын жұмыртқаның концентрлі ерітіңдісімен де жүргізуге болады. Ол шін 2 мл жұмыртқа белогінің ерітіндісін алып, үстіне бірнеше тамшы NaOH пен CuSO 4 қосамыз. Күлгін түстің пайда болғанын байқаймыз.
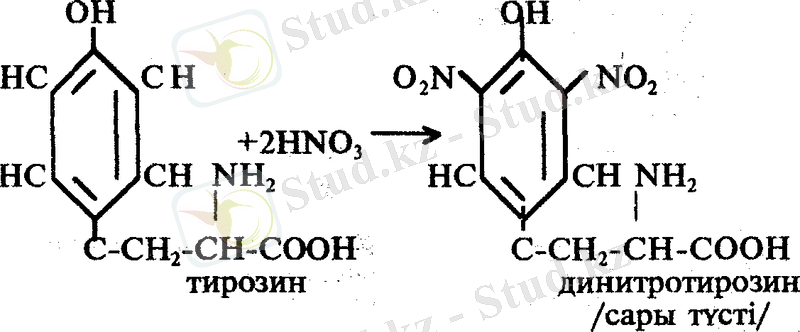
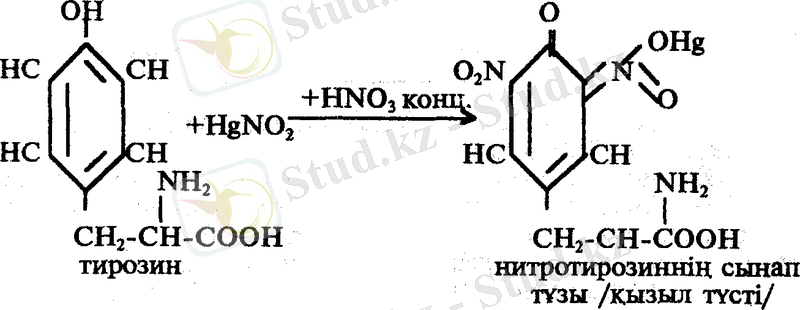
2. Ксантопротеин реакциясы. Бұл реакция арқылы кейбір циклды амин қышқылдарын ашады. Мысалы: тирозин, фенилаланин, триптофан сияқтылар.
Циклды амин қышқылдары концентрлі азот қышқылымен реакцияласканда, сары түсті нитро туындылар береді. Бұл реакция екі сатыда өтеді:
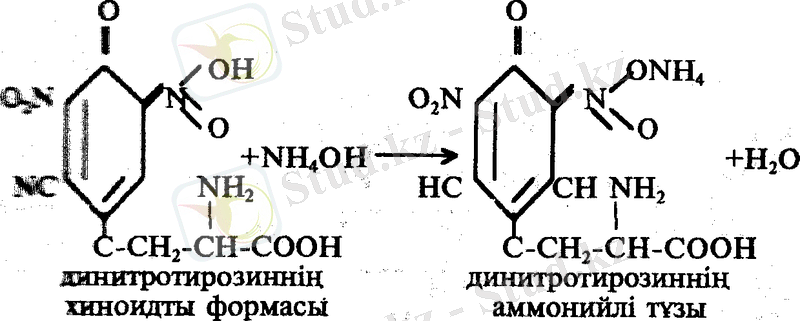
Нитротуындылар сілтілермен әрекетгескенде, күрделі заттар түзеді. Оларды хиноидты формалар деп атайды. Бұл қосылыстардың түсі сары қызыл.
Жұмыс барысы: 1 мл жұмыртқа белогінің ерітіндісіне 5-6 тамшы НNО 3 қосып қыздырады. Қоспа сары түске боялады. Екінші сатыда пайда болған аралық өнімді салқындатып, аммиак немесе 30 % NaOH ерітіндісін қоссақ қоспа сары қызыл түске боялады
Ксантопротеин реакциясын белоктардан, пептидтерден және циклды амин қышқылдарынан басқа да көптеген қарапайым ароматикалық қосылыстарда береді /бензол, фенол және т. б. /.
3. Миллон реакциясы. Бұл реакция арқылы тирозин амин қышқылын ашады. Бұл реакцияға Миллон реактиві қолданылады. Ол концентрлі азот қышқылында ерітілген бір валентті сынап нитриты мен нитратынан тұрады.
Жұмыс барысы: 1-2 мл белок ерітіндісіне 5-6 тамшы Млион реактиві қосылады. Оны қыздырғанда қызыл кірпіш түсті тұнба түзіледі.
Бұл барлық фенолдар үшін де тән реакция қатарына жатады.
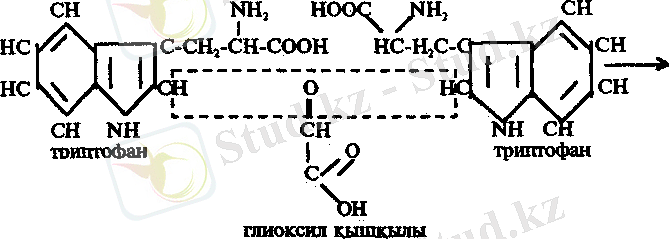
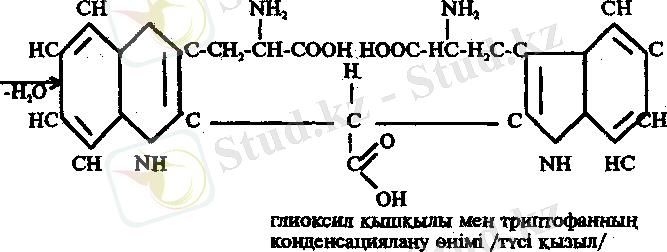
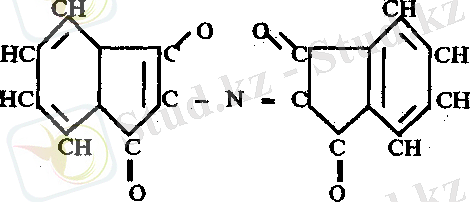
4. Адамкевич реакциясы. Белок ерітіндісіне концентрлі H 2 SO 4 қатысуында глиоксил қышқылын аз мөлшерде қосса, қызыл - күлгін түс пайда болады. Бұл реакция белок молекуласында триптофан амин қышқылының барлығына және онын сілтілі ортада альдегидтер немесе оксиметилфурфуролмен реакцияға түсіп түсті өнім беруіне негізделген. Глиоксил қышқылы концентрлі сірке қышқылының құрамында аз мөлшерде кездеседі. Сондықтан конц. СН 3 СООН глиоксил қышқылының көзі ретінде пайдаланылады.
Бұл реакциядағы қосылатын конц. күкірт қышқылы қоспадағы суды байланыстыру үшін қ ажет.
Тотықсыздандырылған нингидрин аммиак және нингидриннің екінші молекуласымен әрекеттесу нәтижесінде көк түсті күрделі қосылыс түзеді.
8. Фоль реакциясы. Бұл арқылы құрамында күкірті бар амин қышқылдары ашылады.
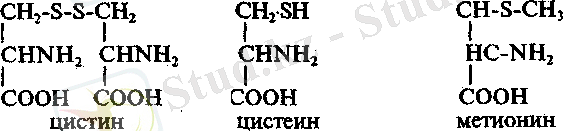
Цистеин мен цистин молекулаларындағы күкірт онша күшті байланыспағандықтан, оны негіз бен күкірт сутек түрінде оңай гидролиздеуге болса, ал ол әрі қарай сілтімен әрекеттесіп, натрий немесе калий сульфидтерін береді.
9. Нитропруссид реакциясы. Бұл реакцияда күкірті бар амин қышқылдарын анықтау үшін пайдаланады.
Жұмыс барысы. 1-2 мл белок ерітіндісіне 2-3 мл сілті ертінідісін қосып қайнатамыз. Суығаннан соң жаңадан бірнеше тамшы 10 % натрий нитропруссидінің ерітіндісін қосамыз. Күкірт сутектін натрий нитропруссидімен әрекеттесу нәтижесінде қызыл - қоңыр пайда болады.
Белоктарды тұнбаға түсіру әр түрлі реактивтер арқылы іске асады. Белоктар коллоидты ерітіңді береді. Себебі белок молекуласының бөлшектерінің зарядтары болады. Белоктардың -тұнбаға түсуі, олардың бөлшектерінің дегидратациялануына су қабаттарының бұзылуына байланысты. Осыған байланысты белок молекулаларының тұрақтылық факторларының бірі жойылады, яғни олардың бөлшектері іріленіп коагуляцияланады. Сондықтан тұнбаға түседі.
Белокты заттардың физико-химиялық қасиетгеріне көптеген факторлар әсер етуіне байланысты, олардың макро, - молекулаларының структурасы өзгеріске ұшырайды. Бұл процесс бізге денатурация түрінде белгілі. Денатурация кезінде белоктың макромолекулаларының активті конформациясы бұзылады. Әсіресе мұның олардың коваленттік /пептидтік/ байланыстарын бұзбай-ақ екіншілей және үшіншілей структураларын өзгеріске түеіруге әсері болады.
Денатурациялануды болдыратын факторларды физикалық және химиялық деп екі топқа бөледі: физикалық факторларға - температура, механикалық әсерлер, ультра-дыбыспен өңдеу, ионизациялық сәулелендіру әсері жатса, ал химиялыққа - ауыр металдардың иондары, минерал және органикалық қышқылдар, аммоний тұздары, сілтілік және сілтілік жер металдары тұздарының ерітінділері; органикалық еріткіштер /спирт, эфир, ацетон, хлороформ және т. б. /, алкалоидты реактивтермен тұнбаға түседі. Әсер етуі жағынан бұларға ұқсас детергенттер, несеп нәрі, кейбір бояғыштар жатады.
Кейбір физикалық факторлардың әсер ету механизмін жан-жақты қарастыру керек. Мысалы, ультрадыбыс толқындары мен ионизациялық сәулелендіру әсерлері салдарынан белоктың макромолекулалары химиялық өзгерістерге ұшырайды.
Белоктарды тұнбаға түсіру реакциялары қайтымды да қайтымсыз да болып келеді. Қайтымды болса, тұнбаға түскен белоктын макромолекулалары негізінен терең өзгеріске ұшырамайды, сондықтан тұнбаны алғашқы еріткіште /мысалы, суда/ қайтадан ерітуге бйлады. Қайтымды тұнбаға түсіру аммоний тұздары, сілтілік және сілтілік жер металдары тұздарының /тұздау/, спирт пен басқа да органикалық еріткіштердің әсерлерінен болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz