Д. И. Менделеевтің периодтық жүйесі: тарихы, құрылымы және Шредингер теңдеуімен түсіндірілуі


Кіріспе3
1. Дмитрий Иванович Менделеев5
Өмірі мен қызметі5
2. Д. И. Менделеев кестесі6
Қорытынды15
Пайдаланған әдебиеттер16
Химиялық элементтердің периодтық жүйесі ( Менделеев кестесі ) - Элементтердің әртүрлі қасиеттерінің атом ядросы зарядына тәуелділігін белгілейтін химиялық элементтердің жіктелу реті.
Жүйе атақты орыс химигі Д. И. Менделеевтің 1869 жылы ашқан периодтық заңының графикалық түрде бейнеленуі болып табылады. Оның бастапқы нұсқасын Д. И. Менделеев 1869-1871 жылдары шығарған еді және бұл нұсқасында элементтердің қасиеттерінің олардың атомдық салмағына (қазіргіше, атомдық массасына) тәуелділігін көрсеткен еді.
Периодтық жүйені суреттеудің (аналитикалық қисық сызықтар, кестелер, геометриялық фигуралар, және т. с. с) барлығы бірнеше жүздеген [1] (кітабында 400-ден астам деп айтылады) нұсқасы ұсынылған. Жүйенің қазіргі кездегі нұсқасында элементтерді екіөлшемді кестеге жинақтау қарастырылады. Мұндағы әрбір бағана (периодтық жүйенің тобы) негізгі физико-химиялық қасиеттерді анықтаса, қатарлар периодтық жүйенің периодын құрайды және белгілі мөлшерде бір-біріне ұқсас боп келеді. Периодтық жүйенің бірнеше түрі бар.
Периодтық жүйесінің ашылу тарихы
Алғашқы кестеде Менделеев әлі ашылмаған бірнеше элементтер бар екенін болжап, оларға кестеде тиісті орын қалдырып, кейбір қасиеттерін күні бұрын айтып берді. Сондай болжанған “экоалюминий” (1875 ж. француз химигі П. Лекок де Буабордан ашқан қазіргі галлий Ga), “экабор” (швед ғалымы Л. Нильсон 1879 ж. ашқан скандий Sc) және “экасилиций” (1886 ж. неміс ғалымы К. Винклир ашқан германий Ge) элементтері кейін ашылды. Сонымен қатар Менделеев марганецке (қазіргі технеций Тс және рений Re), теллурге (полоний Ро), йодқа (астат At), цезийге (франций Fr), барийге (радий Ra), танталға (протактиний Ра) ұқсас элементтердің бар екенін айтқан. Күні бұрын болжанған қасиеттер мен анықталған қасиеттердің дәл келуі Менделеевтің периодты заңын дүние жүзі ғалымдарына танытты. Радиоактивтік ыдыраудың (1806), рентген сәулелерінің (1895) ашылуы, неміс физигі М. Планктің сәуле шығарудың кванттық теориясын (1900), ағылшын физигі Э. Резерфордтың атомның планетарлық моделін (1911) жасауы, Н. Бордың атомның құрылыс теориясын ұсынуы (1913) атомның күрделі табиғаты мен периодтық жүйе құрылымының физ. мәнін түсіндірді. Ағылшын физигі Г. Мозли еңбектерінің нәтижесінде Менделеев ұсынған әр элементтің рет нөмерінің оның ядро зарядымен тең болуы, сондай-ақ атомдағы электрондар санының анықталуы, олардың орналасуындағы периодтық заңның тұтастай ішкі сырын ашты. Бор теориясын әрі қарай неміс физигі А. Зоммерфельдтің дамытуы, кейін швейцариялық физик В. Паули принципінің шығуы электрондық әр қабықта орналасу заңдылығын анықтады. Қазіргі Э. п. ж. 126 хим. элементті қамтиды, олардан трансуран элементтері (Z - 93 - 110) және кейбір элементтер Z - 43 (Tc), 61 (Pm), 85 (At), 87 (Fr) жасанды жолмен алынған. Менделеев периодтық жүйені жасағаннан бері оны кеңістікте немесе жазықтықта орналастырудың графиктік әр түрлі нұсқалары ұсынылғанмен, Менделеевтің ықшамды қысқа және ұзын периодты кесте түріндегі нұсқасы көбірек қолданылады.
Периодтық жүйесінің құрылымы
Қазіргі кездегі периодтық жүйеде барлық элементтер рет бойынша нөмірленген . Элементтердің нөмерін реттік немесе атомдық нөмер деп атайды. Химиялық элементтердің периодтық жүйесін құрастырудағы негізгі принцип - барлық элементтердегі периодтар мен топтарға бөліп орналастыру. Әр топ өз кезегіндегі негізгі (а) және қосымша (б) топшаларға бөлінеді (периодты кестенің ұзын түрін қара) . Топшалардағы элементтер өзара химиялық қасиеттері жағынан өте ұқсас.
Периодтар
Период деп сілтілік металдан басталып инертті газбен аяқталатын элементтер тобын айтады. Периодтар горизонталь қатардан тұрады. Периодтық жүйеде 7 период бар, олар рим сандарымен белгілеген, I, II және III периодтар бір қатардан тұрады және кіші периодтар деп аталады, ал IV, V, VI, VII периодтар екі қатардан тұрады, оларды үлкен периодтар деп атайды. Бірінші периодта-2 элемент, екінші және үшіншіде-8-ден, төртінші мен бесіншіде-18-ден, алтыншыда-32, жетіншіде(аяқталмаған) -32 элемент бар. Әрбір период, біріншіден басқасы, сілтілік металдан басталып, инертті элементпен аяқталады.
1. Дмитрий Иванович МенделеевДмитрий Иванович Менделеев ( 27 қаңтар (8 ақпан) 1834, Тобольск - 20 қаңтар (2 ақпан) 1907, Санкт-Петербург) - орыс энциклопедист-ғалымы: химигі, физигі, физикалық химигі, метролог, экономист, технолог, геолог, метеоролог, педагог, мұнайшы, аэронавт. Петербург Ғылым Академиясының корреспондент мүшесі (1876) .
1834 ж. 27-қаңтарда Ресейдің Тобольск қаласында дүниеге келген. Санкт-Петербург Бас педагогикалық институтын бітірген (1855) . Ғылыми-зерттеу жұмыстарының негізгі бағыты жалпы химия, химиялық технология, физика, экономика, ауыл шаруашылығы, метрология, т. б. салаларға арналған. Ол изомерия құбылысын зерттеп (1854 - 56), сұйықтықтың тығыздығын анықтайтын құрал - ареометр құрастырды (1859) . “Органикалық химия” деген алғаш орыс тілінде оқулық шығарды (1861) . Сұйықтардың қайнауының абсолют температурасын (1860), гидраттық теорияны (1865 - 87), жаратылыстың негізгі заңдарының бірі - периодтық заңды ашты (1869) . Сонымен қатар молекуланың массасын табудың Клапейрон - Менделеев теңдеулерін шығарды. Мұнайдың ауыр металдар карбидтерінен түзілу гипотезасын (1877), көмірді жер астында газға айналдыру идеясын (1880) ұсынды. Менделеев 1907 ж. 20-қаңтарда Санкт-Петербургте қайтыс болды. Менделеевтің құрметіне жасанды жолмен алынған радиоактивті химиялық элемент менделевий аталды.
Өмірі мен қызметіМенделеевтің әкесі осы қаладағы гимназияның директоры болатын. Гимназияны аяқтағаннан кейін ол Петербургтегі педагогика институтына түсіп, оны алтын медальмен бітіріп шықты (1857 ж. )
1859 жылы магистрлік диссертациясын қорғаған соң ол екі жылға Германияға ғылыми іс сапарға жіберілді. Қайтып оралған соң алдымен Петербург технологиялық институтының, екі жылдан кейін осы қаладағы университеттің профессоры болып сайланып, осы жерде 23 жыл бойына жемісті еңбек етті.
Д. И. Менделеев 1876 ж. Петербург Ғылым академиясының корреспондент мүшесі болып сайланды.
Ол 90-жылдардағы студенттер толқулары кезінде өз оқушыларының жағында болып, оларды қорғағаны үшін университеттен кетуге мәжбүр болды.
Д. И. Менделеев үнемі іздену үстінде көп жылдар бойы қарқынды еңбек еткен ғалым. Осы еңбектерінің ең биік шыңы, оны дүние жүзі ғалымдарының қатарына қосқан әрине, «Периодтық заңды» ашуы болды. Бұдан басқа ол «Ерітінділердің гидраттық теориясын» ұсынған, бұл еңбек әлі күнге дейін өзінің құндылығын жоғалтқан жоқ. Мұнан бөтен ол табиғи пайдалы қазбаларды жан-жақты толық пайдалануға, көптеген технологиялық үдерістердің ғылыми негізін қалауда да аса көп еңбек еткен ғалым.
Д. И. Менделеевтің «Химия негіздері» атты еңбегінде бейорганикалық қосылыстар химиясы периодтық заң тұрғысынан алғаш рет теориялық негізделіп түсіндірілді.
Өз заманының үлкен ойшыл ғалымы Д. И. Менделеевке ғылымға сіңірген теңдесі жоқ зор енбегі үшін Фарадей атындағы алтын медаль берілді.
2. Д. И. Менделеев кестесіД. И. Менделеев ашқан периодтық заңның кестелік (графиктік) бейнесі (қ. Менделеевтің периодтық заңы) . Менделеев элементтерді периодтық жүйеге орналастырғанда олардың атом. салмақтарының өсуіне, сонымен қатар олардың хим. қасиеттерінің өзгеруіндегі периодты заңдылыққа сүйенді. Ол кестедегі кейбір элементтерді (Co - Nі, Te - І) атом. салмақтарының өсу бағытына сай емес, хим. ұқсастығына қарай орналастырды, бірнеше элементтердің сол кезде қабылдаған атом салмақтарын 1, 5 - 2 есе өзгертті (Іn, Cl, U, т. б. ) . Алғашқы кестеде Менделеев әлі ашылмаған бірнеше элементтер бар екенін болжап, оларға кестеде тиісті орын қалдырып, кейбір қасиеттерін күні бұрын айтып берді. Сондай болжанған “экоалюминий” (1875 ж. француз химигі П. Лекок де Буабордан ашқан қазіргі галлий Ga), “экабор” (швед ғалымы Л. Нильсон 1879 ж. ашқан скандий Sc) және “экасилиций” (1886 ж. неміс ғалымы К. Винклир ашқан германий Ge) элементтері кейін ашылды. Сонымен қатар Менделеев марганецке (қазіргі технеций Тс және рений Re), теллурге (полоний Ро), йодқа (астат At), цезийге (франций Fr), барийге (радий Ra), танталға (протактиний Ра) ұқсас элементтердің бар екенін айтқан. Күні бұрын болжанған қасиеттер мен анықталған қасиеттердің дәл келуі Менделеевтің периодты заңын дүние жүзі ғалымдарына танытты. Радиоактивтік ыдыраудың (1806), рентген сәулелерінің (1895) ашылуы, неміс физигі М. Планктің сәуле шығарудың кванттық теориясын (1900), ағылшын физигі Э. Резерфордтың атомның планетарлық моделін (1911) жасауы, Н. Бордың атомның құрылыс теориясын ұсынуы (1913) атомның күрделі табиғаты мен периодтық жүйе құрылымының физ. мәнін түсіндірді. Ағылшын физигі Г. Мозли еңбектерінің нәтижесінде Менделеев ұсынған әр элементтің рет нөмерінің оның ядро зарядымен тең болуы, сондай-ақ атомдағы электрондар санының анықталуы, олардың орналасуындағы периодтық заңның тұтастай ішкі сырын ашты. Бор теориясын әрі қарай неміс физигі А. Зоммерфельдтің дамытуы, кейін швейцариялық физик В. Паули принципінің шығуы электрондық әр қабықта орналасу заңдылығын анықтады. Қазіргі Э. п. ж. 110 хим. элементті қамтиды, олардан трансуран элементтері (Z - 93 - 110) және кейбір элементтер Z - 43 (Tc), 61 (Pm), 85 (At), 87 (Fr) жасанды жолмен алынған. Менделеев периодтық жүйені жасағаннан бері оны кеңістікте немесе жазықтықта орналастырудың графиктік әр түрлі нұсқалары ұсынылғанмен, Менделеевтің ықшамды қысқа және ұзын периодты кесте түріндегі нұсқасы көбірек қолданылады. Э. п. ж-н құрастырудағы негізгі принцип - барлық элементтердегі периодтар мен топтарға бөліп орналастыру. Әр топ өз кезегіндегі негізгі (а) және қосымша (б) топшаларға бөлінеді (периодты кестенің ұзын түрін қара) . Топшалардағы элементтер өзара хим. қасиеттері жағынан өте ұқсас. Период деп сілтілік металдан басталып инертті газбен аяқталатын элементтер тобын айтады. Әр периодта 2, 8, 18, 32 элемент болады. Бірінші периодтың ерекшелігі - онда екі элемент қана Н, Не орналасқан. Сутектің сілтілік металдарға да, галогендерге де ұқсайтын ортақ қасиетіне байланысты оны көбіне Іa кейде VІҚа топшаға да орналастырады. Екінші периодтта 8 элемент ( Lі - Ne) бар. Ол сілтілік металл литийден Lі басталады, одан кейінгі ІІ валентті Ве металл, ал ІІІ валентті В элементтінің металдық қасиеті кеміп, ІV валентті көміртектен бейметалдар басталады, олардың (N, О, F) тотығу дәрежелері теріс. Период инертті газ - неонмен (Ne) аяқталады. Үшінші периодта да 8 элемент орналасқан (Na - Ar) . Олардың қасиеттерінің өзгеру сипаты екінші период элементтеріне ұқсас, дегенмен Mg-мен Al-дің Ве-мен В-ға қарағанда металдық қасиеті басымдау, сондай-ақ бейметалдар - P, S, Cl-дың екінші периодтағы “ұқсастардан” айырмашылығы олар өздеріне тән ең жоғары оң валенттіктерін көрсете алады. Менделеев 2 және 3-период элементтерін типтік элементтер деп атаған, себебі олардың бәрі де табиғатта кең таралған. Алғашқы 3 периодтың элементтері негізгі топшаларға (а) ғана кіреді. Қазіргі технологиялар бойынша бұл периодтардың алғашқы екі элементі (сілтілік және сілтілік-жер металдар) Қа-, ІҚа- топшаларды құрайтын s-элементтерден тұрады (кестеден қызыл түске боялған), қалған алтауы (B - Ne, Al - Ar) ІІҚа, VІІҚа-топшаларды құрайтын р-элементтерден тұрады (кестеде сары түсті) . Кіші периодтар деп аталған бұл үш период элементтерінің рет нөмірі артқан сайын атом радиустары кішірейіп, кейінгі атомның сыртқы қабығындағы электрондар саны көбейгенде, олардың өзара ығысуының күшеюінен атом радиустары ұлғая бастайды. Ең үлкен радиус периодтың басында орналасқан сілтілік металға тән. Осындай заңдылық иондар радиусының өзгеруінен де байқалады. Төртінші периодта 18 элемент бар ( К - Кr), ол - үлкен периодтардың алғашқысы. Мұнда сілтілік және сілтілік-жер металдардан кейін ауыспалы деп аталатын 10 элемент (Sc - Zn) орналасады. Бұларды d - элементтер деп атайды (кестеде көк түсті), олар да қосымша топшаларға кіреді. Ауыспалы элементтер түгелдей металдар, Fe - Co - Nі триадасынан басқасы өздеріне тән ең жоғары валенттіктерін көрсетеді. Соңғы алты p-элементтер (Ga - Kr) негізгі топшаға (a) кіреді, қасиеттерінің өзгеруі бұрын айтқан ІІ және ІІІ период элементтеріне ұқсас. Бесінші периодта 18 элемент (Rb - Xe) бар, құрылысы төртінші периодқа ұқсас. Одан айырмашылығы ауыспалы элементтер де, ксенон да (Xe) өзіне тән ең жоғары оң валенттіктерін көрсете алады. Соңғы галоген - иодта аздаған металдық қасиет пайда болады. Алтыншы периодта 32 (Cs - Rn) элемент бар. Онда ауыспалы 10 элементпен (La, Hf - Hg) қатар 14 f - элементтер, лантаноидтар (кестеде жасыл түсті) орналасқан. Жетінші периодта да францийден (Fr) басталатын 32 элемент болуға тиісті, бірақ ол әлі аяқталмаған (12 элемент әлі табылған жоқ) . Мұнда да алтыншы периодтағыдай 89-элементтен кейін 14 f - элементтер - актиноидтар орналасқан (Th - Lr) . Олардың тотығу дәрежесі лантаноидтардан де жоғары болады (ІІІ - VІІ) . Лантаноидтар мен актиноидтар кестенің түрі ықшамды болу үшін төменірек жеке екі қатар етіп орналастырылған. Оларды кестедегі өздерінің заңды орнына қойып горизонталь периодтарды ұзартсақ периодтық түр шығады. Онда атомдардың электрондық құрылымына сай ұқсастығын анығырақ байқауға болады. Қысқа кестедегі топ нөмірі, жалпы алғанда, ондағы элементтердің валенттігі электрондар санына сай келеді. Бір топшадағы элементтердің ұқсастығы олардың валенттік қабаттарының электрондық конфигурациясының периодты түрде қайталанып келіп отырғандығымен түсіндіріледі. Элементтер қасиеттерінің периодты түрде қайталануы олардың электрондық құрылымының периодты қайталануымен сай келетіні де осыдан.
Химиялық элементтердің периодтық жүйесі маңызыХимиялық элементтердің периодтық жүйесі - периодтық заңның графиктік бейнесі, олар өзара тығыз байланысты, бірін-бірі толықтыра түседі. Екеуі де хим. элементтерді материя дамуының бір сатысы деп қарап, олардың арасындағы табиғи байланысты ашады. Периодты заң химия ғылымына ғана жатпайды, ол бүкіл жаратылыстану және табиғи ғылымдардың ортақ заңы, сондықтан ғылыммен бірге дамып, оны байыта түседі.
Химиялық элементтердің периодтық жүйесі ашылған кезде көптеген элементтер белгісіз еді. Д. И. Менделеев аса үлкен болжампаздықпен олардың кейбіреулерінің қасиеттерін сипаттаған болатын (скандий - Л. Нильсон, галлий - Лекок де Буабодран, германий - К. Винклер) .
Ғалымның көзінің тірісінде ол болжаған элементтер ашылып, периодтық заңның дұрыстығының айғағы болды.
Галлий Ga 1875 ж., скандий Sc 1879 ж., германий (Ge) 1885 ж. ашылды. Д. И. Менделеев есептеу жолымен анықтаған сипаттамалары олардың тәжірибе жүзінде анықталған шамаларына сәйкес келеді. Периодтық заң ашылған кезде белгісіз бекзат газдар да қасиеттеріне қарай галогендер мен сілтілік металдар арасынан орын алды.
Заңның ашылған кезінде кейбір элементтердің валенттіліктері мен атомдық массалары дұрыс анықталмаған еді. Элементтердің қасиеттерінің өзгеру заңдылықтары сақталатындай етіп, Менделеев бериллийдін, (Be), торийдің (Тһ), церийдің (С1), индийдің (In), т. б. кейбір элементтердің атомдық массаларын түзетті.
3. Менделеев кестесіндегі Э. Шредингер теңдеуіКванттық механикадағы бөлшектің күйін, координат пен уақытқа тәуелді Ψ(x, y, z, t) толқындық функцияның берілуі бойынша анықталатындығын өткен дәрістерде біз түсіндірген болатынбыз. Сондықтан, кванттық механикадағы толқындық функцияның түрін іздеу үшін, классикалық механикадағы Ньютонның қозғалыс теңдеуі сияқты теңдеуді алу керек. Мұндай теңдеуді 1926 жылы Э. Шредингер тапты. Шредингер теңдеуі қорытылмайды, ол белгілі тәжірибелік фактілер негізінде постулаттандырылады және оның растығы теориялық есептер мен тәжірибелік мәліметтердің сәйкес келуімен дәлелденеді. Жалпы жағдайда Шредингер теңдеуінің түрі
, (11. 1)
мұндағы m - бөлшектің массасы,
 Дж⋅с - 2π-ге бөлінген Планк тұрақтысы,
Дж⋅с - 2π-ге бөлінген Планк тұрақтысы,
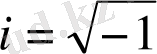 - жорамал сан, Ψ(x, y, z, t) - толқындық функция, U(x, y, z, t) - күштік өрістегі бөлшектің потенциялдық энергиясы,
- жорамал сан, Ψ(x, y, z, t) - толқындық функция, U(x, y, z, t) - күштік өрістегі бөлшектің потенциялдық энергиясы,
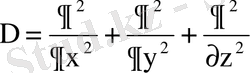 - Лаплас операторы.
- Лаплас операторы.
(11. 1) теңдеуі v<<c жылдамдықпен (с - вакуумдағы жарық жылдамдығы) қозғалатын кез-келген микробөлшек үшін орынды. Шредингер теңдеуі Ψ(x, y, z, t) толқындық функциясына қосымша шарттар қояды:
- Ψ (x, y, z, t) толқындық функциясы шекті, үздіксіз және бірмәнді болуы қажет;
- Ψ(x, y, z, t) толқындық функциясыүздіксіз дербес туындыларға ие болуы керек;
3. Ψ(x, y, z, t) функциясы интегралдануы керек, яғни
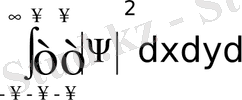 интегралы шекті болуы қажет.
интегралы шекті болуы қажет.
(11. 1) Шредингер теңдеуі жалпы жағдай үшін шешілмейді. Бірақ, бұл теңдеудегі потенциялық энергия уақытқа тәуелсіз, яғни бөлшек қозғалатын күштік өріс стационарлы болатын есептер үшін қысқартуға болады. Бұл жағдайда Ψ(x, y, z, t) толқындық функцияны екі толқындық функцияның көбейтіндісі ретінде жіктейміз: ψ(x, y, z) - тек координатқа тәуелді және ϕ(t) - тек уақытқа тәуелді:
. (11. 2)
(11. 2) өрнегін (11. 1) Шредингер теңдеуіне қойып, мынаны аламыз
.
Соңғы теңдеудің оң және сол жағын ψ⋅ϕ көбейтіндісіне бөлеміз:
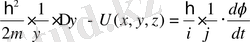 . (11. 3)
. (11. 3)
Теңдеудің сол жақ бөлігі тек координатқа, ал оң жақ бөлігі тек уақытқа тәуелді болғандықтан, бұл теңдіктің әр жағы жеке-жеке тұрақты бір шамаға тең болған жағдайда ғана орындалады. Ол тұрақты шама энергияның өлшемін иемденуі керек және U(x, y, z) потенциялық энергиясы бар күштік өрістегі қозғалатын бөлшектің толық энергиясы болуы керек, яғни -Е . Осыдан екі теңдеу аламыз: біріншісі тек уақытқа тәуелді
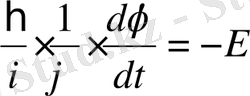 , (11. 4)
, (11. 4)
екіншісі тек координатқа тәуелді (Шредингердің стационарлы теңдеуі)
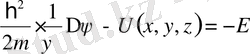 ,
,
мұны келесі түрде жазуға болады:
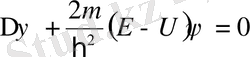 . (11. 5)
. (11. 5)
Шрёдингердің стационарлық теңдеуі (11. 5) кез-келген U(x, y, z) үшін шешіле бермейді, бірақ кейбір дербес жағдайларда бұл теңдеудің шешімін табуға болады. Берілген U(x, y, z) үшін Шредингер теңдеуін қанағаттандыратын толқындық функциялар меншікті функциялар деп, ал осы кездегі Шредингер теңдеуінің шешімі табылатын Е-нің мәндері энергияның меншікті мәндері деп аталады. Айнымалы шамаларды бөле отырып (11. 4) теңдеуін интегралдауға болады
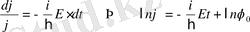 .
.
Соңғы теңдеуден (11. 4) теңдеуді қанағаттандыратын толқындық функцияны аламыз
, (11. 6)
мұндағы ϕ 0 - ϕ функциясының амплитудалық мәні.
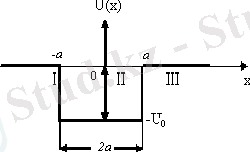
Бір өлшемді потенциалдық шұңқырдағы электронның қозғалысы туралы есепті қарастырып көрейік. Потенциалдық шұңқыр деп 11. 1-суретте көрсетілгендей түрі бар, U(x) -тың х-қа тәуелділігін айтады.
Мұндай қозғалыстың, мысалы ретінде металл ішіндегі электрондардың қозғалысын қарастыруға болады. Бұл жағдайда металл сыртындағы электрон ның потенциалдық энергиясы нөлге тең. (11. 1-суреттегі І және ІІІ аймақтар - шұңқыр сырты x>a, U=0), ал металл ішіндегі потенциялы теріс мәнге ие және электронның металдан шығу жұмысына тең (11. 1 суреттегі ІІ аймақ, шұңқыр іші, x<a, U=-U 0 ) .
11. 1-сурет. Бірөлшемді потенциалдық шұңқыр.
Потенциалдық шұңқырдың ені 2а. Электрон қозғалысы бір өлшемді болғандықтан (ОХ осі бойымен), толқындық функция тек х осіне тәуелді болады және Лаплас операторының түрі
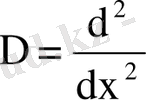 . Е<0 екенін ескеріп, Шредингер теңдеуін І, ІІІ аймақтар және ІІ аймақ үшін мына түрде жазамыз:
. Е<0 екенін ескеріп, Шредингер теңдеуін І, ІІІ аймақтар және ІІ аймақ үшін мына түрде жазамыз:
Ι және ΙΙΙ :
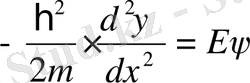 , (11. 7)
, (11. 7)
ΙΙ:
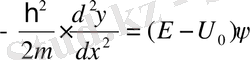 . (11. 8)
. (11. 8)
(11. 7) теңдеуін келесі түрде жазайық
және
(11. 9)
деп белгілейік. Олай болса І және ІІІ аймақтар үшін Шредингер теңдеуі мына түрге келеді
. (11. 10)
Бұл теңдеудің шешуі келесі түрдегі толқындық функция болып табылады:
. (11. 11)
ψ(х) функциясы шекті функция, олай болса х=±∞ мәндерінде ψ(х) шекті болуы үшін А=В=0 болуы керек, яғни І- және ІІІ- аймақтар үшін ψ(х) =0. Олай болса ψ 2 =0, ал мұның мағынасы І- және ІІІ- аймақтардағы электронды байқау ықтималдығы нөлге тең екенін білдіреді.
Енді потенциалдық шұңқыр ішіндегі (ІІ аймақ) электрон қозғалысын қарастырайық. Ол үшін (11. 8) теңдеуін мына түрде жазайық
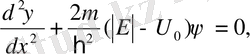
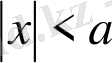 , (11. 12)
, (11. 12)
мұндағы
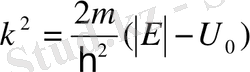 . (11. 13)
. (11. 13)
ІІ аймақ үшін Шредингер теңдеуін аламыз, x<a
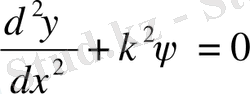 . (11. 14)
. (11. 14)
Бұл (11. 14) теңдеуінің шешімі келесі түрдегі толқындық функция болады
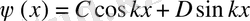 , (11. 15)
, (11. 15)
мұндағы С және D - шекаралық шарттардан анықталатын тұрақты коэффициенттер. Толқындық функция үздіксіз болу керек, сондықтан І және ІІ аймақтар шекарасы үшін
ψ І (- a ) =ψ ІІ (- a ) шарты орындалуы керек, ал ІІ және ІІІ аймақтар шекарасы үшін ψ ІІ ( a ) =ψ ІІІ ( a ) шарты орындалуы керек. Толқындық функцияның үздіксіз шарттарынан потенциалдық шұңқырдың шекарасында келесі шарттар шығады
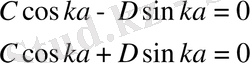 . (11. 16)
. (11. 16)
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz