Аммиак пен аммоний тұздары, азот оксидтері және фосфор: зертханалық әдістер мен қасиеттері


АММИАК ЖӘНЕ АММОНИЙ ТҰЗДАРЫ
Аммиак азоттың сутекті қосылысы. Аммиак өзіне тән өткір иісі бар, ауадан жеңіл, суда жақсы еритін газ. Қалыпты температурада судың бір көлемінде аммиактың 700 көлемі ериді. Аммиактың судағы ерітіндісі - аммоний гидроксиді немесе мүсәтір спирті деп аталады. Аммоний ионы
 бір валентті металдың рөлін атқарады. Аммоний гидроксиді қышқылдармен әрекеттесіп, аммоний тұздарын түзеді. Аммонийдің барлық дерлік тұздары суда жақсы ериді. Ерітінділері күшті диссоциацияланады. Аммоний тұздарына сілтілермен әсер еткенде аммиак бөлінеді, т. б.
бір валентті металдың рөлін атқарады. Аммоний гидроксиді қышқылдармен әрекеттесіп, аммоний тұздарын түзеді. Аммонийдің барлық дерлік тұздары суда жақсы ериді. Ерітінділері күшті диссоциацияланады. Аммоний тұздарына сілтілермен әсер еткенде аммиак бөлінеді, т. б.
Жұмыстың мақсаты. Аммиак пен аммоний тұздарын алу және олардың аса маңызды қасиеттерімен танысу, аммоний тұздарын басқа тұздардан ажырата білу.
Құрал-жабдықтар. Газометр, жуғыш шынылар, азот алатын құрал, аммиакты синтездейтін құрал, екі цилиндр, құрғақ пробиркалар, аммиакты ерітетін шыны ыдыс, аммиакты айыратын құрал, темір штатив, спирт шам, газ жанарғысы, әр түрлі түтіктер, шыны таяқшалар, сіріңке, ағаш жаңқасы, вазелин, шыны пластинкалар.
Реактивтер. Құрғақ кальций гидроксиді, аммоний хлориді, калий перманганаты, натрий гидроксиді, аммоний карбонаты, концентрациялы азот қышқылы, тұз қышқылы, 25%-тік аммиак ерітіндісі, аммоний хлоридінің канық ерітіндісі, т. б.
1 - тәжірибе. Аммиактың синтезі және айырылуы. Зертханада аммиакты синтездеу үшін азот пен сутегін катализатордың көмегімен қосу керек. Азотты зертханада алудың бірнеше тәсілі бар: соның бірі аммоний хлориді мен натрий нитритін қосу арқылы, екішпі жолы тең көлемдегі аммоний сульфаты мен калий дихроматын қосып қыздыру арқылы алу. Сутегін зертханада сутегі алатьш құралда сұйылтылған түз не күкірт қышқылын мырышпен әрекеттестіріп алуға болады. Азотты осы әдістердің бірімен газометрде жинау керек, ал сутегін тәжірибе уақытында алуға болады. Осыдан кейін аммиакты синтездейтін құралды құрастырыңдар. Азот пен сутегі газдарын концентрациялы күкірт қышқылы арқылы өткізіп жуып, кептіру керек. Ол ылғалды өзіне тартып алады. Осыдан кейін шыны түтіктің ішіндегі тотықсыздандырылған темір ұнтағын қатты қыздырып, газдар қоспасын өткізеді. Сонда аммиактың иісін және түтіктің ұшына жалғастырылған сіңіргіш шөлмектегі фенолфталеин түсінің өзгеруі арқылы кез жеткізуге болады. Бұл реакцияда темір жұмсалмайды, ол катализатор рөлін атқарады. Осылай катализатор және температура сутегі мен азоттың қосылу реакциясы үшін қажетті жағдайлар туғызады.
Егер сол температурада темір ұнтағын салған түтік арқылы қайтадан аммиак жіберіп, газ шығатын ұшына жанган сіріңке апарсақ, түтіктен шығып жатқан газ жанады. Ол аммиак айырылу реакциясының нәтижесінде түзілген сутегі екеніне көз жеткізуге болады. Реакция теңдеуін жазыңдар.
2-тәжірибе. Аммиакты зертханада алу. Ол үшін бірдей мөлшерде алынған құрғақ аммоний хлориді мен сөндірілген әкті қағаз бетіне салып, жақсылап араластырыңдар. Аммиактың бөлінгенін иісінен байқаңдар. Үлкен пробирканың 1/3 бөлігіне дейін осы заттардың қоспаларын салып, аузын имек түтігі бар тығынмен жауып, темір штативтің тағанына бекітіңдер. Жайлап қыздырып, бөлінген аммиакты төңкерілген пробиркада ауаны ығыстырып жияап алыңдар. Пробирканың аузын үлкен бармақпен басып, кристалдағыштағы суға батырыңдар да аузын ашыңдар. Пробирка суға толып кетеді. Пробиркадағы суға фенолфталеиннің ерітіндісін тамызсаңдар, судың күлгін түске боялғанын көресіңдер. Реакция теңдеуін жазыңдар.
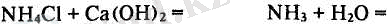
3-тәжірибе. Аммиакты мүсәтір спиртінен алу. Үлкен пробирканың 1/4 бөлігіне дейін мүсәтір спиртін құйып, аузын газ шығатын имек түтігі бар тығынмен бекітіп, темір штативтің тағанына бекітіңдер де жайлап қыздырыңдар. Бөлінген аммиакты ауаны ығыстыру арқылы жинап алыңдар да, оның қасиетімен танысыңдар.
4-тәжірибе. Аммиактың сумен әрекеттесуі. Жоғарыдағы тәжірибеден аммиактың суда жақсы еритіндігімен таныстыңдар. Аммиак суда тек еріп қана қоймайды, онымен химиялық байланысқа түседі. Бұл реакцияда аммиак молекуласы су молекуласынан бір протонды қосып алып, аммоний
 ионына айналады. Аммоний гидроксидінің ерітіңдісін суалтқанда аммоний оксидінің гидраты
NH
4
OH
бөлініп шықпайды. Бұл зат тек ерітіндіде ғана болады, ал қыздырғанда аммиак пен суға айырылады. Аммоний оксидінің гидраты сілті болғаңдықтан, оны басқа сілтілер сияқты қышқылдармен бейтараптауға болады. Аммоний тұздарының ерітінділерін суалтқанда кристалдары алынады.
ионына айналады. Аммоний гидроксидінің ерітіңдісін суалтқанда аммоний оксидінің гидраты
NH
4
OH
бөлініп шықпайды. Бұл зат тек ерітіндіде ғана болады, ал қыздырғанда аммиак пен суға айырылады. Аммоний оксидінің гидраты сілті болғаңдықтан, оны басқа сілтілер сияқты қышқылдармен бейтараптауға болады. Аммоний тұздарының ерітінділерін суалтқанда кристалдары алынады.
5-тәжірибе. Аммиактың оттегінде жануы. Бір-біріне кигізілген жанарғы түтіктер құрастырыңдар. Олардың біріншісі калий перманганатын қыздырғанда бөлінетін оттегі келетін түтікке, ал екіншісі мүсәтір спиртін қыздырғавда бөлінетін аммиак шығатын түтікке жалғасады. Екі газ бір түтіктің аузында қосылады.
Газдар шығып жатқан түтікке жанған шырпы апарганда аммиак от алып, жасылдау жалынмен жанады. Аммиак оттегінде жанғанда азот және су буы түзіледі. Реакция теңдеуін жазыңдар.
6-тәжірибе. Аммиактың ауада және катализатордың қатысында жануы. Қалыпты жағдайда аммиак ауада жанбайды, өйткені мұнда аммиактың жануына қажетті жылу бөлінбейді. Егер ауаны не аммиакты алдын ала күшті қыздырса, аммиак ауада жанады. Егер стақанға кыздырылған мүсәтір спирті арқылы оттегін жіберсе және қыздырылған плитка оралмасын сұйықтыққа тигізбей стақанға батырса, онда оралма өзінен-өзі қатты қызады. Олай болатыны оралманың бетінде аммиак молекулалары оттегі молекулаларымен әрекеттесіп, азот (II) оксиді мен су буы түзіледі. Бұл реакцияны аммиактың катализдік тотығуы деп атайды. Бұл реакцияда плитка оралмасы катализатор ретінде қатысады. Аммиакты тотықтыруға плиткадан басқа, кейбір металдардың оксидтері де мысалы, темір және хромның оксидтері катализатор бола алады. Реакция теңдеуін жазыңдар.
7-тәжірибе. Аммиактың қышқылдармен әрекеттесуі. Аммиак қышқылдармен оңай әрекеттеседі. Бұл реакцияда қышқылдың сутегі протоны аммиакқа қосылып, тұздың құрамында болатын аммоний тобы түзіледі.
Басқа тұздар сияқты, аммоний тұздары да иондардан құралған мысалы, аммоний нитраты
 және
және
 иондарынан тұрады. Бірақ басқа тұздардан айырмашылығы - оң зарядты ион (катион) күрделі болады. Мысалы, аммиактың тұз қышқылымен қосылуынан аммоний тұзы - аммоний хлориді түзіледі.
иондарынан тұрады. Бірақ басқа тұздардан айырмашылығы - оң зарядты ион (катион) күрделі болады. Мысалы, аммиактың тұз қышқылымен қосылуынан аммоний тұзы - аммоний хлориді түзіледі.
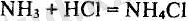
Аммоний хлоридінің түзілуін мынадай көрнекі тәжірибе жасап байқауға болады. Біреуі мүсәтір спиртіне, екіншісі концентрациялы тұз қышқылына мальшған екі ағаш таяқшаны бір-біріне жақыңдатыңдар. Ол екі таяқшаның аралығында қою ақ түтін пайда болады. Бұл түтін аммоний хлоридінің өте ұсақ кристалдарынан тұрады. Аммиак басқа да қышқылдармен қосылу реакцияларына түсіп, аммоний тұздарын түзеді. Молекуласының құрылысы жөнінде аммоний тұздары бір валентті металдардың тұздарына ұқсайды.
Аммоний тұздары
8-тәжірибе. Аммоний тұздарына температураның әсері. Аммоний тұздары қатты қыздырғанда қышқыл мен аммиакқа айырылады. Бұл аммоний тұздарына тән қасиет. Аммоний хлоридін NH 4 C1 пробиркаға салып қыздырғанда, ол иод сияқты возгонкаланады. Бірақ иодтың возгонкасы физикалық құбылыстар қатарына жатады, ал аммоний хлоридінің возгонкасы қайтымды химиялық реакция. Құрғақ пробиркаға шамалы аммоний хлоридін салып, аузын мақтамен тығындап, қыздырындар. Пробирканың жоғарғы жағындағы суық қабырғасына ақ қақ түрінде аммоний хлоридінің қонғанына назар аударыңдар. Аммоний хлориді қызған кезде хлорсутек түзетін болғаңдықтан, тұрмыста мүсәтір деген атпен дәнекерлеуіштің мыстан жасалған бетін тазалау үшін пайдаланылады. Дәнекерлеуішті қызған кезде аммоний хлоридіне (мүсәтірге) үйкеп немесе оның қанық ерітіндісіне батырса оның беті лезде тазарып, жылтырап шығады. Онда мынадай химиялық реакция жүреді:

9-тәжірибе. Аммоний карбонатының қыздырғанда айырылуы. Пробиркаға шамалы аммоний карбонатының кристалдарын салып, штативке бекітіп, қыздырыңдар. Тұздың газға айналып, түгелдей қалдықсыз ұшып кететініне назар аударыңдар. Аммоний карбонатының возгонкаланбайтынын түсіндіретін реакция теңдеуін жазындар. Аммоний карбонатының өткір иісі болады. Ол тұзды аузы берік тығындалатын ыдыста сақтамаса ол түгелімен су, аммиак, көмір (IV) оксвдіне айналады. Реакция теңдеуін жазыңдар.
10-тәжірибе. Аммоний тұздарын анықтау. Аммоний тұздары күшті сілтілермен басқа тұздардан өзгеше әрекеттеседі. Ол аммоний гидроксидін түзбейді, өйткені аммоний гидроксиді - тұрақсыз зат, ол лезде аммиак пен суға айырылып кетеді. Әр түрлі аммоний тұздарын алып, олардың әрқайсысына күйдіргіш натрдың 10%-тік ерітіндісін құйып, қайнау шегіне жеткізбей жайлап қыздырыңдар. Аммиак белінгенін иісінен анықтаңдар. Пробиркалардың аузына дымқылданған қызыл лакмус қағазын апарып, түсінің өзгеруін байқаңдар. Реакция теңдеуін жазыңдар. Барлық аммоний тұздарының сілтілермен әрекеттескенде аммиак бөле айырылатын жалпы қасиетін зертханада аммиак алуға қолданады.
АЗОТ ОКСИДТЕРІ. АЗОТ ҚЫШҚЫЛЫ. ФОСФОР ЖӘНЕ ОНЫҢ ҚОСЫЛЫСТАРЫ
Азот оксидтерінің бәрі химиялық активті заттар. Солардың ішінде аса маңыздысы азот (II) оксиді - түссіз, иіссіз, қиын еритін, қышқыл түзбейтін бейтарап оксид. Бірақ оттегін қалыпты жағдайдың өзіңде-ақ қосып алып, диоксидке айналады. Азоттың екінші бір маңызды оксиді - азот (IV) оксиді. Ол қоңыр түсті, ұнамсыз иісті, улы газ. Суда жақсы ериді. Сумен әрекеттесіп, азотты қышқыл және азот қышқылын түзеді. Сілтімен әрекеттесіп, тұздар түзеді. Азот қышқылы түссіз сұйықтық, меншікті салмағы 1, 53, ауада ашық тұрса, тұз қышқылы сияқты түтінденеді. Суда жақсы ериді. Азот қышқылы ең күшті қышқылдардың бірі, бірақ тұрақсыз. Жарықтың, жылудың әсерінен тез айырылып, су, оттегі және азот диоксидін түзеді. Азот қышқылы өте күшті тотықтырғыштың бірі, оның тұздарын нитраттар деп атайды.
Фосфор - өте маңызды элемент. Ол өсімдіктер мен жануарлар ақуызының (белоктарының) құрамына кіреді. Сүйек, қан, сүт, ми жүйке ұлпасы ақуызында (белоктарында) да болады. Фосфордың екі аллотропиялық түрі бар: ақ және қара фосфор, алайда олардың арасында - күлгін, қызыл түстілері де бар. Зертханада көбінесе қызыл фосфор пайдаланылады. Қызыл фосфорды табиғи қосылыстарынан алады.
Жұмыстың мақсаты. Азот оксиді мен азот диоксидін алу, нитраттардан азот қышқылын алып, олардың қасиеттерімен танысу. Қызыл фосфордан ақ фосфорды алу әдістерін үйреніп, олардың касиеттерімен танысу.
Құрал-жабдықтар. Вюрц колбасы, белгіш құйғыш, кристалдағыш, 500 мл-лік цилиндр, спирт шам, темір штатив, пробиркалар, химиялық стақандар.
Реактивтер. Мыс сым, концентрлі, сұйылтылған (1:2) азот қышқылы, концентрациялы күкірт қышқылы, 25%-тік аммиак ерітіндісі, калий, натрий, мыс, қорғасын нитраттары (ерітінділері және құрғақ тұздары), күкірт, ағаш көмірі.
1-тәжірибе. Азот (II) оксидін алу (жұмысты тартпа шкафта жүргізіңдер) . Вюрц колбасына мыс сымның бірнеше кесіндісін салып, құйғышты колбаға кигізіп, сол арқылы оның үстінен 4-5 мл сұйылтылған азот қышқылын құйыңдар. Егер реакция тым баяу жүрсе, қоспаны ептеп қыздырыңдар. Аздан кейін Вюрц колбасындағы ауа ығысты-ау деген кезде, өлшеуіш цилиндрдегі суды ығыстыру әдісімен газды жинаңдар және цилиндр газға толған мезгілде газ жүретін түтікті судан жоғары көтеріп, колбаны қыздыруды тоқтатыңдар. Су астындағы цилиндрдің ішінде шамалы су қалдырып, аузын басып, сыртқа алып шығыңдар да, ішіндегі диоксидті шайқап ерітіңдер. Осыдан кейін цилиндрдің аузын жоғары қаратып ашыңдар. Азот оксидінің түтінденіп, қоңыр газға айналғанын көріңдер. Цилиндрдің аузын қайта жауып, ішіндегі түзілген диоксидті сумен араластырыңдар. Азот оксидінің диоксидке айналуының реакция теңдеуін жазыңдар. Ерітіндіге лакмус ерітіндісін құйып, қышқыл екеніне көз жеткізіңдер.
2-тәжірибе. Азоттың диоксидін алу. (Жұмысты тартпа шкафта жасаңдар. ) Вюрц колбасына бірнеше түйір мыс жаңқасын немесе мыс сымнын кесіндісін салып, аузын тамшылатқыш құйғышы бар тығынмен жабындар. Құйғышқа концентрациялы азот қышқыльш құйындар. Вюрц колбасынын түтігін аузы жоғары қаратылған цилиндрге салып қойыңдар. Азот диоксиді ауадан ауыр болғандықтан ауаны ығыстыру арқылы жинайсыңдар. Осыдан кейін құйғыштан колбаға бірнеше тамшы қышқыл құйыңдар. Реакция қыздырусыз-ақ жүреді. Бөлінген қоңыр түсті азот диоксидін цилиндрге жинаңдар. Азот диоксиді жиналған цилиндрдің аузын шыны пластинкамен жауып, суы бар кристалдағышқа төңкеріп салыңдар да, судың ішінде шыны пластинканы алыңдар. Цилиндрге судың көтерілуіне көңіл аударыңдар. Азот диоксиді суда жақсы еріп, азоттың екі бірдей қышқылып түзеді. Оны лакмус қағазы арқылы сынап көріңдер. Реакция теңдеуін жазыңдар.
3-тәжірибе. Азоттың диоксидін аммиакты тотықтыру арқылы алу. Өндірісте аммиакты тотықтыру арқылы диоксид, одан азот қышқылын алады. Зертханада да азот қышқылын аммиакты тотықтыру арқылы алуға болады. Өндірісте аммиакты тотықтыруға платина катализаторы қолданылса, зертханада темір, хром, висмут, кобальт, марганец оксидтерінің бірін пайдалануға болады. Газометрді ауаға толтырыңдар. Колбаға аммиактың 25%-тік ерітіңдісін құйыңдар. Шыны түтікке хром (III) оксидін салып, оның екі жағынан асбест тампонмен бекітіңдер. Хром оксидінің астына шамалы асбест төсеңдер. Хром (III) оксидін аммоний бихроматын қыздыру арқылы алуға болады. Стаканға су құйып, оған түтікті батырыңдар. Ол азот диоксидін сіңіру үшін керек.
Тәжірибені түтіктегі катализаторды қыздырудан бастаңдар. Содан кейін газометрден су арқылы ығыстырып, ауаның ағынын бірқалыпты жіберіңдер. Ауаны торсық арқылы да үрлеп жіберуге болады. Ауа колбадағы аммиак ерітіндісі арқылы өткенде аммиактың ауамен қоспасы пайда болады. Ол катализаторы бар түтіктен өткенде тотығады. Түзілген азот оксидтері, ауа мен су булары колбаға келеді. Су булары мен азот оксидінің бірсыпырасы конденсацияланады. Қалған азот оксидтері стақандағы суға келіп сіңеді. Колбада азот қышқылы және ақ түтін түрінде аммоний тұздары болады.
Е с к е р т у: Аммиакты тотықтыруға таза оттегін де пайдалануға болады, бірақ катализатор қатты қызып, түтіктің сынуынан сақтану үшін, оқтын-оқтын салқындатып түру керек. Тотықтыруға оттегі пайдаланылған жағдайда азот диоксидінің шығымы да артық болады.
4-тәжірибе. Зертханада азот қышқылын алу. Зертханада азот қышқылын оның тұздарын концентрациялы күкірт қышқылымен әрекеттестіріп, қыздыру арқылы алады. Ретортаға 5-10 г шамасыңда калий немесе натрий нитратын салыңдар. Ретортаның тубулусы арқылы құйғышпен ішіндегі тұз тегіс ылғалданатындай концентрациялы күкірт қышқылын құйып, тубулусты тығынмен мықтап бекітіңдер. Ішінде қар араласқан немесе салқындатқыш ерітіндісі бар кристалдағышқа салынған колбаны ретортаның мойнына дейін кигізіңдер. Ретортадағы қоспаны жайлап қыздырыңдар. Азот қышқылы алғаш бу түрінде, одан салқыңдатқышқа батырылған колбаға сұйық күйінде жиналады. Колбаға азот қышқылы жиналған кезде қыздыруды тоқтатыңдар. Алынған азот қышқылының түсіне көңіл аударыңдар. Азот қышқылынан аздап азот диоксиді бөлінетіндіктен, алынған қышқылдың түсі сарғыштау болады. Құрал салқындағаннан кейін, колбадағы азот қышқылын құйып алындар. Шын азот қышқылы екенін сынап көріңдер. Ретортадағы қалдық коспаларды мүғалімнің нұсқауы бойынша жуыңдар.
Азот қышқылын алуға реторта болмаған жағдайда пробиркаларды пайдалануға болады.
Реакция теңдеуін жазыңдар.
5-тәжірибе. Азот қышқылының тотықтырғыштық қасиеті. а) жаңқаның азот қышқылында жануы. Азот қышқылының тотықтырғыштық қасиетін байқау үшін мынадай тәжірибе жасаңдар. Стақанды тік ұстап штативтің сақинасына асбест торы арқылы бекітіп, ішіне 5-10 мл қышқыл құйындар. Қышқылды жайлап спирт шаммен қыздырыңдар. Стақанға шала жанған ағаш шоғын жақындатыңдар, ағаш көмірінің жануына, қоңыр-қызыл түсті азот диоксидінің бөлінуіне назар аударыңдар. Азот қышқылының қыздырудан айырылуының реакция теңдеуін жазыңдар.
ә) скипидардың азот қышқылыңда жануы. 100 мл-лік стақанның ішіне (түбіне) 2-3 см құм салыңдар. Кәрлен тостағаншаға 3 мл-ден концентрациялы азот және күкірт қышқылының ерітінділерін құйып, стақандағы құмның үстіне орналастырыңдар. Кәрлен тостағаншадағы қышқылдардың үстіне тамызғышпен скипидар тамызыңдар. Әрбір тамшы скипидар қышқылдарға жанасқанда от алып жанады әрі көп түтін бөлінеді. Күкірт қышқылы бұл жерде су тартқыш рөлін атқарады.
6-тәжірибе. Қыздырудан азот қышкыл тұздарының айырылуы. 1. Жеңіл металдар тұздарының айырылуы. Пробирканы спирт шаммен қыздырыңдар. Калий селитрасы балқып, біраздан кейін майда көпіршіктер бөліне бастайды, ол - оттегі. Осы кезде шала жанған ағаш көмірін тастасандар, ол бірден от алып жана бастайды. Бұдан соң қыздыруды тоқтатыңдар. Жанған ағаш көмірінің үстіне бұршақтай күкірт салсаңдар, ол көз қаратпайтын жарық шығарып жанады.
Өндірісте оққа пайдаланатын қара дәріні қолдану азот кышқыл калий, натрий, т. б. жеңіл металдардың селитрасынан алуға негізделген. Оққа пайдаланатын қара дәрі үш заттың - калий селитрасы, көмір және күкірттің қоспасынан тұрады. Оқ-дәрі жанғанда реакция жүреді. Оны мына теңдеумен көрсетуге болады:
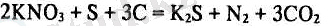
Реакция ете тез жүреді, әрі көп мөлшерде жылу бөлініп шығарады. Сол жылудың әсерінен реакция кезінде түзілген газдар азот, көмір (IV) оксиді өте қатты қызады. Егер реакция жабық жерде, мылтық гильзасында болса, онда газдардың көлемі ұлғайып, оқты немесе бытыраны итеріп шығарады. Атылған кезде газдармен бірге мылтықтан қатты түрдегі күкіртті калийдің өте ұсақ бөлшектері түтін түрінде бөлініп шығады.
2. Ауыр металдар тұздарының айырылуы. Екі пробирка алып, біріне азот қышқыл мыс, екіншісіне азот кышқыл қорғасын тұздарынан 0, 2-1 грамдай салыңдар. Пробиркаларды штативке сәл көлбеу бекітіп, жайлап қыздырыңдар. Тұздар балқымай, бірден қоңыр түсті азот диоксидін және оттегін бөліп, шытырлап айырыла бастайды. Ол реакцияларды мынадай теңдеулермен көрсетуге болады:
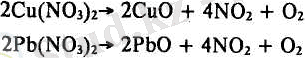
Азот диоксидінің бөлінгенін сары күрең түсінен, ал оттегінің бөлінгенін шала жанған шырпыны батырғаңда жарқырап жануынан көруге болады.
Фосфор және оның қосылыстары
7-тәжірибе. Қызыл фосфордың ақ фосфорға айналуы. Ұзыңдығы 15-20 см, диаметрі 1, 5-2 см болатындай шыны түтік алып, оның бір ұшын сәл ылғалданған қағаз тығынмен бекітіңдер. Екінші ұшы ашык болуы керек. Шыны түтіктің ортасына шыны таяқшамен бір түйір қызыл фосфор салып, түтікті штативке келбеу бекітіңдер. Түтіктің фосфор тұрған жерін бірден қыздырмай алғаш айналасын, сонан соң фосфорды түгелімен буға айналып кеткенше қыздырыңдар. Ақ фосфордың булары қыздырған жердің екі жағына сақина тәрізді болып қонады. Фосфордың ауада тез тотығуын көру үшін, қағаз тығынды алып, түтікті ауаның ағынында ары-бері қозғасаңдар ақ фосфор жанады, ал түтіктің екі ұшынан ақ түтін мен жалынды байқайсыңдар. Ақ фосфордың жануын байқағаннан кейін түтікті марганец қышқыл калий тұзының ерітіндісіне салыңдар. Ол әр түрлі улы қоспалардан сақтану үшін керек. Фосфор ауадағы оттегімен қосылып, фосфор (V) оксидін түзеді. Қосылыстың реакция теңдеуін жазыңдар. Жұмысты тартпа шкафта жасаңдар. Егер ақ фосфорды басқа мақсаттарда пайдаланғыларың келсе, онда әлгі қызыл фосфорды возгонкалаған түтіктердің тығынын ашпай, бірден стақандағы ыстық суға батырыңдар. Ақ фосфор жібіп стақанның түбіне түседі, оны келесі тәжірибелерге пайдалануға болады. Ақ фосфорды су астында сақтайды.
8-тәжірибе. Ак және қызыл фосфордың тұтанғыштық қасиеттерін салыстыру. Металл пластинканы темір штативтің тағанына бекітіп, оған бір-бірінен алыстау етіп ақ және қызыл фосфорды салындар. Одан кейін металл пластинканың қызыл фосфор салған жағын жайлап оқтын-оқтын қыздырыңдар. Жалыннан алыс тұрса да қыздырудың әсерінен ақ фосфор бірден жанып кетеді де, ал қызыл фосфор сәл ғана бықсиды, ал одан әрі қыздырсаңдар жанады. Қызыл фосфор қалыпты жағдайда тотықпайтыңдықтан, құрғақ күйінде шыны сауыттарда сақталады, бірақ ол ылғал тартқыш зат. Қызыл фосфор улы емес, суда ерімейді.
9-тәжірибе. Қызыл фосфор қосылыстарының от алуы. Бертолле тұзы жанғыш затпен мысалы, күкіртпен араластырылған күйінде шырпынын басында болады, ал қызыл фосфор өте ұсақ үгітілген шынымен және желіммен бірге шырпы қорабының бүйіріне жағылады. Шырпының басын қораптың бүйіріне үйкегенде фосфор Бертолле тұзымен қосылып, от алады. От алған фосфордан шырпының басындағы күкірт немесе басқа оңай от алғыш заттар тұтанады. Қызыл фосфордың Бертолле тұзымен қоспасын сәл үйкесе немесе үстінен басса да от алып, қопарылыс береді. Реакция теңдеуін жазыңдар:

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz