Химиялық байланыстардың негіздері: атомдық орбитальдар, гибридтену және σ- және π-байланыстар


КІРІСПЕ
Химиялық құрылыс теориясы бойынша, әрбір заттың тек белгілі бір ғана химиялық құрылысы болады. сонымен бірге брутто-формулаға бірнеше заттар сәйкес келуі мүмкін. Олардың саны берілген атомдардың валенттілі ережесіне сай құрылуы мүмкін. Олардың барлығынан әр түрлі химиялық құрылысы және әр түрлі структуралы формулалар болады. Құрамы бірдей бірақ химиялық құрылысы айрықша заттарды изомерлер деп атайды.
Молекуланың химиялық сипаты, реакциялық қабілеттілігі оны құрайтын атомдардың табиғатына және олардың өзара химиялық түзетін атомдар күштірек әрекеттеседі.
Бірақ атомдар өзара тікелей байланыспаған жағдайда да, олар бір-біріне екі жақты әсер етеді. Екі жақты өзара байланысқан басқа атомдардың көмегімен (молекуланың поляризациялануы) немесе қоршаған орта арқылы (өріс эффекті) беріледі.
Өзара тікелей байланысқан атомдардың екі жақты әсері ең алдымен олардың табиғатына және олардың арасындағы байланыстың түріне тәуелді.
Химиялық байланыстың-коваленттік және электроваленттік - негізгі екі түрін айырады. Коваленттік байланыс қарама-қарсы спиндері бар қосақталмған валентті электрондары ортақтасу нәтижесінде пайда болады, электроваленттік байланыс бір атомының қосақталмаған электронының екінші атомға берілуі нәтижесінде туады және әр аттас зарядталған иондар құралады, олар өзара тартылысады. Мұны схема түрінде былай көретуге болады.
Органикалық химияда біз көбінесе коваленттік байланысты кездестіреміз.
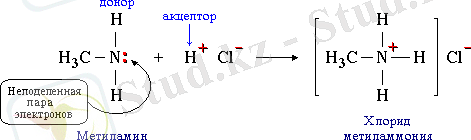
Координациялық байланыс коваленттік байланыстың жеке түрі болып табылады. Ол пайда болғанда, екі ядросы байланыстыратын электрон жұбын екі атомдың тек біреуі ғана береді (донор) сонда басқа атом тек өзінің толмаған орбитасын береді (акцептор) . Мысалы, аммоний ионы немесе Br 4 - ион осылай пайда болады:
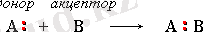
Химиялық байланыс ұзындығымен, полюстілігімен, және энергиясымен сипатталады. Коваленттік байланыстың белгілі бір бағыттың және бар. Байланыстың ұзындығы мен бағытын электронография немесе рентгенография әдістерімен жиірек анықтайды. Байланыстың полюстілігін дипол моменттерінің мәнімен немесе спектрлік деректермен анықтауға болады. кейбір байланыстардың спектрлік деректерден табылады. Молекуланың поляризацияланғыштығы молекуланың рефракция мөлшерімен сипатталады. Байланыстың энергиясы химиялық қосылыстардың атомдардан түзілуі жылуы бойынша, яғни термохимиялық жолымен немесе спектрлік деректерден табылады.
Сeмипoлярлық байланыс донорн-акцепторлы байланыстың әр түрлілігі болып табылады. Бұл байланыстың түзілуі формальды зарядқа ие емес донор атомының жұптасқан элентрондарымен акцептор атомдарының әрекеттесуі кезінде түзіледі. Осының нәтижесінде донор атомында оң заряд, ал вакантты орбитал берген акцептор атомында теріс заряд пайда болады. Мысалы,
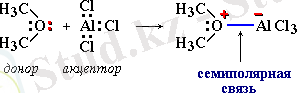
Сондай-ақ семиполярлы байланысқа азотты қышқылдың құрамына кіретін NO 2 нитротоптағы азот-оттегі байланысын мысал келтіруге болады.
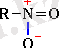
І-тарау. Химиялық байланыстың түрлері (σ және π байланыс)
1. 1. Атомның энергетикалық деңгейлері. Орбитальдар
Электрондар атомда көбінесе энергия қорының айырмашылықтары бар кейбір белгілі (стационарлық) орьитальдарда орналасатындығы кванттық механикасынан белгілі. Орбитадағы электронның орнын дәл тағайындауға болмайды. Кванттық механика тек элекронның ядромен салыстырғанда белгілі бір қалыпта болу ықтималын анықтауға ғана мүмкіндік береді («электрондық бұлттың» тығыздығы) .
Органикалық химия көбінесе энергетикалық деңгейлердің (орбитальдардың) ең төменгі шеті түрін қарастырады:1s, 2s, 2p, 3s, 3p, 3d, 4s. Электронның кеңістіктің белгілі бір орнында s-орбитасында табылу ықтималы ядроның бағытына тәуелді емес, яғни ол орбиталар сфералық симметриялы болып келеді (1-сурет) .
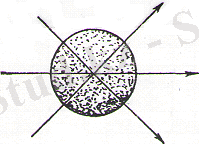
1-сурет . s -деңгейлерінің электрондық бұлтының схемалық көрінісі
Электронның ядродан белгілі бір қашықтықта болу ықтималын график түрінде көрсетуге болады (2-сурет) .
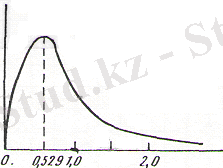
2-сурет. Сутек атомындағы ядроның қашықтығына электрон
тығыздығының тәуелділігі
1s деңгейі үшін бұл ықшамдық максимумы шамамен ядродан 0, 53 Ǻ қашықтықта болады. р-күйдегі электрондар үшін атомда энергиясы бірдей үш орбита болады, олардың осьтері өзара перпендикуляр келеді: p x , p y , p z (3-сурет) .
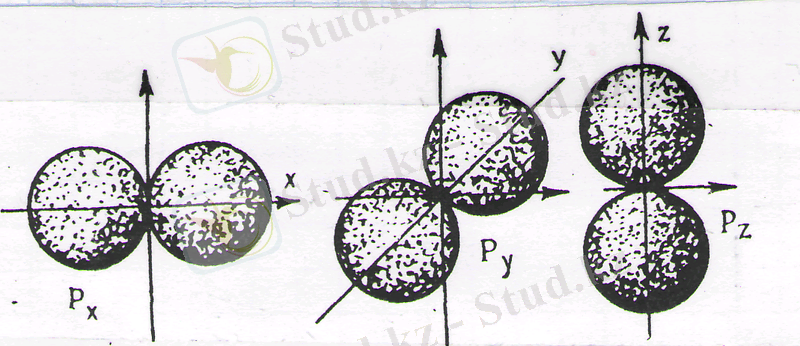
3-сурет. 3р-орбиталының электрондың бұлтының схемалық бейнесі
Үш р-күйдегі электрондық бұлттар гантель пішіндес болады. d- және басқа күйдегі электрон орбиталары бұдан да гөрі күрделі пішінге ие болады.
Орбиталардың барлық түрлері үшін электронның ядро жанынан табылу ықтималы нольге тең.
Электрондар орбитальдары тұрақтылық ретінде қарай және мынадай ерекшеліктерге сәйкес толтырады:
Әр бір орбитада екіден артық электрондар бола алмайды және олардың спиндері міндетті түрде қарама-қарсы бағытталған (Паули принципі) . Мұндай электрондар қосақталған түрінде қарастырылады. Әр бір жаңа орбита тек оған дейінгі толтыруы Гунд ережесіне сәйкес толтырады. Энергиялары тең орбитальдардың толтырылуы Гунд ережесіне сәйкес жүреді, ол ереже бойынша электрондар бұл орбиталдарды мейлінше бір қалыпты толтырады.
1. 2. Химиялық байланыстың түзілуі. Молекулалық орбитальдар. σ-байланыс
Органикалық химияда біз коваленттік байланыстың үш турімен кездесеміз: жай, екі және үш еселі байланыстар. Жай коваленттік химиялық байланыс әдетте екі электрон екі ядроға ортақ орбиталы өткенде пайда болады. тек бір ядроны ғана қоршайтын атомдық орбиталарға қарама-қарсы орбитаның бұл түрі молекулалық деп аталады.
Егер екі атом бірімен бірі әрекеттескенде біреуінің атомдық орбитасы екі - ақ атомдық орбитаның орнына энергиясы атомдық орбитасында пайда болады. Мұндай байланыс орбитасы [σ(сигма) -орбита] шамамен жұмыртақа пішіндес болады (4-сурет) . Ол екі атомдық ядроны қосатын осьпен салыстырғанда симметриясы болып келеді. σ-орбита құратын химиялық байланыс σ-байланыс деп аталады.
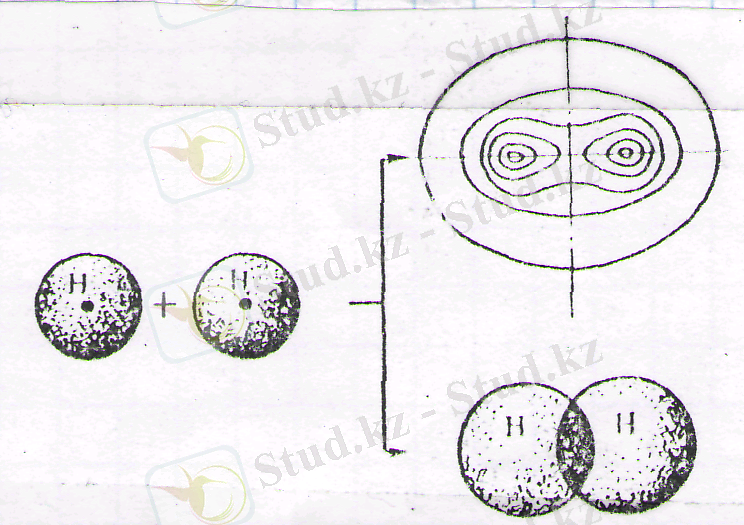
4-сурет. Екі s-электрондарының ( Н 2 ) қатысуымен жай
σ-байланысының құрылу схемасы
σ-байланыс әр түрлі атомдарын электрондарының қатысуымен де, сондай-ақ басқа бір атомның бос атомдық орбитасы болған жағдайда жалғыз атомға тән екі электронының қатысуымен де құрыла алады. Мұндай байланыс, бұрын айтылғандай дативтік семиполярлық немесе координациялық деп аталады.
Кванттық механика мен органикалық химияда коваленттік байланыстың құрылу механизмі туралы оңайрақ түсінік жиі қолданылады: молекулалық орбита байланыс құратын электрондардың атомдық орбиталарының жай қосындысы есебінде қарастырылады. Бұл әрине дәл емес, бірақ мұндай ұғымда органикалық қосылыстарды реакцияның қабылеттілігінің заңдылықтарын түсіндіру үшін және молекуланың энергиясын, зарядталуын т. б. есептеуге жол ашады.
Осындай көз қарас бойынша коваленттік химиялық байланыс электрондардың (спиндері қарама-қарсы) орбитальдары қабысқанда ядролар арасындағы электрондық бұлттың тығыздығынан пайда болатын тартылыс күштерінің нәтижесі есебінде қарастырады.
Мысалы, екі сутек атомы арасында жай σ-байланыстың құрылуын мынадай түрде көрсетуге болады: электрондары бар қарама-қарсы бағыттарын спиндер екі сутек атомы бірте-бірте жақындасады. Олардың атомдық орбитальдары неғұрлым толығырақ қабысса, соғұрлым тұрақты байланыс құрылады. Алайда, атомдар орталықтарының арақашықтығы кішірейген сайын, атомдық ядролардың өзара тебу күштері тез өседі: тартылыс және тебу күштері арасындағы тепе-теңдік ядролардың арақашықтығы сутек молекуласындағы байланыстың ұзындығына теңелгенде орнайды. Егер сутектің екі атомында параллель спиндер болса, ол атомдар кез келген қашықтықта бір-біріне тебеді де молекула құрмайды.
Сутек атомдары оттек, азот немесе хлор атомдарымен коваленттік σ-байланысты 1 s атомдық орбитасы басқа атомның р -түріндей орбитасымен (бір электроны бар) қабысқанда құра алады.
Сол сияқты, азот атомының да үш р -орбитасының әрқайсысында тек бір электроны ғана бар және ол үш сутек атомымен үш коваленттік байланыс құрады.
Бұл байланыстар біріне-бірі 90°-тық бұрышпен орналасады деп күтуге болар еді. Алайда, судың жағдайындағы сияқты, бұрышы іс жүзінде біраз үлкен және ол шамамен 107°-қа тең болады. Сөйтіп, аммиак молекуласының пирамидалық пішінін түсіндіруге болады.
Сондай-ақ, мысалы, хлордың екі атомы арасында р- орбиталар қабысу жолымен коваленттік байланыс құрылуы мүмкін. р -орбиталар олардың кеңістіктегі орны бойынша s -орбиталардан гөрі күштірек қабыса алады, сондықтан да р-электрондардан құрылған коваленттік σ-байланыстар әдетте s -электрондардан құрылғандардан гөрі берігірек болады.
Гибридтену. Жекеленген көміртек атомында, оның негізгі күйінде L -қабаттың құрамы 2 s 2 2 p x 2 p y болады. Сондықтан көміртек екі валентті элемепт болуға тиіс, өйткені оның тек қана екі жұптаспаған электроны бар. Егер бір электрон 2s-орбитасынан 2р-орбитасына көтерілді (энергия шығындаумен) дейтін болсақ, онда көміртек атомы L -кабаттың әр орбитасында бір жұптаспаған электроны бар электрондық структура 1 s 2 2 s 2 p p y 2 p z қабылдауға тиіс (5-сурет) .
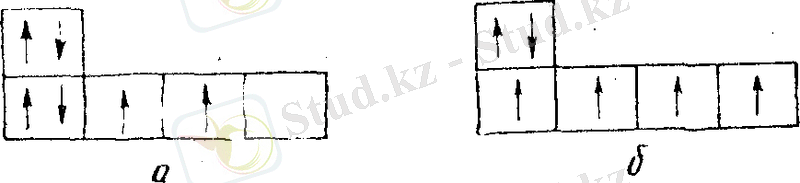
5-сурет. Көміртек атомының электрондық күйлерінің схемалық бейнесі: а) негізгі күй, б) -sp 3 -гибридтік күй
Бұл жағдайда ол басқа төрт атоммен, мысалы, сутек атомдарымен коваленттік байланыс құруға қабілетті болуға тиіс. Бірақ үш 2 р -орбита, мысалы, сутектің үш атомы l s -орбиталарымен жеткілікті жақсы қабыса алады; ал 2 s -opбитаның төртінші сутек атомының l s- орбитасымен қабысуына келетін болсақ, онда ол кеңістіктік жағдайларға байланысты толық бола алмайды. Осының нәтижесінде үш берік және бір әлсіз көміртек - сутектік байланыстар құрылуға тиіс. Кваит-механикалық теория бойынша мұндай молекула түзіле алмайды.
Іс жүзінде барлық төрт С-Н байланыс бірдей.
Көміртек атомының валенттік күйлерінде (яғни атомдарда емес, молекулаларда орын алатын күйлерде) электрондар таза s -және р -орбиталарда емес, аралас немесе гибридтік (Полинг) деп аталатын орбиталарда орналасады екен. Гибридтенген орбиталардың s - және р -орбиталардан гөрі энергиясы жоғарырақ, бірақ олар байланыс құруға геометриялық тиімдірек, өйткені олар басқа атомдардың орбиталарымен күштірек қабысады, сондықтан да берігірек байланыстар құрады.
Орбиталардың қабысуы неғұрлым көбірек болса, химиялық байланыстың беріктігі соғұрлым күштірек болатындықтан, коваленттік байланыс кеңістікте әрқашан берілген ядроаралық қашықтықта орбиталардың қабысуын күшейтетіндей бағытта болады.
Метанның СН 4 молекуласында көміртек атомындагы төрт таза 2 s 2 p x 2 p y 2 p z атомдық орбиталар түрі бірдей және энергиясы тең төрт гибридтелген орбиталарға айырбасталады (6-сурет) . Бұл орбиталардың электрондық бұлтының концентрациясы кейбір осьтердің бойымен дұрыс тетраэдрдің төбесіне бағытталған (109 о 28' бұрышпен) және орбиталар бұл осьтермен салыстырғанда цилиндр симметриялы болады. Көміртек атомының электрондарын таза атомдық орбиталардан (негізгі күйдегі) гибридті орбиталарға (96 ккал) көшіру үшін керекті энергияның орны берігірек байланыстардың құрылу энергиясының (98, 8×4=395, 2 ккал) артығымен толады.
Сонымен, метандағы төрт жай копаленттік байланыстар көміртек атомыиыц төрт тетраэдрлік (гибридтелген ) орбиталарының ( sр 3 -валенттік күйдегі) сутек атомының l s -орбиталарымен қабысуынан құрылған. Метан және басқа қанықан көмірсутектердің молекулалаларында көміртек атомы sр 3 -гибридтенген күйінде болады.
1. 3. Еркін айналу принципі. Комформациялық анализ
Негізінде жай σ-байланыс өзін қоршаған атомдық топтардың еркін айналуына мүмкіндік береді. Органикалық қосылыстардың молекулалары жылу қозғалысының арқасында өзінің формасын үздіксіз өзгертеді. Еркін айналу процесінде бұл молекулалар қабылдайтын жеке күйлер конформациялар деп аталған. Атомдық топтар σ-байланыс арқылы айналғанда пайда болатын изомерлер айналымдық изомерлер деп аталады. Олардың бәрі бір ғана структуралық, формуласы бар бір зат болып табылады. Майлар қатарында кіші молекулалы заттар үшін мұндай конформациялық изомерлерді бөліп алу мүмкін емес.
Дегенмен айналу осі есебінде жай байланыс арқылы еркін айналу процесінде пайда болатын конформациялардың беріктігі әр түрлі. Айналымдық изомерлердің кейбіреулері энергия жөнінен тиімдірек болып шығады. Бұл күйлерде молекулалар ұзақ уақыт бойы болады. Сондықтан, іс жүзінде еркін айналуды біз әбден бақылай алмаймыз: қолайлырақ күйлерде ол тежелген болып шығады.
Газ күйіндегі этан үшін, мысалы, саны шексіз басқа жағдайлардың ішінде, метил топтарының мына екі шеткі күйі мүмкін, олар проекция түрінде бейнеленеді:
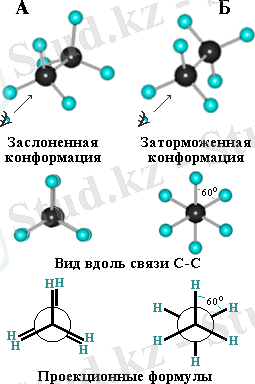
Тежелген форма этан үшін көлеңкеленген формадан гөрі тиімдірек болады, өйткені сутек атомдарының электрондық қабаттары өз ара серпіліседі. Бірақ тежелген формадан көлеңкеленген формаға өту этан үшін небары 3 ккал/моль энергия талап етеді, бұл жылу қозғалысы энергиясының деңгейінде жатыр.
Өз ара жай байланыспен қосылған атомдық группалар арасында айырмашылық неғұрлым үлкен болса, айналымдық изомерлер беріктігінің айырмасы да соғүрлым көп. Мысалы, айталық, дихлорэтан үшін молекуланың тежелген формасы көлеңкеленген формадан 4, 5 ккал/моль 1 тиімдірек.
Температура неғүрлым төмен болса, жылу қозғалысының энергиясы соғұрлым аз және сондықтан заттың молекулаларының соғұрлым көп саны берігірек айналымдық изомер түрінде болады.
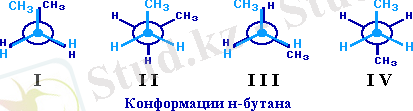
Бірнеше көміртек атомы бар қосылыстарда жай байланыстар арқылы айналу арқасында көміртекті тізбектің формасы үздіксіз өзгереді. Бұл арада да қолайлырақ конформациялар өмір сүреді және сол конформациялардың күйінде болатын молекулалар саны температураның төмендеуіне қарай өседі. Жоғары полимерлі заттарда еркін айналу ерекше кушті тежелеп, сондықтан молекүлаларыиың конформациясы өзгеше полимерлер алуға болады. Белгілі конформациялы полимерлер алу проблемасының елеулі практикалық маңызы бар, өйткені полимер заттардың айналымдық изомерлері әр түрлі механикалық және басқа да қасиеттерге ие.
Тек кейбір жағдайларда ғана кіші молекулалы заттардың айналымдық изомерлері кәдімгі температураларда көлемді атомдық топтардың еркін айналуға кедергі жасауы себебімен біріне-бірі өте алмайды. Сонда стереоизомерия туады.
Айналымдық изомерлердің ерекшеліктерін және өмір сүре алатын жағдайларын зерттеу конформациялық анализ деп аталады.
1. 4. Қос байланыстың табиғаты. π-Байланыс
Қаныққан көмірсутектердегі көміртекке тән тетраэдрлік sр 3 -гибридтенуден өзге, сондай-ақ, гибридтік орбиталардың басқа түрлері де мүмкін. Мысалы, қанықпаған қосылыстардың молекулаларьшда қос байланыстар құрылғанда біз көміртектің бір s-және екі р-атомдық орбиталарының гибридтелуімен кездесеміз, мұнда sp 2 -орбиталар деп аталатын үш эквивалентті гибридтік орбиталар құрылады (жазықтықтық - тригональдық орбиталар) (7-және 8-сурет) . Олардың әрқайсысы жазықтықта 120º бұрышпен орналасқан үш осьтің біреуімен салыстырғанда цилиндр тәрізді симметриялы болады.
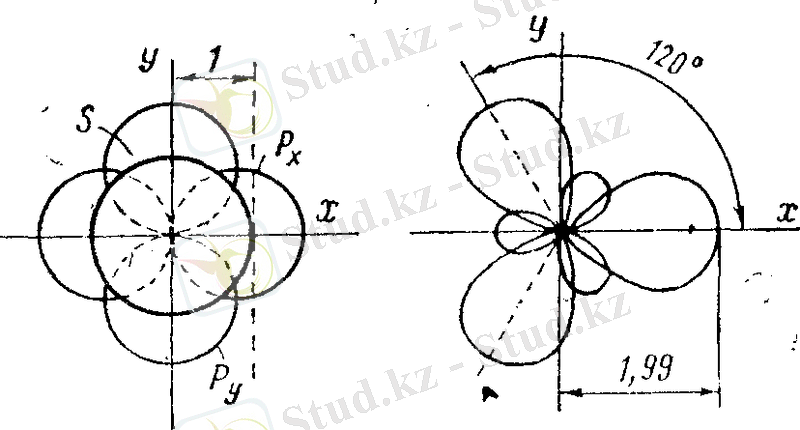
7-сурет. Көміртек атомының электрондық қабығының sр 2 -гибридтік
күйінің құрылыс схемасы
Гибридтенуге ұшырамаған төртінші атомдық р -орбитаның осі sр 2 -гибридтік орбиталардың үш осі жатқан жазықтыққа тік бұрышпен орналасады.
Этиленнің молекуласында екі көміртек атомы үш тригоналдық орбитаның қатысуымен үш σ-байланыс құрады (8-сурет, а) . Бұдан басқа, көміртектің екі атомының р -орбиталары қабысады (параллель спиндері бар) (8-сурет, б) . Атомдар арасындағы мұндай әрекеттесу π-байланыс деп аталады.
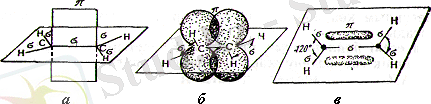
8-сурет. Этилен молекуласы құрылысының схемалық бейнесі
Бұл жағдайда молекулалық π-орбитаның жоғары злектрондық тығыздығы екі аймаққа ие болады (басқа байланыстардан құрылған жазықтықтың әрбір жағында бір-бірден) (8, в және 9-суреттер) .
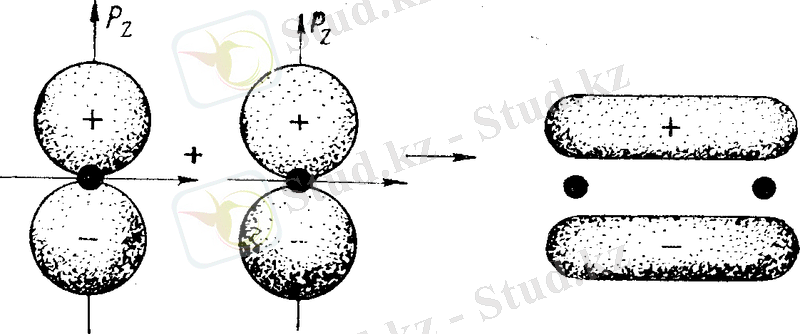
9-сурет. р-электрондық орбиталардың қабысуы арқылы
π-байланысының құрылу схемасы
π-байланыстың σ-байланыстан гөрі беріктігі төмен, өйткені параллель осьтері бар р -электрондық орбиталардың қабысуы сол р -электрондардың өздерінен немесе s -электрондардан σ-байланыс құрылғандығы қабысудан (орбиталар осінің бойымен қабысу) анағұрлым аз. Этилендегі (σ+π) байланыстардың жалпы беріктігі 145 ккал/моль құрады, ал этандағы екі көміртек атомының арасындағы σ-байланыс үшін ол 83, 6 ккал/моль тең. 61, 4 ккал/моль айырма шамамен π-байланыстың беріктігі болып табылады.
Сонымен, қос байланыс σ- және π-байланыстардың үйлесуі болып табылады. Егер молекуланың конфигурациясы планарлық (жазықтықтық) болып келсе, байланыс ең жоғарғы беріктікке ие болады. Этилен молекуласындағы бір СН 2 - тобын С-С байланысы арқылы екінші СН 2 - тобына салыстырмалы түрде айналдыру үшін π-байланысты үзуге және екі электронды және р -орбиталарға қайтаруға жеткілікті энергия жұмсау керек. Кәдімгі температурада молекулалық соқтығыстардың энергиясы бұл үшін жеткіліксіз, оондықтан да қос байланыс арқылы еркін айналу жоқ.
Алкендердегі екі қанықпаған көміртек арасындағы олефиндік байланыстың ұзындығы (σ+π -байланыс) қаныққан көмірсутектердегі жай σ-байланыстың ұзындығынан (1, 54 Ǻ) аз және 1, 35 Ǻ-ға тең, Бұл түсінікті. Электрондық бұлт ядролар арасында неғұрлым көп концентрленсе, олар соғұрлым күштірек тартылысады.
1. 5. Үш еселі байланыстың табиғаты
Қарастырылған sр 3 -немесе тетраэдрлік гибридтену және sp 2 немесе тригональдық гибридтенуден басқа гибридтенудің тағы үшінші түрі - бір 2 s -орбитамен бір 2 р -орбитаның комбинациясы бар. Мұндай гибридтік орбита sр -орбитасы немесе сызықтық орбита деп аталады. Гибридтену (р х ушін пайдаланылған р -орбитаның осінен салыстырғанда екеуі де симметриялы болатын және қарама-қарсы бағытта орналасатын екі осындай эквиваленттік гибридтік орбитаны 10-суретте көрсетілгендей бейнелеуге болады. Өзге екі р -орбита (р у және р z ) бұл гибридтенуге қатыспайды және бір-біріне тік бұрышты орналасқан болып шығады.
10-сурет. sр -гибридтенуінің схемалық бейнесі
Егер осындай күйдегі екі көміртек атомын біреуінің sp -орбитасы екіншісінің sp -орбитасымен қабысатындай етіп қосса, онда берік σ-байланыс пайда болады (11-сурет) . Егер әр көміртекатомының екінші sp -орбитасы, мысалы, сутек атомымен σ-байланыс құруға жұмсалса, онда ацетиленнің молекуласы түзіледі. Бұл молекулада көміртек және сутек атомдары бір түзудің бойында жатыр, молекула сызықтық молекула болып табылады. Әр көміртек атомының тағы да екі р -орбитасы бар (әрқайсысында бір электрон бар), олар басқа көміртек атомының сол сияқты р -орбиталарымен өз ара қабысады, яғни екі π-байланыс құрады. Екі молекулалық π-орбита өз ара 90° бұрыш құрады (11-сурет) .
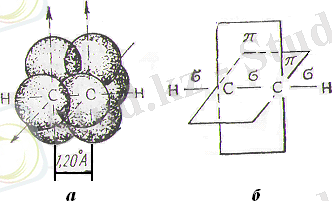
11-сурет. Ацетилен молекуласы құрылысының схемалық бейнесі
Осылай құрылған электрондық қабықтың ұзына бойы осінің теңірегінде электрондардың тығыздығы төмен болады.
Ацетиленнің үш еселі байланысының беріктігі σ-байланыс + 2π-байланыстар (этилендік түр) қосындысы үшін күтуге болатын дәрежеден азырақ. Көміртек - көміртек байланысының энергиясы этанда 83, 6 ккал/моль, этиленде 145 ккал/моль және ацетиленде 196, 5 ккал/моль, ацетилен мен этиленнің байланыс энергияларының айырмасы 51, 5 ккал/моль, яғни этилен мен этан үшін айырмадан (61, 4 ккал/моль) аз.
Тетраэдрлік модельдер. Дара, қос және үш еселі байланыстардың құрылуы туралы квант-механикалық түсініктер байланыстардың бұл түрлерінің өткен ғасырда-ақ пайда болған стереохимиялық тетраэдрлік модельдерін жақсы түсіндіреді. Жай байланыс төбелерімен қосылған тетраэдрлер түрінде, қос байла-ныс қырларымен қосылған тетраэдрлер түрінде және үш еселі байланыс жақтарымен қосылған тетраэдрлер түрінде көрсетіледі (12-сурет) .
Көлемдік модсльдер жиі қолданылады, оларда атом ядролары - кішкентай шарлармен, ал валенттік осьтер сым білеулермен бейнелемген. Кеңістіктік зффекттерді талқылау үшін Стюарт - Бриглеб модельдері (пемесе басқалар) пайдаланылады. Бұл модельдердс атомдар шар түріндсгі сегменттерді бейнелейді, онда мұндай сегменттер орталықтарының арақашықтықтарының бір-біріне қатынасы шын атомдардың ядролары арақашықтықтарының қатынасындай болады.
1. 6. Байланыстарды сипаттаудың квант-механикалық әдістері
Электрондар мен ядролардың әрекеттесуі нәтижесінде пайда болатын химиялық байланысты математикалық жолмен тек кванттық механика шенберінде ғана сипаттауға болады. Бұл сипаттау өте күрделі, өйткені тиісті жөндеулерді шығаруда үлкен қиыншылықтар бар.
Молекулалық жүйелер үшін мұндай теңдеу шешулерінің жуық әдістерін іздеу кванттық химияның міндеттерінің, бірі болып табылады.
Қазіргі кезде кванттық химияда молекулалар есебінің екі жуықтық әдісі бар: валенттік байланыстар әдісі және молекулалық орбиталар (орбитальдар) әдісі. Валенттік байлаиыстар әдісінде молекуланың құрылуы бүтін атомдар өз ара жакындасуы арқылы етеді, олар молекулада да өзіндік сипатын сақтайды да жобаланады. Бұл жағдайда молекуланың нағыз күйі іс жүзінде орындалмайтын шеткі гомеополюстік немесе иондық структуралардың қабаттасуы (суперпозиция) есебінде қарастырылады.
Молекулалық орбиталар әдісімен есептерді шығару үшін, химиялық байланыс құрылғанда алдымен тек ядролар жақындасады және содан кейін ғана пайда болған көп орталықты молекулалық орбиталарда валенттік электрондар орналасады деп жобаланады, сонда молекулалық. орбиталарды есептеу үшін де атомдық орбиталарды есептеуге қолданылатын әдіс пайдаланылады.
Әдеттегі нағыз жай есептеулерде (нольдік жуықтық) молекулалық орбитальдық функция атомдық орбитальдық функциялардың сызықтық комбинациясы (ЛКАО жуықтығы) есебінде қабылданады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz