Химияда катализаторлардың рөлі: теориясы және мұнай-химиялық өндірістердегі қолданылуы


ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
Жаратылыстыну педагогика университеті.
Тақырыбы: Химияда катализаторлардың ролі.
Мазмұны
І. Кіріспе бөлім: 1. Катализдің қолданылуы.
2. Катализ дегеніміз не?
3. Химиялық өңдірісте катализатордың алатын орны.
ІІ. Негізгі бөлім. 1. Реякция жылдамдығына катализатордың ролі.
- Аммиякты синтездеу.
- Мұнай химиялық өнеркәсіпте синез газдың қолдану.
- Мұнай химиялық өнеркәсәіптің шикізат түрлері және оларды өңдеудің негізгі бағыттары.
- Гетрогенді жүйедегі тепе-теңдік.
ІІІ. Қортыңды. 1. Катализаторды ашқан ғалым.
IV. Пайдаланылған әдебиеттер.
- Суербаев Х. А «Мұнай өңдеу өнеркәсібінің каталитикалық процесі» Алматы. 2004ж.
- «Мұнай өңдеу және мұнай химиясы» Алматы 2004ж.
- «Мұнай химиясына кіріспе»
- Нассиров Рахматтолла «Жалпы және онорганикалық химия»
Қатты отындарды газдату
газогенераторда өткізіледі, түзілетін жанғыш газдар (негізінен СО
2
Н және СН
4
- тең тұратын) генераторлы деп аталады. Қатты отындардың барлық түрлерін газдандырады: тас және қоңыр көмірлер, антрацит, кокс, жартылай кокс
?
торф, ағаш, жанғыш сланецтер және т. б. генераторлық газдарды негізінен металлургиялық шыны, керамикалық және басқа өндірістерде, ішкі жанғыш двигательдерде газтурбиналарда және тұрмыстық қажетіне отын ретінде қолданады. Үрленетін газдар құрамына байланысты ауалық газ (газдану ауамен өткізіледі), булы ауалық, булыоттекті, сулы, жартылай сулы, оттекті үрлеу болып белінеді.
Қатты қыздырылған көмірдің және су буының і200°С температурада әрекеттесуі осы процесстің негізгі реакциясы болып табылады.
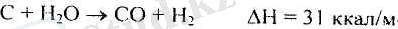
Сұйық отындарды газдандыру - су буымен, оттекпен немесе ауамен ыдырау енімдерін конверсиялаумен өтетін көмірсутек молекулаларын ыдырату жолымен сұйық отындарды жанғыш газдарға айналдыру процессі. Құрамына байланысты алынатын газдарды отын немесе химиялық өндіріске шикізат ретінде қолданады. Газдану жағдайына тәуелді келесі реакциялар өтеді: 1) Жоғарымолекулалық қаиыққан көмірсутектердің төменмолекулалы қаныққан және қанықпаған көмірсутектерді түзе ыдырауы; 2) Қаныққан көмірсутектердің қанықпаған көмірсутектерді және сутекті түзе дегидрленуі; 3) Көмірсутектердің су буьімен және оттекпен әрекеттесуі. Аталмыш непзгі түрленулерден басқа, изомерлеу, полимерлеу, куйе және кокс түзу реакциялары өтеді.
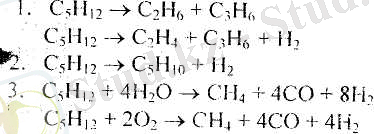
Синтез-газ - көміртек оксидінің және сутектің қоспасы, мұнайхимиялық өнеркәсіп үшін эте құндьі шикізат болып табылады. Су буымен және оттекпен метанды (немесе табиғи газды) тотықтыра конзерсиялау - синтез-газды алудың өнеркәсіптік тәсілі; оларға сәйкес синтез-газды алудың процесстерін метандыбулы және метанды-оттекті деп сәйкесті айырады.
Метанды-булы процесс. Бұл процестің бірінші сатысы - ол метанмен су буы арасында өтетін эндотермиялық реакция:
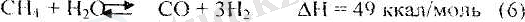
Осы негізгі реакциямен бір уақытта су буынык конверсиясы деп аталатын СО және Н 2 О (бу) арасындағы экзотермиялық реакция да өтеді.
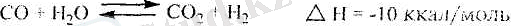
[Бұл реакцияның тепе-теңдігінің оң жаққа ығысуьіна температураның төмендеуі үлес қосады. Реакцияның теле-теңдік константасы (К р ) температураньі арттырған^төмендейді (686°С ол 1, 6 -ға, ал 1500°С -
Химиялық реакцияға кіретін және нәтижесінде түзілетін зат-тар әр түрлі фазада болса, ондай жүйені гетерогенді деп атайды.
Гетерогенді жүйеде жүретін химиялық реакциялардың өзінше срекшелігі бар. Мұндай жүйеде жүретін реакция бірнеше сатыдан тұрады. Бірінші сатыда әрекеттесетін заттар диффузия арқылы катты заттың беттік қабатына тартылады. Екінші сатыда сол беттік қабатта химиялық рёакция жүреді. Үшінші сатыда реакция өнімі диффузияланып бөлініп шығады. Мүндай жағдайда жалпы хи-мпялық реакция жылдамдығы ең баяу жүретін сатыға тәуелді болады. Гетерогенді жүйеде ең баяу жүретін диффузия сатысы. Сондықтан мүндай жүйеде жүретін реакцияларды араластырып отырады. Сонымен катар, гетерогенді реакция жылдамдығы фаза-ларды бөліп тұрған беттік қабатқа пропорционал болады. Сондык-тан басқа жағдайлар тең болса да реакция жылдамдығы беттік қабаттың шамасына да байланысты. Реакцияға кіретін қатты зат неғүрлым үсақ болса, оныц беттік қабаты да соғұрлым үлкен бо-лады.
Технпкада реакциялардың көпшілігі гетерогенді жүйеде жүре-ді. Мысалы, қатты отынның жануы, темір кенінің домна пешінде тотықсыздануы, металл коррозиясы және басқа.
Егер гетерогендік жүйеде реакция қайтымды болса, оған да массалардың әсер заңын қолдануға болады. Мысалы:
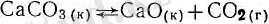
СаСО пен СаО қатты фазада болғандықтан, тепе-тендік кезін- 0Л ардың концентрациялары түрақты болады. Тепе-теңдік тек
газ күйіндегі зат концентрациясына СО 2 тәуелді болады:
К=[СО 2 ] ; Яғни, СО 2 концентрациясы артатын болса, тепе-теңдік солға
(СаСОз) ', ал ол кемитін болса онға (СаО + СОо) ығысадьу
Аммиак.
Азот сутегімен бірнеше қосылыс түзеді. Олардьщ ішшде ең маңыздысы - аммиак. Оны лабор. аторияда аммоний хлоридін кальций гидроксидімен қосып
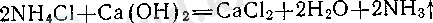
қыздыру арқылы алады:
Өнеркәсіпте аммиак өндіру атмосферадағы бос азотты байла-ныстырудың бірден-бір жолы. Бұрын азоттын. табиғи, минералы ретінде тек Чили селитрасы ЫаІЧОз белгілі болатын. Аммиак өн-діру атмосферадағы азотты минерал қосылыстары күйіне айнал-дыруға мүмкіндік береді. Алғаш аммиакты цианамид әдісі арқы-: лы алып жүрді. Ол үшін алдымен кальций цианамиді СаСМ
2
алы-нады:

Кальций цианамидінсу буымен әрекеттестіріп аммиак алады:

Қазіргі кезде аммиакты синтез әдісімен - азот пен сутегін әре-кеттестіріп алады:

Реакция теңдеуінен оныд экзотермиялық процесс екені көрініп түр. Демек температураны өсіру аммиак синтезіне кері әсер етеді. Соған орай процесті біршама темен температурада 500-550°С, катализатордың қатысуымен, аса жоғары қысымда жүргізеді.
Аммиак - өткір иісті, түссіз газ. Ауадан жеңіл. Ол ете улы. Аммиак -33, 4°С-та сұйыққа айналады, ал - 77, 8°С-та қатады. Оны арнайы цистерна мен баллондарда сақтап, тасымалдайды.
Тарихы мол аналитакалық химияның өте жақсы зерттелген және үздіксіз дамып отыратын теориясы бар. Бұл теория заттың химиялық құрамы туралы қажетті ақпарат беретін химиялық реакцияға негізделген. Реакцияның түрі (бейтараптау, комплекс түзу, тотығу-тотықсыздану және тұнбаға түсіру реакциялары) және оны еткізу жағадайлары аса маңызды. Көптеген химиялық реакциялар сулы ертінділерде өтеді.
Гравиметриялық және титриметриялық анализ әдістері ерітіндідегі реакцияларға негізделген. Бірсыпыра физика-химиялық анықтауларды жасау үшін де ерітіндідегі реакциялар пайдаланылады. Осы реакциялардың жүруін басқаратын заңдылықтар анали-тикалық химияның теориялық негізінің маңызды құрам бөлігі болып табылады. Ерітіндідегі химиялық тепе-теңдікті, соңдай-ақ гетерогендік жүйеде тұздар, қышқылдар, негіздердің қатты фазасы болғавда есептеу анализдің химиялық әдістерінің теориясына кіреді. Химиялық реакциялары және олардың жүру жағдайларын дұрыс таңдау белгісі осы реакциялардың термодинамикасы мен кинетиткасынанг келіп шығады.
Бөліп шығару, бөлу, концентрлеу және бүркеу сияқты арнайы тәсілдерді қолдану жолымен бөгет жасайтын компоненттер әсерін жойып, дүрыс нәтиже үшін химик-аналитикке анализ жасаудың ең қолайлы жағдайын жасау өте қажет.
Толық анализ жасағанда әрбір сатысында пайда болатын қателіктерді анықтап, оларды жою, анықтаудың эксперименттік нәтижелерін математикалық өңдеу анализдің дүрыстық проблемасымен тығыз байланысты.
Өзіндік ерекшеліктері және олардың ерітіңдіге өткізу тәсілдері бар бейорганикалық, элементоорганикалық, органикалық, полимерлік, композициялық және т. б. заттардың нақты анализ әдістері болатын теориялық бөліміне, сондай-ақ анализ жасаудың методологиясы да кіреді.
Әр түрлі заттарды, өнімдерді, материалдарды мөлшерлік және сапалық анализ жасау методикасында, сондай-ақ техникалық процестерді және қоршаған ортаны аналитикалық бақылағанда, аналитикалық химияның теориялық негіздерін білу, оларды іс жүзінде дұрыс пайдалануға мүмкіндік туғызады.
ХИМИЯЛЫҚ ЖҮЙЕЛЕР ТУРАЛЫ ҰҒЫМ
Берілген физика-химиялық процесте болатын немесе қатынасатын компоненттердің жиынтығын ж ү й е л і деп атаймыз. Жүйе гомогенді (біртекті) және гетерогенді (біртексіз, екі немесе көп фазалы) болуы мүмкін.
Ж үй е фазасы (символы ц>) - бұл химиялық құрамы мен физикалық қасиеті жағынан біртекті және жалпы көлемнің басқа бөліктерінен жіктеу бетімен ажыратылған тепе-теңдіктегі жүйе көлемінің бір бөлігі.
Ф а з а - бұл физикалық шама емес, ұғым. Фаза ұғымы өте кіші көлемдерге және өте дамыған жүйелерге жатпайды. Фаза сұйық, қатты және газ тәріздес болады.
Жүйе компоненті (символы к) жеке химиялық зат түрінде оқшауланған күйде болуға қабілеттті жүйенің тәуелсіз қүрам бөлігі больш табылады. Компонент те физикалық шама емес, ұғым.
Гомогенді жүйе - оны құрайтын бөлімдерге ажырататын, жіктеуші беттері жоқ жүйе болып табылады. Гомогенді жүйенің барлық учаскелері қүрамы және қасиеті бойынша біртекті, мысалы, газдар қоспасы, ауа (егер онда қатты бөлшектер болма-са), түздар, қышқътлдар, негіздердің қанықпаған ерітінділері. Гомогенді жүйеде бір ғана фаза бар.
Гетерогенді жүйе - бір-бірінен бөлімдерге ажырататын жіктеуші беттері бар және құрамы мен қасиеттерімен ерекшеленетін екі немесе бірнеше біртекті бөліктен (фазалар) түрады. Гетерогенді жүйеге мысал ретінде, кез келген қосылыстың мөлшері артық болғандағы қаныққан ерітіндісін, араласпайтын екі сұйықтықты, көптеген металл құймаларын мысалы, болат пен шойын т. б. жүйелерді алуға болады.
Термодинамикалық жүйе - бұл компоненттердің жеке құрам бөліктерінің арасындағы энергияның алмасуы мүмкін болатын жүйе.
Химиялық жүйе заттың құрам бөліктерінің қосымша алмастырылуымен (яғни, химиялық реакцияның жүруімен) сипатталады.
Е р і т і н д і - бірнеше компоненттерден тұратын, гомогенді бір фазалы жүйе. Еріткіште біркелкі жайылған бір не бірнеше еріген заттар немесе иондар, еріткіш ерітіндінің компоненттері болып табылады. Ерітінді қандай агрегаттық күйде болса, таза түрінде дәл сондай болатын компонентті еріткіш деп есептейді, бірақ оның мөлшері берілген жүйеде артығырақ болуы қажет, мысалы, ауа- бұл оттектің, көмірқышқыл және инертті газдар-дың, су буының және басқа заттардың азоттағы ерітіндісі (ауадағы азот мөлшері көлемінің 78 проценті) . Спирт пен су кез келген қатынаста бір-бірімен араласады және ерігенше бірдей агрегат күйде болады, сондықтан олардың біреуінің мөлшерінің аздығына байланысты жүйе судың спирттегі немесе спирттің судағы ерітіндісі бола алады. Егер олардың мөлшері бір-біріне жақын немесе шамалас болса, онда мұндай жүйені аралас еріткіш деп атайды.
Аналитикалық химияда көбінесе еріткіш сүйықтық болып келетін ерітінділер қолданылады. Маңызды еріткіштің бірі-су.
Төменгі қаныққан және қанықпған көмірсутектер ароматты және нафтенді көмірсутектерді мұнай химиялық өнеркәсіптің шикізаттарының негізгі түрлеріне жатады.
Олардың ішінде аликиларилсуль фонаттарсияқты түрлі жуғыш заттарды крекингі бензиндерден және газойылдерден қоспаларын толықтыру үшін биензинді фракцияларынан өңдіретін кейбір процестерді айтуға боады.
Синтез-газ (СО4-Н 2 ) өнеркәсіптік негізгі органикалық синтездің көптеген бөлігінің бастапқы шикізаты болып табылады. Синтез-газ қолданысын екі түрге бөлуте болады: 1) сутек қолданысы және 2) көміртек оксиді кәне оның сутекпен қоспасының (синтез-газ) қолданысы. Гомогенді катализдің бұл жалпы механизмі бойынша, катализатордың қатысуымен реакция активтендіру энергиясы аз жолмен жүреді. Гетерогенді катализ. Реакцияға түсетін заттар мен катализатор әр фазада болған жағдайды гетерогенді катализ дейі
Мысалы, реакцияға түсетін заттар - газдар немесе сұйыықар, ал катализатор- қатты зат.
Жалпы алғанда, катализатордың реакция жылдамдығына тигізетін әсері оның реакцияға түсетін заттар молекулаларынын активтендіру энергиясын төмендетуімен сипатгалады. Мысалы, төмендегі реакцияныалайық

Химиялық өндірісте катализаторлардын алатын орны өте зор. Күкірт қышқылын, тас көмірден сүйық отындар алу, аммиакты синтездеу, жасанды каучук және пластмасса дайындау, майды гидрлеу, т. б. процестер тек катализаторлардың катынасы аркылы жүргізіледі
Реякция жылдамдығын өзгертіп, бірақ өздері реакция нәтижесінде өзгермей қалатын заттарды катализаторлар дейміз.
Катализаторларға төмендегі қасиеттер тән:
1. Реащия түсетін заттардың көп мөлшерлерін реакциядан түзілетін оаттарға айналдыру үшін, катализатордың азғантай ғана мөлшері керек.
2. Катализаторлар белгілі бір реакцияның немесе белгілі бір реакция топтарының ғана жылдамдыктарын өзгерте алады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz