Ветеринариялық вирусология: ветеринариялық медицина және ветеринариялық санитария мамандықтарының студенттеріне арналған оқу-әдістемелік құрал


ҚАЗАҚСТАН РЕСПУБЛИКАСЫ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ
СЕМЕЙ ҚАЛАСЫНЫҢ ШӘКӘРІМ АТЫНДАҒЫ МЕМЛЕКЕТТІК УНИВЕРСИТЕТІ
ВЕТЕРИНАРИЯЛЫҚ САНИТАРИЯ КАФЕДРАСЫ
Е. О. ОМАРБЕКОВ
ВЕТЕРИНАРИЯЛЫҚ ВИРУСОЛОГИЯ
пәні бойынша «ветеринариялық медицина» және
«ветеринариялық санитария» мамандықтарының
студенттеріне арналған
ОҚУ ҚҰРАЛЫ
СЕМЕЙ 2016
Құрастырған : Е. О. Омарбеков, ветеринария ғылымдарының кандидаты, ветеринариялық санитария кафедрасының доценті.
Рецензент : О. Н. Ахметжанов, ветеринария ғылымдарының кандидаты, ветеринариялық медицина кафедрасының доценті.
Оқу құралы «ветеринариялық вирусология» пәні бойынша «ветеринариялық медицина» және «ветеринариялық санитария» мамандықтарының студенттеріне арналған, Семей, 2016. -110 б.
Ветеринарлық вирусологияның басқа пәндерден ерекшелігі оның оқу объектісінің, вирустың, өз ерекшеліктеріне тікелей байланысты, атап айтқанда, олардың мөлшерінің өте кішкентайлығы, абсолютті генетикалық паразиттілігі, тек бір ғана нуклеин қышқылынан тұруы ж. т. б. Яғни вирустың бұл ерекшеліктерін егжей-тегжейлі білмейінше, олардың қоздыратын ауруларын анықтап және сол аурулардың алдын алу проблемаларын шешу мүмкін емес.
Бұл оқу құралының негізгі мақсаты-студенттерге вирустар туралы, олардың табиғаттағы және адам-мал организміндегі рөлін жай теориялық жолмен ұғымды тілмен жеткізіп қана қоймай вирустарды лабораториялық жолмен зерттелінетін объектілерден бөліп алу жолдарына үйрету. Осы себепті зертханалық жұмыстар мен әдістемелерді баяндау, патологиялық материалды логикалық байланысты зерттеуді үйрету көзделген. Студент ауруға күдікті малдан патологиялық материалды алып және оны негізгі талапқа сай лабораторияға жіберу ережесін білуімен қатар зерттеу нәтижесі бойынша қорытынды беруге үйренуі керек. Практикалық сабақта студент патологиялық материалдан вирусты бөліп алу үшін қолданылатын негізгі әдістемелерді толық игеріп шығуы тиіс. Әрине малдәрігерлік вирустық ауруларға иммунологиялық диагноз қоюмен бірге практикада қолданылатын вирустық препараттар жайлы білуге міндетті. Осы оқу құралында автор айтылған проблемаларды жүйелі түрде беруге тырысқан.
Ветеринариялық санитария кафедрасының мәжілісінде қаралып, ұсынылды. (хаттама № 1, «09» қыркүйек 2016 ж. )
Аграрлық факультетінің оқу-әдістемелік комиссиясында қарастырылып баспаға ұсынылған (хаттама №1, «30 » қыркүйек 2016 ж. )
МАЗМҰНЫ
1 Вирустардың негізгі қасиеттері
2 Вирусологиялық лабораторияда жұмыс істеу тәртібі
3 Патологиялық материал алу және оны зерттеуге дайындау
4 Патологиялық материалдағы вирустарды торшаішіндік
денешіктер мен вириондарды табу арқыла анықтау
5 Лабораториялық жануарлар және оларды вирусологияда қолдану
6 Тауық эмбрионы және оны вирусологияда қолдану
7 Торшалар өсіндісі және оларды вирусологияда қолдану
8 Вирустарды титрлеу
9 Гемагглютинация реакциясымен (ГАР) вирустың титрін анықтау
10 Гемагглютинацияны тежеу реакциясы (ГАТР)
11 Тура емес (енжар) гемагглютинация реакциясы (ЕГАР)
12 Бейтараптандыру реакциясы (БР) және оны вирусологияда қолдану
13 Диффузиялық преципитация реакциясы (ДПР)
14 Иммунды флуоресценция реакциясы (ИФР)
15 Диагностикалық жаттығулар
16 Вирусология пәнінде жиі кездесетін терминдер
17 Пайдаланылған әдебиеттер
1-тақырып. ВИРУСТАРДЫҢ НЕГІЗГІ ҚАСИЕТТЕРІ
Сабақтың мақсаты: Студенттерді вирустардың жалпы қасиеттерімен таныстыру.
Сабақтың мазмұны: Вирустар жануарлардың, өсімдіктердің, жәндіктердің, бактериялардың, микроскопиялық саңырауқұлақтардың, қарапайымдылардың және басқа да тірі организмдердің облигатты клетка ішіндік паразиті. Бұлар өмірдің клеткасыз, бірақ өзіндік геномы арқылы тек тірі клеткаларда көбею қасиеті бар түрі. Вирустар тіршілігі тек екі формада болады - бірінші, клеткадан тыс немесе жансыз формасы, ал екіншісі - вегетативті немесе жанды- репродукцияланатын түрі. Клеткадан тыс түрін вирустық бөлшектер - вирион деп те атайды. Ал вирустың клетканың ішіндегі түрін вирус- клетка кешені деген балама аттармен де түсіндіреді. Басқа тірі организмдермен оның ішінде егжей-тегжейлі зерттелген микроорганизмдермен салыстырғанда вирустардың мөлшері, көлемі өте ұсақ. Әдеттегі лабораторияларда қолданылып жүрген жарық микроскоптарының көмегімен оларды көруге болмайды. Бұларды көру үшін арнайы құрал - электронды микроскоп керек. Вириондардың массасын және оның құрамдарын (нуклеин қышқылдарын - РНҚ, ДНҚ, белоктарын, липидтерін, углеводтарын) Дальтонмен (Д) өлшейді. 1Д=1, 67·10 -24 г
1 Килодальтон (кД) - 1000Д
1 Мегадальтон (МД) =1000кД=10 6 Д
1Миллидальтон (мД) = 10 -3 Д
Вирустардың ұзындық өлшем бірлігі - қазіргі халықаралық өлшем бірлігі (СИ) бойынша нанометрмен (нм) өлшенеді.
1мкм =10 -6 м
1нм=10 -9 м
1 мм=1000 нанометр (нм)
1 нм - 10 ангстрем (А 0 ) Бірақ осындай өте ұсақтығына қарамастан олар басқа тірі инфекциялық агенттер тәріздес, өз бойларында генетикалық информацияларды сақтай отырып, тұқым қуалаушылық, өзгергіштік және де табиғи және жасанды сұрыптауға болатын қасиеттерімен сипатталады. Вирустардың тағы бір ерекшелігі - өзінің зат алмасу процесінің жоқтығы себепті еш нәрсемен қоректенбейді, тыныс алу, белок синтездеу және энергия құру жүйелері жоқ. Жасанды қоректік орталарда (ет пептонды агар, ет пептонды сорпа ж. т. б. ) өспейді. Олар үшін тек тірі клетка керек. Бұл қасиеттерін алғаш рет орыстың ғалым-ботанигі Дмитрий Иосифович Ивановский (1864-1920) темекі теңбілінің пайда болу себептерін зерттеуінде анықтаған. Вирустар тек бір ғана - РНҚ немесе ДНҚ-дан тұрады. Ал егер вирустарды электронды микроскоп көмегімен зерттесек онда олардың шар, таяқша немесе жіпше тәріздес сыртқы пішіндерін көруге болады. Диагностикалық маңызы зор қасиеті - кейбір вирустардың (құтыру, шешек, гепатит ж. т. б. ) торшаның цитоплазмасында, ядросында өздеріне тән шоғырлануы яғни торша ішіндік ядролық немесе цитоплазмалық денешіктер түзуі.
Вирустардың құрылымын қарастырсақ, олар нуклеоидтен- вирионның орталық бөлігі -бұл нуклеин қышкылынан тұрады. Бұл қышқыл сыртқы белоктік қабықшамен - капсидпен жабылған, ал әрбір капсид капсомерлерден тұрады (1 сурет) .
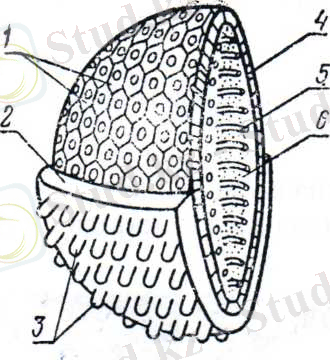
1 сурет. Вирионның құрылысы
1 - капсомерлер; 2 - пеплос; 3 - жіпшелер; 4 - капсид; 5 - нуклеин қышқылы; 6 - нуклеидтың ішкі ақзаты.
Капсомерлердің капсидке орналасуына байланысты вирустарды үш топқа бөледі: 1. Спираль тәріздес 2. Икосаэдрлі (20 қабырғалы)
 3. Құрастырмалы симметриялы.
3. Құрастырмалы симметриялы.
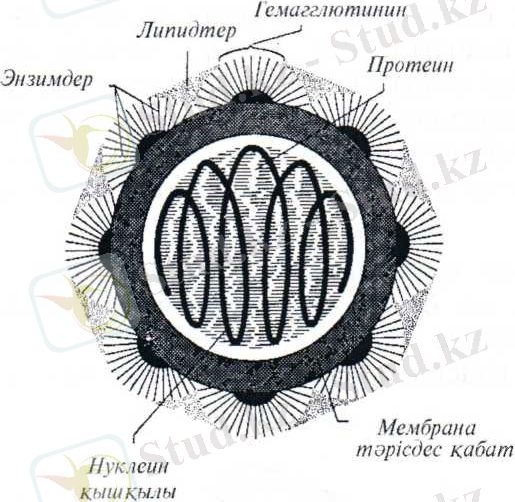
Спиральді симметриялы вирустар қатарына миксовирустар - тұмау, құстардың классикалық оба, Ньюкасл ауруы вирустары, қойдың жұқпалы сүйелі, сиырдың везикулярлы стоматиті жатады (2 сурет) .
2 сурет. Тұмау вирусының құрылысы
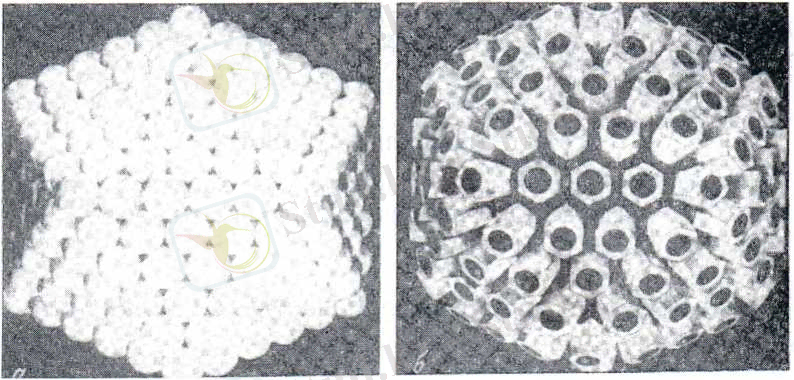 Ал
икосаэдрлі симметриялы
вирустар қатарына - аденовирустар, герпесвирустар, пикорнавирустар жатады (3 сурет) .
Ал
икосаэдрлі симметриялы
вирустар қатарына - аденовирустар, герпесвирустар, пикорнавирустар жатады (3 сурет) .
Шар тәріздес вирустардың капсидтері икосаэдрлы симметрияға жатады, олар 20 қырлы, ал әр қыры үш бұрышты формада. Капсомерлер саны вирустардың түріне байланысты оннан бірнеше жүз және одан да жоғары болады. Капсид вирустың нуклеин қышқылын сыртқы қоршаған орта әсерінен сақгайды және олардың сезімтал клеткаға жабысуын (адсорбция) қамтамасыз етеді, яғни, вирустың антигендік және иммуногендік қасиеттері капсидке тікелей байланысты. Құрастырмалы симметриялы вирустарға - бактериофагтар, шешек ж. т. б. жатады (4а, 4б сурет) .
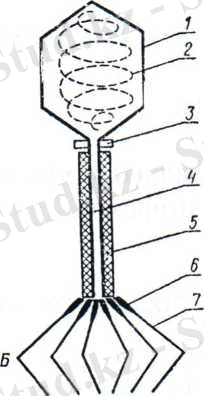
4а сурет. Т-2 бактериофагінің құрылысы
Б - сызбасы; 1 - қабығы; 2 - басы (ДНК) ; 3 - мойыны; 4 - стержені; 5 -
қабы; 6 - бұдыры; 7 - фибриллалар
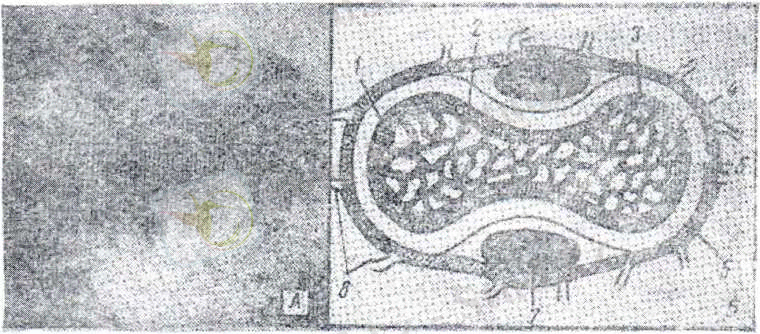
4б сурет. Шешек вирусының құрылысы
1 - нуклеид; 2 - осмиофильді фибриллалар; 3 - нуклеоплазма; 4 - нуклео-
идтің қабығы; 5 - вирусоплазма; 6 - вирионның қабығы; 7 - бүйір дене-шігі; 8 - қылшықтары.
Вирустар мал шаруашылығында, әсіресе ірі қара малында парагрипп, инфекциялық ринотрахеит, вирустық диарея, аденовирустық індеттерінің қоздырғыштары болумен қатар төлдердің өлі тууы және басқадай патология себептерінің бірі болып есептеледі. Мысалы, инфекциялық ринотрахеит індетіне шалдыққан малдан соқыр төлдер, шошқаның оба вирусында - торайлардың өлі туып немесе тұқымның семіп қалуы көп кездеседі. Ал аса көңіл бөлетініміз малдың вирустық ауруларының адамға қауіптілігі (құтыру, вирустық энцефалит, тұмау, геморрагиялық қызба ж. т. б. )
БАҚЫЛАУ СҰРАҚТАРЫ
- Вирустардың табиғаты.
- Вирустардың ашылуы.
- Вирустардың биосферадағы орны мен рөлі.
- Вирустардың басқа инфекциялық агенттерден ерекшеліктері.
- Инфекциялық патологияда вирустардың рөлі.
- Вирионның өлшем бірлігі.
- Вирионның физикалық құрылысы және симметриясы.
ӘДЕБИЕТТЕР
- Сюрин В. Н., Белоусова Е. В., Фомина Н. В. - Ветеринарная вирусология. - М. : ВО Агропромиздат, 1991.
- Троценко Н. И., Белоусова Р. В., Преображенская Э. А. - Практикум по ветеринарной вирусологии. - М. : ВО Агропромиздат, 1989.
- Мырзабекова Ш. Б. Жалпы вирусология. Оқулық. Алматы, Білім, 2004. -368 бет.
2-тақырып. ВИРУСОЛОГИЯЛЫҚ ЛАБОРАТОРИЯДА ЖҰМЫС ІСТЕУ ТӘРТІБІ
Сабақтың мақсаты. Студенттерге практикалық сабақтар кезінде және кейін арнайы вирусологиялық зерттеу лабораторияларында жұмыс істеген кезде қандай негізгі жағдайларға көңіл бөлулері керек екендігіне тоқталу. Сабақтың мазмұны. Өндірістік малдәрігерлік лабораториядағы вирусологиялық бөлімнің негізгі мақсаты - вирустық жұқпалы ауруларға дер кезінде нақты диагноз қою. Вирусологиялық лабораторияда патологиялық материалмен жұмыс істегенде, әркім мына үш жағдайға көңіл бөлулері керек. 1. Лабораториядағы жұмыс істеп отырған зерттеушілердің қауіпсіздігін қамтамасыз ету.
2. Зерттеліп отырған материалдың бөгде микрофлорамен ластануын болдырмау.
3. Инфекцияның лабораториядан тысқары таралуын болдырмау. Бұл айтылған талаптар үшін тек мына жұмыс ережелерін дұрыс орындау керек:
а) жұмыс орнында өте жинақы болу керек б) лабораторияға, кафедра аудиториясына тек халатпен, ақ қалпақпен және дәкеден жасалған маскамен кіру керек;
в) жұмыс үстелінде ешқандай бөгде заттар болмауы тиіс.
г) сабаққа керекті құралжабдықтарды кезекші студент таратып береді; д) қолданылып отырған құралдар стерильді болуы тиіс; е) ерітінділерді сорып алуы үшін резина - сорғышты қолдану керек (түтікшені ауызға салып соруға болмайды) ;
ж) қолданылған құралдарды залалсыздандыру үшін оларды арнайы стерилизаторға жинастыру керек; з) қолданылған шыны түтікшені дезинфекциялаушы ертіндісі бар сауытқа жинастыру керек;
и) жұмыс үстінде пайдаланылған қағаз және т. б. қалдықтарды арнайы сауытқа жинап стерилдеу керек;
к) қолданылған шайынды суларды жалпы су құбырына төгуге болмайды;
л) егер студент зерттеліп отырған вирустық материалды кездейсоқ төгіп не болмаса үстөлге тамызып алса, ол міндетті түрде сабақ жүргізіп тұрған оқытушыға хабарлап, ол жерді залалсыздандыру керек;
Сабақ соңында студент жұмыс орнын жөнге келтіріп, кезекшіге өткізіп, қолын сабынды сумен жуу керек.
Есте сақтайтын жай - лабораторияға түскен кез келген материалды залалданған деп түсіну керек. Ал залалданған материалмен жұмыс істеу әрбір зерттеушіден үлкен жауапкершілікті, жинақылықты талап етеді. Вирусологиялық лабораторияда істейтін кез келген қызметші асептика мен антисептика ережесін біліп оларды бұлжытпай орындауы керек.
Асептика дегеніміз - адам денесіне, қолына, кілегей қабықтарына түскен микроорганизмдер мен вирустарды өлтіріп, олардың індет туғызуына жол бермеуге бағытталған шаралар. Бұл мақсат үшін мынадай антисептиктер қолданылады - 70 % этил спирті, 5 % спиртті йод ерітіндісі, 0, 5-3 % хлорамин ерітіндісі, 0, 5-1 % формалин ерітіндісі және 1-2 пайыздық метилкөгі мен бриллиант жасылының спирттік ерітінділері.
Дезинфекция дегеніміз - физикалық және химиялық заттар көмегімен қоршаған ортадаға адам және мал организмдеріне патогенді микроорганизмдер мен вирустарды өлтіру шаралары. Бұл мақсатта мына химимялық ерітінділер қолданылады - 0, 1-10 % хлорлы әк, 0, 5 % формалин, хлорамин, 3-5 % фенол, лизол, 2-3 % сілтілі ерітінділер. Дезинфекциялау үшін қолданылатын ерітінділердің түрлері мен олардың концентрациясын таңдау дезинфекцияланатын объектіге байланысты. Стерилизация дегеніміз - кез келген лабораториялық материалдарда, заттарда, ерітінділерде, қоректік орталардағы микроорганизмдерді толық жою шарасы. Бұны физикалық (жоғары температурамен әсер ету, ультракүлгін сәулесімен әсер ету, бактериологиялық сүзгіден өткізу) және химиялық әдістермен орындауға болады.
Зерттелуге жіберілетін вирустық материал міндетті түрде таңбаланылуы (нөмірленуі) тиіс, яғни қандай материал, қай жерден, қай уақытта алынғаны ж. т. б. мәліметтер көрсетіледі. Зерттелініп отырған материалдан алынған вирусты әрі қарай егжей - тегжейлі зерттеу және оны серологиялық идентификациялау үшін материалды консервациялайды (бұзылудан қорғау шарасы) .
Вирустарды концервациялау үшін мына әдістер қолданылады: 1. Вирустық материалды ( зерттелініп отырған органдар мен ағзалардың кесінділері) ұзақ уақыт сақтау үшін 50% глицерин ерітіндісін пайдаланады. Оның бактериостатикалық қасиеті бар. 2. Көп жағдайда вирустарды минус 20, минус 30, минус 70 градус температурада суытатын тоңазытқыштарда сақтайды. Кейбір вирустар бұл аталған температурада өздерінің залалдылығын қорғағыш белоктік заттар қоспасынсыз жоғалтуы мүмкін. Бізге белгілі жай - ол вирустық материалда неғұрлым белоктік заттар аз болса, соғырлым вирустар тұрақтылығының төмендігі байқалады, яғни олар өздерінің биологиялық белсенділігін жоғалтады. Вирустарды мұздату арқылы сақтағанда мынадай қоспаларды пайдалануға болады - инактивтелген қан сарысуы, майсызданған сүт (10-30 %) және желім (0, 5-1, 5пайыз) .
3. Вирусты сақтаудың тиімді жолының бірі - лиофилдеу немесе вакуум жағдайында мұздатып кептіру. Вирусологиялық лабораторияда мынадай құжаттар болу керек: 1. Вирусологиялық зерттеулерді тізетін дәптер. 2. Залалданған жануарларды тізетін дәптер. 3. Патологиялық материалдан бөлініп алынған вирусты тізетін және олардың залалданғаны туралы белгілейтін дәптер.
Студенттерге берілетін тапсырма 1. Кафедраның вирусологиялық лабораториясының жұмысымен, құрал-жабдықтарымен танысу. 2. Вирустық материалмен жұмыс істеу ережелерін қарастыру. 3. Шыны - түтікті резина сорғышты пайдалануды үйрену(машықтану) .
Құрал - жабдықтар
- Лабораториядағы құрал- жабдықтар.
- Люминисценттік микроскоп.
- Центрифугалар.
- Тоңазытқыштар.
- Магнитті бұлғауыштар.
- Термостаттар.
- Спиртовкалар.
- Резина - сорғыштар.
- Шыны түтіктер.
- Петри табақшалары.
- Қоректік орталар.
ТЕКСЕРУ СҰРАҚТАРЫ
1. Вирусологиялық лабораторияда жұмыс істеу ережелерін айтыңыз.
2. Вирустық материалды сақтау (концервация) жолдары қандай?
3. Вирустарды жою әдістерін айтыңыз.
3 -тақырып. ПАТОЛОГИЯЛЫҚ МАТЕРИАЛ АЛУ ЖӘНЕ ОНЫ ЛАБОРАТОРИЯЛЫҚ ЗЕРТТЕУГЕ ДАЙЫНДАУ
Сабақтың мақсаты: Студенттерді ауруға күдікті малдан немесе өлекседен қандай заттарды зерттеуге алу және оның әдістемелерімен таныстыру. Сабақтың мазмұны: Ауруға нақты диагноз қою - зерттелуге тиіс материалды ережеге сай алып оны лабораторияға жеткізіп зерттеу ерекшеліктеріне тікелей байланысты.
Ауруға күдіктенген жануардан немесе өлекседен ауру қоздырғышын бөліп алу үшін алынған заттарды (ағзаларды) патологиялық материал деп атайды. Зерттелуге тиісті материалды ауру малдан немесе өлекседен тез арада алып лабораторияға жіберу керек. Патологиялық материалды алу кезінде болжаған аурудың патогенезін және вирустың тропизмдік қасиетін ескеру керек, яғни індет қоздырғышының кіру жолын, оның организмге таралуын, қоздырғыштың шоғырлану жерін және организмнен шығу жолын ескерген жөн. Мысалы, дерматропты вирустарды бөлу үшін дененің жарақаттанған жерінің тері қабыршақтарын, күлдіреуіктерді, нейротропты вирустарды бөлу үшін - миды, жұлынды, пневмотропты вирустарды бөлу үшін танау мен кеңсіріктің бөліндісін, олардың жуындысын жібереді. Вирусты бөліп алу үшін организмнен кез келген экскреттері мен секреттерін, ағзалардың кесінділерін, қанды, лимфаны лабораторияға жіберуге болады. Вирусты бөліп алу үшін кейбір вирустық ауруларда фибринсізденген қанды немесе ерітілген қанды (дистилденген су мен қанның 1+1 қосындысы) жіберуге болады. Ал вирусқа қарсы антиденені анықтау үшін бір малдан 2-3 апта аралатып екі мәрте қан сарысуын жіберу керек. Танаудан, көзден, жұтқыншақтан және тік ішектен зерттелінетін материал алу үшін стерильді мақта немес дәкеден жасалған тампон (анжы) арқылы жұғынды алып оны 5-10 миллилитрлік Хэнкс немесе физиологиялық ерітіндіге араластырады. Бұл ерітінділердің құрамына пенилциллин және стрептомицин антибиотиктерін 500ЕД дозасында қосалқы микроорганизмдер тіршілігін сақтау үшін қосады. Ал вирустардың тез арада инактивтелуін тоқтату үшін ерітіндіге арнайы белокті заттар - 0, 5 % желім, немесе 0, 5-1% альбумин қосады.
Несепті катетер көмегімен стерильді сауытқа алады.
Мал өлгеннен кейін зерттелуге тиісті материалды барынша жылдам алуға тырысу керек. Себебі, көптеген вирустық індеттерде мал өлгеннен кейін жүретін аутостерилизация феномені болады. Бұл кезеңде вирустың саны күрт азайып және өлекседе бактериялардың өсуі қарқындайды, ал вирусты байырғы әдістермен бөліп алу қиынға түседі. Патологиялық материал ретінде, 10-20 грамм мөлшерінде, ішкі органдар мен ағзалардан кесінді алуға болады. Вирустардың инактивациясын баяулату үшін алынған материалды салқындатқыш қоспамен термосқа салады. Салқындатқыш қоспа ретінде тәжірибеде 3 бөлік мұз немесе қар және 1 бөлік ас тұзын қолданады. Егер бұл әдістемеге мүмкіншілік болмаса онда материалды глицериннің 50 пайыздық ерітіндісіне салады. Бірақ глицерин ерітіндісі материалды иммунды флюоресценция әдісімен зерттеуге кедергі жасайды. Осы себепті материалмен бірге лабораторияға люминисценттік микроскопияға жұғынды жібереді. Аса көңіл аударатын жай - зерттеуге алынған материалды белгілеу (этикеткалау) . Оңай өшіріліп немесе алынып қалатын таңбалар болмау керек. Белгіде материалдың кімнен, қандай шаруашылықтан, қандай малдан және қашан (қай күні) алынғанын көрсетіп термосқа сүргі салады. Алынған материалды, болжау диагнозын және шаруашылық туралы, оның толық эпизоотологиялық деректерін көрсетіп жолдама қағазбен лабораторияға арнайы адаммен жібереді. Лабораторияда зерттеу жұмысын осы жолдама хатта көрсетілген болжау диагнозына сүйене жоспарлайды. Алынған материал тез арада зерттелуге тиіс. Егер мүмкіншілік болмаса (эксперименттік жануардың, тауық эмбрионының немесе клетка өсіндісінің жоқтығы) онда материал минус 40-70 градуста сақталуы керек.
ВИРУСТЫҚ МАТЕРИАЛДЫ ЗЕРТТЕУГЕ ДАЙЫНДАУ
Келіп түскен материалды консерванттардан (глицерин т. б. ) тазартады, мұзын ерітеді. Зерттеуге материалдың жартысын қалдырып, қалғанын тоңазытқышқы қояды. Бұл қосымша зерттеу қажет болып қалған жағдайда керек. Зерттеу жоспары жасалынады.
Органдар мен ағзаларды зерттеуге дайындау
1. Материалды стерилді фарфор түйгішке салып қайшымен майдалайды да арнайы кварц құмын қосып езгілейді. 2. Езілген материалдан Хэнкс немесе фосфаттық ерітінділерді қосып 10 пайыздық жүзінді (суспензия) дайындайды. 3. Жүзіндіні центрифугаға минутына 1500-3000 айналыммен 10-15 минут айналдырады. 4. Тұнба үстіндегі мөлдір сұйықты стерильді флакондарға, түтіктерге сорып алады. 5. Бөлінген алынған сұйықты кездейсоқ микроорганизмдерден тазартады: а) бактериалды сүзгіштерден өткізу арқылы; б) антибиотиктер (пенициллин, стрептомицин ж. т. б. ) қосу арқылы. Олардың дозасы 1мл сұйыққа 100-200 ЕД. Антибиотик қосылған жүзінді 1 сағаттан астам тұрмау керек. 6. Дайындалған ЕПА, ЕПС, ЕПБС, Сабуро қоректік орталарына егу арқылы бактериологиялық тексеруден өткізеді (бактерияларға, микроскопиялық саңырауқұлақтарға) . 7. Суспензияда бактериялар мен саңырауқұлақтар болмаса, вирустың бар - жоғын анықтау үшін, онымен лабораториялық жануарларды, тауық эмбриондарын және клетка өсіндісін залалдайды. Егер бактериологиялық тексерудің нәтижесі оң болса, яғни материал бактериялармен ластанған болса, онда жүзіндіні тағыда антибиотиктермен әсерлейді.
Студенттерге берілетін тапсырма
1. Ауру малдан және өлекседен патологиялық материал алу және оны лабораторияға жеткізу ережелерін меңгеру (жолдама хат, этикеткалар тағу, консервациялау әдістері) . 2. Зерттелінген материалдан жүзінді(суспензия) дайындауды үйрену, білу.
Құрал-жабдықтар
Стерилизаторлар, стерилді қайшылар мен қысқыштар, спиртовкалар, стерилді мақта-тампондар (анжы), спирт - ректификат, пенициллин флакондары, термос (салқындатқыш қоспамен), стерилді түйгіштер, антибиотиктер, қоректік орталар, центрифугалар.
ТЕКСЕРУ СҰРАҚТАРЫ
1. Патологиялық материал дегенді қалай түсінесіз? 2. Ауруға күдікті малдан және өлекседен вирусологиялық зерттеу үшін не алуға болады? 3. Патологиялық материал алу кезінде вирустың қандай қасиеттерін ескереміз? 4. Алынған материалды қандай күйде жеткізеді және оның қандай сақтау жолдары бар. 5. Материалды вирусологиялық зерттеуге қалай дайындайды? 6. ЕПА, ЕПС, ЕПБС және Сабуро қоректік орталарын қандай мақсатпен пайдаланады.
4-тақырып. ПАТОЛОГИЯЛЫҚ МАТЕРИАЛДАҒЫ ВИРУСТАРДЫ ВИРУСТЫҚ ДЕНЕШІКТЕР МЕН ВИРИОНДАРДЫ ТАБУ АРҚЫЛЫ АНЫҚТАУ
Сабақтың мақсаты: Зерттелініп отырған патологиялық материалда вирустың бар-жоғын (индикация) оның торша ішіндік денешіктер құру қасиеті арқылы анықтау әдістерін үйрету.
Сабақтың мазмұны: Алғашқы сабақтан бізге вирустардың абсолютті торша ішіндік паразит екендігі белгілі. Торша ішінде вирустар көбінесе өзара байланыссыз РНҚ немесе ДНҚ молекулаларының шоғырлануы болып келеді. Ал әрбір нуклеин қышқылдарының молекуласына вирустық белоктар туралы мағлұмат жазылған. Торша ішінде сол генетикалық мағлұмат іске асып әр түрлі вирустық белоктар жасалынады. Вирустардың көптеген құрылыс белоктарында өздігінен бірігіп агрегат түзу қасиеттері бар. Ал әрбір осындай күрделі агрегатқа РНҚ-ның немесе ДНҚ-ның бір молекуласы қосылады. Кейде бұлардың құрамына торшаның липидтері де бірігеді. Сонымен вирион құрылады. Вирионды - вирустың торшадан тыс, белсенділігі жоқ тіршілік ету формасы деп атауға болады. Вирустар бір торшадан екіншісіне немесе бір организмнен екіншісіне осы вирион түрінде беріледі.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz