Қолданбалы химия кафедрасының №1-№5 зертханалық жұмыстарының нұсқаулығы


№ 1 зертханалық жұмыс
Бейорганикалық қосылыстардың кластары
Жұмыстың мақсаты
Бейорганикалық қосылыстардың
негiзгi кластары,
оларды алу жолдары,
химиялық қасиеттерін зерттеу.
Жұмыстың мазмұны :
а) қышқылдық оксидтер мен негiздiк
оксидтердiң сумен әрекеттесуі;
б) ерiмейтiн гидроксидтердi алу жолдары;
в) гидроксидтердiң берiктiгi;
г) орта тұздарды алу;
д) негiздiк тұздарды алу;
е) амфотерлiк гидроксидтердi зерттеу.
Техникалық қауіпсіздік :
химиялық реактивтермен жұмыс істегенде өте сақ болу қажет.
Қажетті қондырғылар мен реактивтер :
а) жанарғы;
б) тұздардың, қышқылдардың, негіздердің ерітінділері;
в) фенолфталеин, оксидтер.
Жұмыстың теориялық негізі
Оксидтер дегеніміз - екі элементтен тұратын, біреуі міндетті түрде оттегі болып келетін күрделі заттар.
Оксидтер үш топқа жіктеледі; негіздік, қышқылдық және амфотерлі.
Негіздік оксидтерге К 2 О, СаО, ВаО, СuО т. б. қышқылдық оксидтерге: СО 2 , SО 3 , Р 2 О 5 , СІ 2 О 7 т. б. амфотерлі оксидтерге АІ 2 О 3 , ВеО, Сr 2 О 3 т. б. жатады.
Негіздер дегеніміз - бір немесе бірнеше гидроксил тобымен байланысқан металл атомдарынан тұратын күрделі заттар. Мысалы: NaOH, КОН, Са(ОН) 2 және т. б.
Қышқылдар дегеніміз - сутегі атомдары мен қышқыл қалдығынан тұратын күрделі заттар. Мысалы: НСІ, HNO 3 , H 2 SO 4 , H 3 PO 4 .
Тұздар дегеніміз - металл атомдары мен қышқыл қалдықтарынан тұратын күрделі заттар. Олар орта, қышқылдық, негіздік және қос тұздар болып жіктеледі.
Қалыпты немесе орта тұздарға: NaCl, FeCl 3 , CaCl 2 , KNO 3 .
Қышқылдық тұздарға: NaHCO 3 , Ca(HCO 3 ) 2 , KHSO 4 .
Негіздік тұздарға: CuOHCl, CuOHNO 3, AlOHCl 2 ;
қолданбалы химия кафедрасы
Жұмыстың барысы
1- тәжiрибе: Металл оксидтерi мен бейметалл оксидтерінiң сумен әрекеттесу реакциясы.
а) Екi пробиркаға 2-3 мл дистилленген суды құйыңыз және бiреуiне СаО, екiншiсiне ВаО оксидтерiн кiшкентай шпательмен салыңыз.
Әрбiр пробиркаға 1-2 тамшы фенолфталеин тамызып, негiздер түзiлгенiн анықтаңыз. Реакциялар теңдеуiн жазыңыз.
б) Пробиркаға 2-3 мл дистильденген су құйып, оған Кипп аппаратынан көміртек диоксидін жіберіңіздер. Химиялық теңдеулерді молекулалық, иондық түрде өрнектеңдер.
2-тәжiрибе: Нашар еритiн мыс, никель және темiр гидроксидтерiн алу
Үш пробиркаға 2-3 мл: 1-не мыс, 2-не никель, 3- не темiр (III) тұзының ерiтiндiлерiн құйыңыз.
Әрбiр пробиркаға натрий гидроксидiнің 2н ерітіндісін тұнба түзiлгенше қосыңыз. Орындалған реакцияның теңдеулерін жазыңыз. Түзiлген тұнбаның түсiн жазып көрсетiңiз.
Тұнбаларды сақтаңыз!
3-тәжiрибе: Гидроксидтердiң берiктiгi
2-шi тәжiрибе бойынша алынған мыс, никель, темiр гидроксидтерiнiң тұнбаларын абайлап қайнағанша қыздыру керек. Қай гидроксид түсiн өзгерттi, себебi не, қай гидроксид ыдырады? Реакция теңдеулерін жазыңыз.
Тұнбаларды сақтаңыз!
4-тәжiрибе: Мыстың (ІІ), никельдің (ІІ) және темiрдің (III) орта тұздарын алу
3-шi тәжiрибе бойынша алынған гидроксидтер тұнбаларына азот қышқылын қосыңыз. Тиiстi реакциялардың теңдеулерiн жазыңыз.
5-тәжірибе. Мыс пен кобальттың негiздiк тұздарын алу
а) Екi пробиркаға 2-3 мл-ден мыс сульфатының ерiтiндiсiн құйыңыз. 1- ші пробиркаға көк тұнба түзiлгенше 2-3 мл натрий гидроксидiн (С NaOH = 2моль/л) қосыңыз. 2-ші пробиркаға натрий гидроксидiн (С NaOH = 0, 5моль/л) тамшылатып аспан түстi көк тұнба түзiлгенше қосыңыз (әрбiр тамшыдан соң араластыру керек) . Екi пробиркадағы тұнбаны абайлап қайнағанша қыздыру керек.
Неге бiрiншi пробиркадағы тұнба қараяды, ал екiншiсiндегi тұнба өзгермейдi, соған түсiнiк берiңiз және тиiстi реакциялардың теңдеулерiн жазыңыз.
б) Кобальт хлоридiнің (II) ерiтiндiсiне тамшылап натрий гидроксидiн (С NaOH = 0, 5моль/л) тұнба түзiлгенше қосыңыз (әрбiр тамшыдан соң араластырып отыру керек) .
Тұнбаның түсi қандай? Осы тұнбаны ерітіндісімен бірге екi пробиркаға тең бөлiңiз.
Бiреуiне натрий гидроксидiнiң тең көлемiн құйып содан кейiн қыздырыңыз. Басқасына тұз қышқылының ерiтiндiсiн тұнба толық ерiгенше қосыңыз. Тиiстi реакциялардың теңдеулерiн жазыңыз.
қолданбалы химия кафедрасы
6. Қышқыл тұздар
а) Пробирканың 1/3 бөлігіне кальций гидроксидін құйып, оған Кипп аппаратынан көміртектің диоксидін тұнба түзілгенше және ол ерігенше жіберіңіздер.
б) 6a -тәжірибеден алынған кальций гидрокарбонатын 3 пробиркаға бөліп құйыңдар. 1-ші пробирканы лайланғанға дейін қыздырыңдар. 2-ші пробиркаға кальций гидроксидін, 3-ші пробиркаға натрий карбонатын құйыңыздар. Реакция теңдеулерін жазыңдар.
7-тәжiрибе: Амфотерлiк гидроксидтердiң қасиеттерi
а) 2-3 мл алюминий тұзының ерiтiндiсiне тамшылатып отырып, араластыру арқылы натрий гидроксидiн (С NaOH = 0, 5моль/л) тұнба түзiлгенше қосыңыздар.
Тұнбаны ерiтiндiмен бiрге екi пробиркаға бөлiңiз. Бiреуiне артығымен натрий гидроксидiн (С NaOH = 2моль/л), ал екiншiсiне тұнба толығымен ерiгенше тұз қышқылын қосыңыз. Екi пробиркадағы да тұнба еріп кетуі қажет.
Неге екi пробиркадағы да тұнба ерiп кетеді? Гидроксидтiң амфотерлiк қасиетiне анықтама берiңiз.
б) Осы сияқты бақылауларды мырыш, хром тұздарын алып орындап көрсетiңiз.
Жұмысты өндеу:
Лабораториялық дәптерге тәжірибелердің атын, реакциялардың молекулалық, иондық теңдеулерін және алынған заттардың ерекше қасиеттерін (тұнбаның түсі, газдың иісі т. б. ) жазыңыз.
Бақылау сұрағы:
1. Тұздарды алудың 10 түрлі әдістерін жазып көрсет.
2. Бес-бестен бейорганикалық заттардың кластарына мысал келтір.
Қолданбалы химия кафедрасының
26. 06. 2015 ж. отырысында
№17 бұйрықпен бекітілген
қолданбалы химия кафедрасы
№ 2 зертханалық жұмыс
Мырыштың эквиваленттiк молярлық массасын анықтау
 Жұмыстың мақсаты
Жұмыстың мақсаты
Тәжірибеде мырыштың
эквиваленттік молярлық массасы қышқылдан
сутектi ығыстыру арқылы анықталады.
Жұмыстың мазмұны:
а) эвдиометрдің газ шығармайтындығын тексеру;
б) тәжирібе жүргізу;
в) бөлініп шыққан сутектің көлемін өлшеу және қалыпты жағдайға келтіру;
г) мырыштың эквиваленттік молярлық массасын тауып және салыстырмалы қатені есептеу.
Қажетті қондырғырлар мен реактивтер:
- Эвдиометр;
- Өлшенген мырыш түйіршігі;
- Тұз қышықылының ерітіндісі;
- Дистилленген су;
- Барометр;
Жұмыстың теориялық негіздері.
Эквивалент дегеніміз реакция кезінде орнын баса алатын, қосып алатын, бөліп шығаратын бір сутек ионының немесе ТТР кезіндегі бір электрон эквивалентіне тең заттың бөлшегі.
Zn + 2HCl = ZnCl 2 + H 2 ↑
Бұл ТТзР реакциясында 2-электрон қатысады. Бір электронға сәйкес реакция
½ Zn + HCl = ½ ZnCl 2 +½ H 2 ↑
яғни, бір электронға 1/2 атом Zn, бір молекула HCl, 1/2 молекула ZnCl 2 және 1/2 молекула H 2 сәйкес келеді. Бұдан Э (Zn) =½ Zn; Э (HCl) = HCl; Э (ZnCl 2 ) = ½ ZnCl 2 ; Э (H 2 ) =½ H 2 ↑
2NaOH + H 2 SO 4 = 2H 2 O + Na 2 SO 4
бұл реакцияға 2 ион сутегі қатысады, сондықтан бір сутегі ионына
NaOH + ½ H 2 SO 4 = H 2 O + ½ Na 2 SO 4
сәйкес келеді. Сондықтан Э (NaOH) = NaOH; Э (H 2 SO 4 ) =½ H 2 SO 4 ;
қолданбалы химия кафедрасы
Э (H 2 O) = H 2 O; Э (Na 2 SO 4 ) = ½ Na 2 SO 4
Зат мөлшерінің бірлігі- моль. Моль - 6, 02 . 10 23 структуралық элементі бар атом, молекула, ион, эквивалент заттың мөлшері. Сонымен эквиваленттік моль дегеніміз - құрамында 6, 02 . 10 23 эквиваленті бар зат мөлшері. Бір эквиваленттік мольдің массасы заттың эквиваленттік молярлық массасы деп аталады. М э , г/моль. Біз қарастырған мысалдағы заттардың мольдік массасы:
М Э (Zn) = ½ M(Zn) = 1/2 . 65=32, 5 г/моль
М э (HCl) =M(HCl) = 36, 5 г/моль
Заттың эквиваленттік молярлық массасын табу үшін төмендегі формулаларды қолданамыз:
А) жай заттар үшін
М э =М/В
мұндағы М-берілген заттың молярлық массасы; В - атомның валенттілігі.
Б) күрделі заттар үшін
М э =М/В . n
мұндағы М-берілген заттың молярлық массасы; В-атомның валенттілігі; n-молекуладағы функционалдық топтың саны.
Мысалы:
М Э (Al) = 27/3 = 9 г/моль
М Э (H 2 SO 4 ) = 98/2 = 49 г/моль
М Э (Al 2 (SO 4 ) 3 ) = 342/3 . 2 =57 г/моль
Барлық заттар бір-бірімен эквиваленттеріне сәйкес әрекеттеседі.
Эквиваленттер заңы: Реакцияға түсетін заттардың массасы олардың эквиваленттеріне тура пропорционал болады.
m 1 /m 2 = М Э1 / М Э2
Егер әрекеттесуші заттар ерітінді түрінде болса, онда эквиваленттер заңы былай өрнектеледі: с эк1 . V 1 = с эк2 . V 2 ; мұндағы с эк1 және с эк2 -ерітіндінің молярлық концентрациясының эквиваленті, моль/л; V 1 мен V 2 -әрекеттесуші ерітіндінің көлемі, мл.
Жұмыстың орындалуы. Жұмысты орындаудың алдында эвдиометр аспабының жұмысқа дайындығын (газ шығармайтындығын) тексеру керек. Ол үшiн:
1. Теңестіретін түтіктен воронка арқылы бюретканы нольдік бөліміне дейін сумен толтырып, аспаптағы ауаны ығыстыру қажет.
2. Содан кейін бюретканы штативке бекiту керек. Егер аспап жұмыс iстеуге дайын болса, алғашқы кезде бюреткадағы су аздап төмен түседi де, одан кейiн тұрақты деңгейде қалып қояды. Егер аспап дұрыс болмаса бюреткадағы су үздiксiз төмен түсе бередi.
3. Оствальд пробиркасындағы тармақтың біреуіне мырышты өлшеп салыңыз, ал екінші тармаққа тұз қышқылын құйыңыз.
қолданбалы химия кафедрасы
4. Оствальд пробиркасын төңкеріңіз, сонда қышқыл мырыш бар тармаққа төгіледі, екеуінің арасында реакция басталады.
5. Реакция нәтижесінде бөлініп шыққан сутек бюреткадағы суды ығыстырады. Теңестіретін түтікті реакция барысында төмендету қажет. Сонымен қатар түтік пен бюреткадағы су бір деңгейде болу керек, яғни аспаптағы газ қысымы атмосфералық қысымға жақын болуы қажет.
6. Мырыш толық еріп кеткесін, бюретка арқылы бөлініп шыққан сутектің көлемін эвдиометр арқылы өлшеу керек.
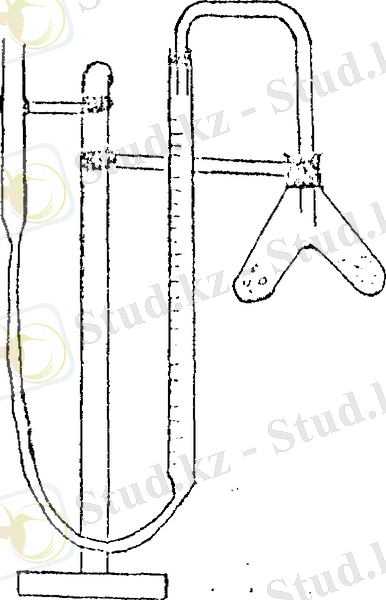
1. Көлемі 50 мл бюретка;
2. Екі тармақты пробирка (Оствальдтің
пробиркасы) ;
3. Теңестіретін сауыт ретінде қызмет
атқаратын ашық түтік;
4. Штатив.
1- сурет. Сутегінің көлемін есептеуге арналған
кұрылғы - эвдиометр
Алынған нәтижелердi өндеу мен есептеу.
1. Металдың массасы (m) - г;
2. Бөлiнген сутектiң көлемi (V) - мл;
3. Атмосфералық қысым ( Р) - кПа. Р 0 = 101325 Па = 760 мм. с. б. ;
4. Абсолюттiк температура (Т) - 273 + t 0 C;
5. Тәжірибе температурасы (t 0 , C) ;
6. Тәжірибе температурасындағы су буының қысымы (W) - кПа;
7. Аспаптың ішіндегі сутектің қысымы (P-W) - кПа;
8. Қалыпты жағдайға келтірілген сутектің көлемі - V 0 (H 2 ) .
Металл ығыстырған сутектiң көлемi:
сутектiң парциалдық қысымы: Р Н2 = P - W.
Металдың эквиваленттік массасын табудың бiрiншi жолы .
Металл ығыстырған сутектiң көлемiн Менделеев - Клапейрон теңдеуi бойынша қалыпты жағдайға келтiредi:
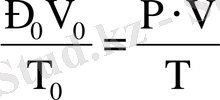 Equation. 3 немесе
Equation. 3 немесе
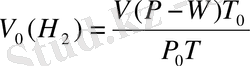 Equation. 3
Equation. 3
Мұндағы Т = t
 Equation. 3 273 - абсолюттiк температура, Р
0
= 760 мм с. б. немесе 101, 325 кПа; Т
0
= 273 К. V
c
(H
0
) - ығысқан сутектiң қалыпты жағдайдағы көлемi.
Equation. 3 273 - абсолюттiк температура, Р
0
= 760 мм с. б. немесе 101, 325 кПа; Т
0
= 273 К. V
c
(H
0
) - ығысқан сутектiң қалыпты жағдайдағы көлемi.
Сутек молекулалары молiнiң массасы 2г қалыпты жағдайда 22, 4л көлем алса, атомдар молiнiң массасы 1г - 11, 2 л немесе 11200 мл көлем алады.
қолданбалы химия кафедрасы
Металдың эквиваленттiк массасын М Э мына формула бойынша табамыз:
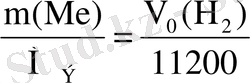 Equation. 3 М
Э
(Zn) =m(Zn)
.
11200/ V
0
(H
2
)
Equation. 3 М
Э
(Zn) =m(Zn)
.
11200/ V
0
(H
2
)
Металдың эквиваленттік массасын табудың екiншi жолы.
Бұл әдiс бойынша Менделеев-Клапейрон теңдеуi арқылы РV=m/MRT сутектiң массасын тауып, оны эквиваленттер заңының теңдеуiне
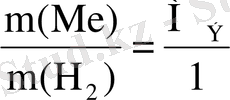 Equation. 3 қою арқылы металдың эквиваленттiк массасын табады.
Equation. 3 қою арқылы металдың эквиваленттiк массасын табады.
10. Тәжірибенің салыстырмалы қатесін табу:
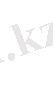
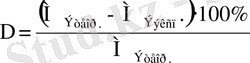
Бақылау сұрағы:
- Мыс қосылыстарында бір және екі валентті болады. Мыстың атомдық массасы мен валенттіліктерін пайдаланып, бір және екі валентті мыстың эквиваленттерін анықтаңыздар.
- 1г металл 1, 78 г күкіртпен қосылады. Күкірттің эквиваленті 16 г/моль екенін еске алып металдың эквивалентін есептеп шығарыңыз.
Қолданбалы химия кафедрасының
26. 06. 2015 ж. отырысында
№17 бұйрықпен бекітілген
қолданбалы химия кафедрасы
Әртүрлі температурадағы су буының қысымы, кПа
Реттік
№
Температура
К 0
Қысым
мм. сын. бағ.
Қысым
кПа
Атмосфералық қысым, кПа
Қысым
мм. сын. бағ.
Қысым
кПа
Қысым
мм. сын. бағ.
Қысым
кПа
№ 3 зертханалық жұмыс
Химиялық реакцияның жылдамдығы
Жұмыстың мақсаты
 Химиялық реакцияның жылдамдығының заттардың концентрациясына және температураға тәуелді екенін зерттеу.
Химиялық реакцияның жылдамдығының заттардың концентрациясына және температураға тәуелді екенін зерттеу.
Жұмыстың мазмұны
а) Тиокүкірт қышқылының ыдырау жылдамдығының тиосульфаттың концентрациясына байланысты өзгеруі;
в) Тиокүкірт қышқылының ыдырау жылдамдығының температураға байланысты өзгеруі.
Жұмыстың теориялық негіздері
Химиялық реакцияның жылдамдығы дегеніміз - уақыт бірлігіндегі заттың концентрациясының өзгерісі.
υ = (c 2 - c 1 ) / (τ 2 - τ 2 ) =∆c/∆τ
Химиялық реакцияның жылдамдығына көптеген факторлар әсер етеді: реагенттердің концентрациясы, температура, катализатор, сыртқы басқа да әсерлер, әрекеттесуші заттардың табиғаты.
Химиялық реакциялардың концентрацияға тәуелділігі әрекеттесуші массалар заңы арқылы өрнектеледі. Заң: “Химиялық реакциялардың жылдамдығы әрекеттесуші заттардың стехиометриялық коэффициенттерінің дәрежесіндегі концентрацияларының көбейтіндісіне тең”.
aА + bВ = сС
реакциясы үшін, әрекеттесуші массалар заңының формуласы мынадай:
υ =k c a A c b B
Химиялық реакциялардың температураға тәуелділігі Вант-Гофф ережесімен сипатталады: “Температураны әрбір 10 0 С ұлғайтқанда, химиялық реакцияның жылдамдығы 2-4 есе артады”.
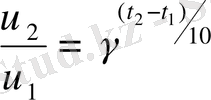
Бұл жұмыста химиялық реакцияның жылдамдығы тиокүкірт қышқылының ыдырау реакциясы арқылы зерттелінеді. Тиосульфат натрийға күкірт қышқылын қосқанда төмендегідей реакция жүреді:
Бұл жұмыста химиялық реакцияның жылдамдығы тиокүкірт қышқылының ыдырау реакциясы арқылы зерттелінеді. Натрий тиосульфатына күкірт қышқылын қосқанда төмендегідей реакция жүреді:
қолданбалы химия кафедрасы
Na 2 S 2 O 3 + H 2 SO 4 = H 2 S 2 O 3 + Na 2 SO 4 , тез жүретін саты
H 2 S 2 O 3 = H 2 SO 3 + S↓, баяу жүретін саты
H 2 SO 3 = SO 2 ↑+ H 2 O, тез жүретін саты
Жиынтық теңдеу былай жазылады:
Na 2 S 2 O 3 + H 2 SO 4 = H 2 S 2 O 3 + SO 2 ↑+ S↓ + Na 2 SO 4
Бұл реакцияның жылдамдығы баяу жүретін екінші реакцияның жылдамдығына тәуелді. Баяу жүретін сатыда түзілетін коллоидты күкірт ерітіндіні лайлайды. Тиосульфат ерітіндісіне күкірт қышқылын қосқан кезден бастап, ерітіндідегі ең алғашқы лайлану пайда болғанға дейінгі уақыт - реакция жылдамдығын көрсетеді.
Қажетті реактивтер мен приборлар:
А) Натрий тиосульфаты ерітіндісі, с = 0, 0025моль/л;
Ә) Күкірт қышқылының ерітіндісі, с = 0, 0025моль/л;
Б) Пробиркалар, шыны таяқша;
В) Секундомер;
Г) Пипеткалар.
Жұмыстың орындалуы
1-тәжірибе. Реакция жылдамдығының концентрацияға тәуелділігі.
Пробиркаға өлшеуіш пипетканың көмегімен 1мл натрий тиосульфаты ерітіндісін (с = 0, 0025моль/л) және 2 мл дистилденген су құясыңдар, басқа пробиркаға 1 мл күкірт қышқылының ерітіндісін (с = 0, 0025моль/л) құйыңдар. Осыдан кейін Na 2 S 2 O 3 ерітіндісіне H 2 SO 4 ерітіндісін қосып бірден секундомер арқылы қышқылды қосқан уақыттан бастап лайлану пайда болғанға дейінгі уақыт аралығын дәл анықтаңыз. Осы тәжірибені натрий тиосульфатының көлемін көбейте отырып, тағы да екі рет қайталаңдар (тәжірибені кесте мәліметтерімен сәйкес жасаңдар) .
Na 2 S 2 O 3
мл
H 2 O
Мл
H 2 SO 4
мл
Жалпы
ерітінді
мл
Реак-цияға
кететін
уақыт, сек
Реакция
жылдамдығы
1/τ
1/τ-күкірттің түзілу жылдамдығы; τ-секундпен берілген уақыт
Реакция жылдамдығының концентрацияға тәуелділігін көрсететін график тұрғызыңдар.
қолданбалы химия кафедрасы
2-тәжірибе. Реакция жылдамдығының температураға тәуелділігі
Үш пробиркаға 2 мл натрий тиосульфаты ерітіндісін, басқа үш пробиркаға күкірт қышқылы ерітіндісін құйып алыңдар мен күкірт қышқылын құйып алыңдар. Сосын Na 2 S 2 O 3 және H 2 SO 4 ерітіндісінің бір жұбын су моншасына салыңдар. 1-ші жұбын бөлме температурасында жасаңдар. Ерітінділерді 1 минут ұстаңдар. Пробиркаларды судан шығармастан Na 2 S 2 O 3 ерітіндісіне H 2 SO 4 ерітіндісін жылдам қосыңдар. Қосқан уақыттан бастап тұнба пайда болғанға дейінгі уақытты секундомердің көмегімен дәл анықтаңдар. Осы тәжірибені су моншасының температурасын 10 0 С арттыра отырып, 2 рет жасаңдар. Тәжірибе нәтижелерін кестеге толтырыңыз, салыстырмалы жылдамдықты есепеңіз. Реакция жылдамдығының температураға тәуелділігін көрсететін график тұрғызыңдар.
Na 2 S 2 O 3
Мл
H 2 SO 4
мл
Реакция
жылдамдығы, 1/τ
Бақылау сұрақтары:
- Реакция жылдамдығына әсер ететін факторлар. Әрекеттесуші массалар заңы, оның математикалық өрнегі.
- Жылдамдық константасы дегеніміз не? Бұл өлшемнің физикалық мағынасы қандай және оған қандай факторлар әсер етеді?
- Вант-Гофф ережесі, математикалық өрнегі. Реакция жылдамдығының температуралық коэффициенті дегеніміз не?
4. Берілген теңдеулердің оң және сол бөліктерінің реакция жылдамдықтарының өрнегін жазыңыз.
1) 2SO 2 + O 2 = 2SO 3
2) N 2 + 3H 2 = 2NH 3
Қолданбалы химия кафедрасының
26. 06. 2015 ж. отырысында
№17 бұйрықпен бекітілген
қолданбалы химия кафедрасы
№4 зертханалық жұмыс
Қайтымды реакциядағы тепе-теңдіктің ығысуы
Жұмыстың мақсаты
Заттың концентрациясының тепе-теңдіктің ығысуына әсерін зерттеу.
Жұмыстың теориялық негізі
Көптеген химиялық реакциялар соңына дейін жүрмейді. Мұндай реакцияларды қайтымды реакциялар деп атайды. Қайтымды реакцияларға қайтымдылық белгісі ↔︎ қойылады. Мысалы:
А + В ↔︎ С + Д
Белгілі бір уақыттан кейін қайтымды реакцияларда тепе-теңдік орнайды. Тепе-теңдік дегеніміз - тура және кері реакцияның жылдамдығы теңескен кездегі жүйенің күйі. Тепе-теңдікті ығыстыруға болады. Тепе-теңдікті тура және кері бағытқа ығыстыруға болады. Тепе-теңдіктің ығысуы Ле-Шателье принципі арқылы іске асады. Заттың концентрациясын өзгерту арқылы тепе-теңдікті ығыстыруды қарастырайық.
Қажетті реактивтер:
А) Калий роданидінің ерітіндісі, С=0, 0025моль/л;
Ә) Темір(ІІІ) хлориді ерітіндісі, С=0, 0025моль/л;
Б) Калий хлоридінің түйірлері;
В) Пробиркалар
Жұмыстың жүру барысы:
Екі пробиркаға 5 мл-ден калий роданиді С=0, 0025моль/л мен темір (ІІІ) хлориді ерітіндісін С=0, 0025моль/л құйыңдар. Оларды бір-біріне құйып, араластырыңдар. Ерітінді қандай түске боялды? Алынған жалпы ерітіндіні тең етіп 4 пробиркаға бөліп құйыңдар. І-пробиркадағы ерітіндіні эталон ретінде қалдырыңдар. ІІ-пробиркаға 1 мл қаныққан темір(ІІІ) хлориді ерітіндісін, ІІІ-пробиркаға 1 мл калий роданидінің ерітіндісін құйыңдар. IV-пробиркаға калий хлоридінің бірнеше кристалдарын салыңдар. Әрбір пробиркадағы түстің өзгеруін бақылаңдар, эталон ерітіндімен салыстырыңдар.
Тәжірибеден алынған нәтижелерді жазу:
Бақылау нәтижесі төмендегідей жазылады:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz