Бұлшықет және дәнекер тіндерінің биохимиялық негіздері


Бұлшықет тканьдерінің биохимиясы .
Бұлшықет адам денесінің 40-42%-ін алады. Оның негізгі кызметі жиырылу және кайтадан орнына келу нәтижесінде адамның қозғалысын қамтамасыз етеді. Бұлшықеттің жиырылуы кезінде химиялык энергияның механикалык энергияға айналуы жүреді.
Бұлшыкеттің 3 түрі бар:
1) Қаңкалық немесе көлденең жолақты бүлшықеттер.
2) Тегіс, біріңғай салалы бүлшықеттер.
3) Жүректік бұлшықеттер.
Қаңқалық бұлшық еттер морфологиялық құрылысы жағынан және жүйкелену тәсілдерімен кейінгі екі түріне карағанда өзгеше болады. Барлық салмақтың 40%-і қаңқалық бұлшықет болса, 2, 5% жүректік бұлшықет болады.
Бүлшықет жеке-жеке талшықтардан тұрады. Ет талшығы үлкен, ядросы көп клетка болып табылады. Бұл клетканы электр-қозғыштық қасиеті бар плазма мембранасы сарколемма қоршап жатады. Цитоплазмада, яғни саркоплазмада басқа клеткадағы сияқты митохондрий т. б. органеллалар болады. Осы бұлшықет клеткасында клетканың жеке бір құрамды бөлігі болатын миофибрилдер болады.
Миофибрилл - құрылысы жағынан ерекше болып келетін клетка бойымен орналасқан белоктар тобы. Олар белоктар тізбегінің 2 түрінен тұрады: а) миозиндік белоктар (қалың қабат) ; ә) актиндік белоктар ( жұқа кабат) .

Миозиндік және актиндік белоктар барлық жиырылу жүйесінің негізгі компоненті болып табылады. Миофибрилде бұл белоктар белгілі бір тәртіппен орналасқан.
Миофибрилдердің қүрылыстық бөлімі саркомерлер болып табылады.

Саркомерлер - миофибрилдердің екі пластинкасының арасындағы бөлімі. Бұл бөлімді М-пластинаға бекітілген миозин жіпшелері және Z-пластинаға бекілген актин жіпшелері кұрайды.
Саркоплазмада миофибрилдерден басқа эндоплазмалық ретикулумның
цистерналары мен түтікшелері болады. Бұл түтікшелер көлденең орналасқан. Бұлшыкеттердің химиялық қүрамында: су - 75-77 %; белок - 20%; майлар - 1-3%; туалар -1%; көмірсулар - 0, 5-2%; экстрактивті заттар, яғни қалаық заттар 1% болады.
Белоктар . Бұлшықеттің құрамында көптеген белоктар болады: миозин, актин, актомиозин, тропомиозин, тропонин, миоглобин т. б.
Миозин - глобулинді белок, төмендегідей қызмет атқарады:
- Миозиннің молекуласы миофибрилдердің қалың қабатын құрайтын талшықтардыбір кезеңде түзе алады.
- Миозиннің ферменттік қасиеті бар. Бұл ферменттің қасиеті 1930 жылы В. А. Онгельстардт пен Любимованың еңбектері нәтижесінде дәлелденген. Онын АТФ-ты гидролиздік жолмен ыдыратуға мүмкіндігі бар.
- Миозин - миофибрилдердің жіңішке қабатының негізгі белогы болып табылатынактинмен байланыса алады. Миозиннің молекуласы ұзынша келген 2 негізгі ауыртізбектен және 4 жеңіл тізбектен тұрады.
Электрондық микрофотографиядан миозин молекуласының 2 бөлімінен тұратындығын көруге болады.

Аяқ бөлімі суперспиральданған 2 а- спиральдан тұрады, ал бас бөлімі глобуда түрінде ұйымдасқан 4 жеңіл тізбектен тұрады. Бас бөлімінің ферменттік қасиеті бар:
1) ол АТФ-ты гидролиттік жолмен АДФ-қа және Н3РО4 ыдыратады.
АТФ-АДФ+Н 2 О
2) бас бөлімінің актинмен байланысатын жері болады.
Миозиннің көптеген молекуласы бірімен бірі қабаттасып қанқалық бұлшықеттердің қалың қабатын құрайды.
Актин - миофибрилдердің жіңішке жіпшелерін құрайды. Ол екі түрде кездеседі:
а) глобуда түрінде - актин; ә) фибрилларлы түрі - F актин.
Фибриллярлы актин глоблалы актиннен тұрады, яғни глобулалы актиннің бірнеше молекуласы жіпке тізген моншақ секілді фибридлярлы актинді құрайды.
Актин миозинмен ктомиозин деп аталатын комплекс түзеді, бұл комплекс АТФ қатысуымен ыдырауы мүмкін, ал бірақ әрітіндіде АТФ және К, Мg иондары болса. актомиозин жіпшесі жиырыла алады.
1940 ж жүргізілген Сент-Дьердидің тәжірибесі бойынша бұлшықеттің жиырылуы актиннің, миозиннің, АТФ-тың бірімен-бірінің әрекеттесуі нәтижесінде жүреді.
Актин клетка активтілігінің біраз түрлеріне қатысады: 1/ даму кезіндегі клетканың жылжуына; 2/ қан ұйғының ретракциясына; 3/ зақымдалған клеткаларда макрофагтардың жылжуына т. б.
Тропомиозинді 1946 жылы Бейли ашқан, 2α - спиральдан тұрады. Жіңішке жіпке бойлай орналасады.
Тропонин - глобулалық белок. 1963 жылы Эбаси ашқан. 3 полипептилтік тізбектен тұрады: 1/ТпС -Са 2+ байланысатын; 2/ ТпТ- тропомиозинмен байланысатын; 3/ Тп -актинмен байланысатын тізбек. Сонымен қатар миозиннің АТФ-азалык активтілігін тежеуге да қатысуы мүмкін.
Миоглобин - қүрамында гем бар, гемопротеидтерге жататын күрделі белок. Қызыл бұлшықеттердің құрамында болады. Оттегімен байланысып, қандағы гемоглобинмен келетін оттегі жеткіліксіз болғанда, оттегінің бұлшықеттердегі қосымша резерві болады. Қанқа бұлшықетін екі топқа бөлуге болады: а/ қызыл бұлшықет. Мұнда митохондрий көп, глюкозаның, май қышқылдарының кетондық денелердің тотығуы аэробты жолмен жүреді.
ә/ ақ бүлшықет. Мұнда гликолизге қатысатын ферменттер активті болады және бұл бұлшықеттердің жиырылуы өте жылдам болады. Қызыл бұлшықетпен ақ бұлшықеттің өзара қатынасы әр кісіде әртүрлі болады. Осыған сәйкес спортсмендер арасында жақын және алыс қашықтықта жүгіретін кісілерді анықтауға болады.
Коллаген - бұлшықет тканьінің 10% жуығы. Дәнекер тканьның белогі.
Майлар . Аздаған мөлшерде кездееседі. Үшглециридтер 0, 6% мөлшерінде. Бұлшықет майларының негізгі бөлімі фосфатидтерден тұрады. Олар жүрек, канқа және бірыңғай салалы еттерге қарағанда 2 есе көп, жүрек сфингомиелинінде аздап кездеседі. Бұлшықет құрамында аздаған холестерин де бар.
Тұздар. Олардың негізгі бөлімін калий тұздарды құрайды. Na, РО 3 4 , М 2 , Са болады. Олар бұлшықеттің жиырылу процесіне қатысады.
Көмірсулар. Негізінен гликоген түрінде кездеседі. қажет энергия көзі ретінде жұмсалады.
Экстрактивті заттар. АМФ, АДФ, креатинфосфат, карнозин, ансерин. Бұл заттар бұлшықеттердің жиырылу қабілетін туғызады.
Бұлшықеттердің жиырылу механизмі.
Бұлшықеттердің жиырылу - оның саркомерлерінің қысқаруынан туады. Саркомерлердің қысқаруы қалай жүреді? Ол актиндік, миозиндік жіпшелердің бойымен М-пластикасына бағытталып қозғалуы арқылы жүреді. Ал актиндік жіптердің қозғалуы негізгі миофибрид белоктарының - миозиннің, актиннің,

тропомиозиннің және тропониннің өзара әрекеттесуі нәтижесінде іске асады. Маркомердің қысқаруы АТМ-тың гидролизі және Са 2+ қатысуымен жүреді. Яғни Са 2 ' бұлшықеттердің жиырылу процесінің аллостериялык жолмен физиологиялық реттеушісі болып табылады.

Нервтік импульс м. б. деполяриза Са 21 -тропенин-трономиоз-актин АІФ -миозин-актемиозин-Са + ыдырауы Са 2+ АТФ эндоплазмалык ретикулум.
Нервтік импульс мембрананың деполяризациясын туғызып Са~' эндоплазмалык ретикулумнан босап шығуына жағдай жасайды. Миозинмен актин әрекеттесіп, АТФ гидролизге ұшырайды. Сонан сон Са~ босайды. тропомиозин актиннің миозинмен байланысуын тежейді. Соның арқасында бұлшықеттің жиырылуы тоқтап, қайтадан орнына келеді. Са 2+ цитоплазмадан қайтадан эндоплазмалық ретикулумге енуі АТФ-аза насосы арқылы іске асады. Ол үшін энергия жүмсалады. 2 Са" 1 үшін молекула жүмсалады.
Бұлшықеттердің жиырылу механизімін схема түрінде төмендегідей етіп көрсетуге болады:

а) тыныштық кезінде миозиннің бас бөлімі актин жібімен байланаспайды.
ә) Са 2+ актинмен, миозинмен байланысып актомиозин түзеді.
б) миозиннің бас бөлімі өз бағытын өзгертеді, сонымен аяқ бөліммен бас
бөлімнің арасында бұрыш пайда болады, бұл бұрыш 45°тең.
в) миозиннің бас бөлімі актинмен байланысқан, оның 45°-қа бұрылуы актиннің
де жылжыуна әкеп соқтырады.
Ал АМФ көмірсулардың катаболизміне қажет ферменттерлерін, энергия көзі біткен кездегі күшті модуляторы болып табылады. АТФ гидролизі кезінде түзілетін АДФ тотығып фосфорилденудің гликолиздің. Кребс циклдерінің ферменттерінің активтендіруіне мүмкіндік жасайды. Қаңқалық бұлшықеттер үздіксіз жұмыс істеуге бейімделмеген, олар тек қажет уақытта ғана жұмыс істейді. Бұл еттердегі зат алмасу, осы еттердің жиырлуына қажет АТФ-ты өндіруге бағытталған. Бұлшықеттер жүмыс істеу активтілігіне сәйкес глюкоза, май қышкылдары, кетондық денелер сияқты энергетикалық субстраттарды қолданады, ал жүрек бұлшықеті бұлармен қоса сүт қышқылының энергия көзі ретінде жұмсайды.
Тыныштық кезінде бұлшықеттер жоғары май қышқылдарын, кетондық денелерді жұмсайды. Қалыпты яғни орташа жұмыс істеген кезде жоғары май қышқылдарының, кетондық денелерді, қан глюкозасын жұмсайды. Өте күшті активті жүмыс істеген кезде жоғары май қышқылдары, кетондық денелер, қан глюкозасы және бұлшықеттердегі қорлық гликоген жұмсалады.
Бұлшықеттердегі зат алмасу ерекшеліктері .
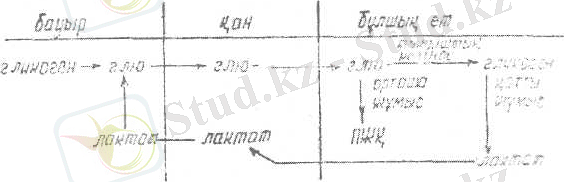
Бұлшықеттердегі көмірсулардың алмасуы тыныштық кезінде көмірсулардың гликогенге айналуын, ал күшті жұмыс істеген кезде осы гликогенді және қанмен түсетін глюкозаны энергия көзі ретінде жұмсауға бағытталған. Дегенмен негізгі энергетикалық мүқтаждықтар барлық бұлшықеттер үшін майлардың тотығуы нетижесінде түзілген жоғары май қышқыдарының β - тотығуымен қамтамасыз етіледі. Жоғары май қышқылдары митохондрияға, яғни β - тотығу жүретін жерге карнитиннің көмегімсн жеткізіледі.
Ал жүрек бұлшықеті қызу жұмыс кезінде, сүт қышқылдарын тотықтыру арқылы да энергиямен қамтамасыз етіледі. Сүт қышқылы жүрекке қаңқалық бұлшықеттерден қан арқылы түседі. Жоғары май кышқылдарынан басқа бұлшықеттер, әсіресе жүрек еттері бауырдан қан арқылы түсетін кетондык денелерді қолдана алады.
Жүрек бұлшықеттері осы жолмен жылдамдықпен жүргізілетін бұлшықеттердің жүмысы көмірсулардың және майлардың катаболизмін қажет етеді.
Инсулин қан глюкозасын бұлшықет клеткаларына өткізіп, тотығу процесіне қатысып, энергия көзі болуына жағдай жасайды.
Катехоламиндер гликогеннің жұмсалуын, май көздеріндегі майлардың липолизін жылдамдатып, бұлшықеттердегі β - тотыктыруды активтендіреді.
Бұлшықеттерде синтездік процестер өте аздап жүреді: гек қана глюкогенез, пируваттан аланиннің синтезі сияқты процестер жүреді. Бұлшықеттердегі гликолиз қайтымсыз, пентзофосфаттық жол жүрмейді, май кышқылдары және үшглицеридтер синтезделмей ді.
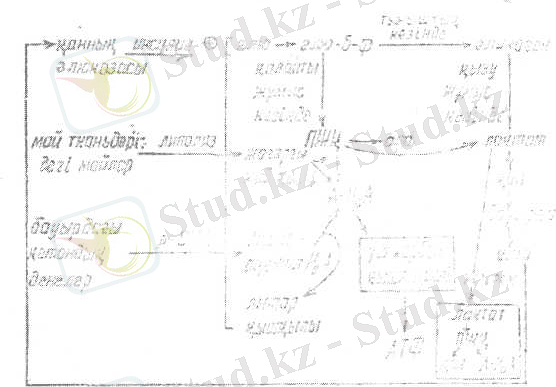
Бұлшықеттердегі гликогеннің қоры көп емес, сондықтан олар қызу жұмыс істеген кезде түзілетін энергияның белгілі бір шегі бар. Сонымен қатар сүт байланысты рН-тың төмендеуі, қатты жұмыс істеген кезде I -ның көтерілуі, бұлшықеттердегі метаболизмді баяулатады, бұлшықеттердің шаршауы «метаболиттік қарыз» деген ұғымды тудырады. Осы «метаболиттік қарызды» жою үшін, қатты жүмыс істеп біткенмен кейін де бұлшықеттерде оттегіні қолдану жылдамдығы жоғары болады. Себебі бұл оттегі НЖҚ-ның және сүт қышқылының тотығуы, АТФ пен креатимфосфаттың бұлшықеттегі корын орнына келтіру үшін қажет. Сонымен қатар, бауырда лактат глюконеогенез жолымен глюкозаға айналады, ол бұлшықетке түсіп, глюкогеннің орнына келтіруге жұмсалады.
Жүрек бұлшықетіндегі зат алмасу ерекшеліктері.
Жүрек бұлшықеті де каңқалық бұлшық ет секілді актин және миозин жіптерінен тұрады. Жүрекке тән қасиет бірқалыпты ырғақта жиырылу мен созылудың жүріп отыруы. Жүректе аэробты зат алмасу жүреді. Сондықтан оттегінің жетіспеуіне жүрек бұлшықеті өте сезімтал келеді. Жүрек бұлшықетінде қаңқалық еттерге қарағанда митохондрий көп болады. Олар жоғары май қышқылдарын. глюкозаны кетондық денелерді, сүт қышқылдарын, пирожүзім қышқылын аэробты жолмен тотықтыру процестеріне қатысады. Оттегінің клеткаішілық қоры болып табылатын миоглобиндер де көп кездеседі. Энергияның қоры ретінде гликоген және фосфокреатин болады, ал тамақтанғаннан кейінгі кезеңде глюкозаны энергия көзі ретінде қолдану күшейеді де, жоғары май қышқылдарының қолданылуы баяулайды.
Жүрек етінің жиырылуының және созылуының биохимиялык механизмі қаңка бұлшықетіне ұксас, тек қана жүрек етінің жұмыс істеуі үздіксіз, бірқалыпты жүріп отырады.
Нервтік импульс - Са~ босанып шығуы-жиырылу процесінің активтенуі.
Жүрек үшін тек қана аэробты жолмен тотығу процестері тән болғандықтан, миокардтың бір кішкене жеріндегі спазма немесе тромбоз нәтижесінде оттегінің жетіспеушілігі, жүрек бұлшықетіндегі қанның жетіспеуіне және осы еттің некрозына яғни миокард инфарктына әкеп соқтырады.
Жүрек бұлшықеттінің инфаркты енді кезде ондағы гликогеннің есебінен гликолиз күшейеді. Бұл кезде сүт қышқылыныңда концентрациясы артады. Бірақ гликогеннің қоры көпке жетпейді, глкозаның да сіңірілуі баяулайды, бұл энергия түзілуі жүретін механизмдердің зақымдалғанының белгісі болып табылады. Май алмасуынын да нашарлауы байқалады, үшглицеридтердің концентрациясы артып, тыныс алу ферментінің активтілігі төмендегідей болады: миокард инфаркты кезіндегі АТф-тын төмендеуі «бос күйінде» тотығуға көшуіне байланысты екендігін 1966 жылы академик Северин С. Е. жұмыстарында дәлелдеп берді, яғни тотығу кезіндегі бөлінген энергия АТФ-тың түзілуіне жұмсалмайтындығын көрсетті.
Ал жүректегі энергия ресурстарының және оттегінің өз орнына жұмсалмауы организмдегі жалпы зат алмасуға әсерін тигізіп бүйрек, бауыр, нерв жүйесі жүмысының нашарлауына да әкеп соқтырады.
Миокард инфаркты кезінде болатын патогенездердің биохимиялық негіздері схема түрінде берілген.
Бұлшықеттің алғашқы байқалатын миопатия деп атайды. Миопатиялар тұқым қуалаушылық негізінде өрбиді. Ауру бала кезден басталып, бұлшықет клеткалары біртіндеп өледі, бетін келе бұлшықет әлсіреп істен шығып қалады. Мұндай науқастар, ешбір инфекциялық ауруды көтере алмайды. Е витамині жетіспеген кезде де бұлшықеттердің атрофиясы байқалады. Бүл өзгерісті майлардың асқын тотығуы кезінде түзілетін заттардың әсерімен лизосом (ферменттердің) мембранасы зақымдалып, ондағы гидролиттік ферментердің босап шығып, жолындағы барлық заттарды гидролизге ұшырататындығымен түсіндіруге болады.
Бұлшықеттердің науқасы кезінде зәрде креатин кебейеді, ал креатинин азаяды. Креатининің мөлшері қанда артады.
Креатинин креатинфосфаттан ферменттін қатысуынсыз дефосфорилдену жолымен түзіледі:

Креатинфосфат -> креатинин + НЗРО4
Зәрмен
Креатининнің зәрмен тәуліктіік бөлінуі тұрақты шама ( 1-2 мг%) . Креатинннің бөлінуін бақылау арқылы бүйректің жұмысын бағалауға болады.
Дәнекер ткань биохимиясы.
Дәнекер тканьдер адам салмағының жартысына жуығын алады және ол шеміршек, сіңір, тіс, тері қан тамырлары, паренхималы органдардың стромалары, қарын т. б. құрамында болады. Дәнекер тканьдердің өздерше тән ерекшеліктер бар:
1. Оның құрамында фибробласта, остеобласта, хондробласта, керотобластар деп
аталатын көптеген клеткаішілік элементтер бар. Оның құрамында фибрильді белоктардың қатарына жататын - коллагендік, эластиндік талшықтар бар.
- Оның клеткаларының бірінен - бірінің ара кашықтығы алыс және олардың арасыяғни клеткааралық матрикс «ерекше» затпен толтырылған, барлық дәнекер ткаьнің50% - ке жуығын осы зат алады. Бұл клеткааралық матрикстің атқаратын бірнешеқызметтері бар:
1) клеткалардың бөлінуіне және олардың қызметіне қарай ерекшеленуіне қатысады.
Мысалы, сүйектік, шеміршектік, бүйректік тканьдер.
2) Биологиялық желімнің қызметін атқарып, клеткалардың тканьдерді қамтамасыз
етеді.
3) Тканьдердің биомеханиқалық қасиетін қамтамасыз етеді, яғни оларға мықтылық,
керілгіштік қасиет береді.
4) Органдардың, клеткалардың белгілі бір қалпы, формасы болуына және талғамды
өткізгіштігіне қатысады.
Дәнекер тканьдердің химиялық құрамы күрделі, ол 3 түрлі компоненттен тұрады.
- Фибрилді белоктар: коллаген, эластиннен.
- Белоктар мен тұратын гибридті молекула протеоогликандардан тұрады.
- Құрылымдық гликопротеин - фибронектиннен тұрады.
Қабыну, суық тиген кезде жүретін процестердің салдарынан дәнекер тканьдердегі зат алмасудың бұзылуы ревматизм, артрит сиякты ауыр науқастарға шалдықтырады.
Коллагеннің құрамы, құрылысы және синтезі.
Коллаген - организимдегі барлық белоктардын 1/3 бөлімін кұрайтын желім тәрізді белок. Ол 30-35% глициннен (әрбір 3-ші амин қышқылы), 20% пролин және оксиппролиннен, 10% аланиннен, сонымен бірге амин қышқылдарынан тұрады.
Коллагеннің молекуласы 3-а-полипетидтік тізбектен тұрады. Олардың әрқайсысында 1000-ға жуық амин қышқылдары болады және әрбір тізбек өзара көптеген сутектік байланыстар арқылы байланысқан.
>СО . . . Ш->С=0 . . . №І
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz