Комплексті қосылыстар: теориясы, құрылымы және қолданылу салалары


Мазмұны
Кіріспе
Комплексті қосылыстар. 3
Лигандалар. 4
Комплексті қосылыстар жіктелуі. 7
Комплексті қосылыстардың негізгі атаулары. 8
Аналитикалық химиядағы комплекс түзу реакцияларының сапалық талдауда қолданылуы10
Қорытынды
Пайдаланған әдебиеттер тізімі
Кіріспе
Бір элемент атомының өзара немесе басқа элемент атомымен химиялық байланысқа түсуі қасиеті яғни валенттік байланыс ұғымы XIX ғасырда атом-молекулалық теория дамуымен, Д. И. Менделеевтің (1869 ж. ) периодтық заңының ашылуымен, органикалық құрылыс теориясының ашылуымен (A. M. Бут¬леров, 1861 ж. ) тікелей байланысты болды. XIX ғасырдың аяғы мен XX ғасырдың басында ол жалпы қолданатын және химиялық қосылыстардың құрылысын оқып үйрену негізіне енгізілді.
Молекулалық қосылыстарды оқып үйрену көп уақыт бойы тоқтап қалды. Швеция ғалымы Альфред Вернер (1893 ж. ) химияға алғаш рет валенттік байланыс ұғымын енгізгеннен кейін ғана алға жылжыды. Олар Вернердің ұсынған комплексті қосылыстарды оқып үйренудің негізінде жатыр.
Жоғарғы ретті қосылыстардың құрылысын түсіндіру үшін А. Вернер химияға координациялық байланыстардың негізгі және қосымша валенттік ұғымын енгізді, валенттік ұғымын кеңейтті. Осыдан барып бұл теория координациялық деген ат алды.
А. Вернер өзінің комплексті қосылыстар туралы еңбегінде құрамы белгілі барлық химиялық қосылыстарды қарапайым немесе атомдық (бірінші ретті қосылыстар) және молекулалық (жоғарғы ретті) деп бөлді. Сулы ерітінділерінде тұрақты, өзінің алғашқы компоненттеріне ыдырамайтын немесе өте аз мөлшерде ыдырайтын молекулалық қосылыстар комплексті қосылыстар тобына біріктірілді.
Бірінші ретті қосылыстр түзіп бірігетін кейбір элемент атомдарында тек кәдімгі валенттік қанығады, бірақ олардың қосылысқа деген қабілеті жойылмайды. «Қосымша валенттік» арқасында бұл молекулалар ары қарай әрекеттесіп, күрделі қосылыстар түзеді. Вернер бойынша қосымша валенттік деп қарапайым жеке компоненттердің химиялық қосылғыштың жеке көрінісі. Комплексті қосылыс - орталық атомнан және ол координациялайтын молекулалар немесе иондардан тұратын, қатты күйде және судағы ерітінділерде дербес күйде бола алатын қосылыс (көбіне металдар және онымен байланысқан молекулалардан) немесе иондардан тұратын фрагменттері бар өздігінен өмір сүре алатын қосылыстар.
Комплексті қосылыстар
Комплексті қосылыстар - құрамында комплекс бөлшектер бар химиялық заттар. Комплекс қосылыстар - күрделі иондар не молекулар - кристалдық күйде де, еріген күйде де бола алады. Комплекс қосылыстардың молекуларында комплекс түзгіш не орталық атом көбінесе оң зарядты атомдардың бірі орталық орынды алады, оған координацияланған теріс иондар не бейтарап молекулалар лигандалар болады. Комплекс түзгіш және лигандалар ішкі сфераны құрайды да, квадрат жақшамен бөлінеді. Комплекс түзгіш пен лиганда арасында донарлы-акцепторлы механизм бойынша түзілген σ-коваленті байланыс болады, бұл байланыс саны координациялық сан деп аталады. Кешенді қосылыстар, координациялық қосылыстар - жай химиялық қосылыстардың әрекеттесуі нәтижесінде түзілетін құрамы күрделі химиялық қосылыстар. Кешенді қосылыстарға кристаллогидраттар CuSO45H2O, аммиакаттар CaSO44NH3, ашудас KAl(SO4) 212H2O, т. б. күрделі қосылыстар жатады. Кешенді қосылыстар теориясын алғаш (1893) Швейцария химигі А. Вернер ұсынды және оны координациялық теория деп атады. Бұл теорияға сәйкес Кешенді қосылыстарда орт. орын алып тұрған ион немесе атом кешен түзуші деп, ал оның айналасына жиналған, яғни координацияланған иондарды немесе молекулаларды лигандалар деп атайды. Кешен түзушінің айналасына координациаланған лигандалардың жалпы саны оның координациялық саны деп аталады. Кешенді ионның заряды сыртқы иондар зарядының қосындысына тең, бірақ мәні кері болады. Кешен түзушінің зарядын табу үшін Кешенді қосылыстардың құрамына кіретін басқа иондардың барлығының зарядының алгебр. қосындысын шығарып, оған теріс мән қояды. Негізгі кешен түзушілерге хим. элементтердің периодтық жүйесінің қосымша топшаларында орналасқан d-элементтері жатады. Маңызды лигандтарға жататын полюсті молекулалар: H2O, NH3, CO, NO, NH2OH, т. б., аниондар: F, Cl-, Br-, Қ-, O2-, OH-, CN-, т. б. Полюсті молекулалар Кешенді қосылыстардың сыртқы сферасында аниондар немесе катиондар болуы кешен ионының зарядына байланысты. Егер қосылыстағы кешен ионының заряды оң болса, сыртқы сферада аниондар орналасады, ал кешен ионының заряды теріс болса, сыртқы сферада катиондар орналасады. Кешенді қосылыстардың атауы кейбір электрбейтарап молекулалардың - лигандалардың қалыптасқан аты бойынша аталады, мыс. : H2O - аква, NH3 - амин, NO - нитрозил, т. б. Егер лигандалардың саны бірнешеу болса, олардың санын грекше көрсетеді: 2 - ди, 3 - три, т. б. Кешенді қосылыстар су ерітіндісінде диссоциацияланады. Кешенді қосылыстар хим. талдауда, сирек кездесетін маңызды металдарды бөліп алуда, тазартуда т. б. қолданылады. Кешенді қосылыстардың өсімдіктер мен жануарлар организміндегі биол. зат алмасу процестеріндегі маңызы зор.
Қазіргі уақытта " комплексті бөлшек" түсінігі туралы қатаң анықтама жоқ.
Комплексті бөлшек - кристалдар немесе ерітіндіде өздігінен болуға қабілетті күрделі бөлшектер, олардан өздігінен бөлінуге қабілетті жай бөлекті көруге болады. Мысалы, мыстың гидраттанған ионы [Cu(H2O) 4] 2 - комплексті бөлшек, ол ерітінділер және бірнеше кристаллогидраттарда болады, ол Cu2иондары және H2O молекуласынан құралған, су молекулалары -нақты молекулалар, Cu2 иондары көптеген мыс қосылыстары кристаллдарында кездеседі. Керісінше, SO42 ионы комплексті бөлшек болмайды, бірақ O2 ионы кристалл түрінде кезігеді, S6 ионы химиялық жүйелерде болмайды. Басқа да комплексті бөлшектерге мысалы: [Zn(OH) 4] 2, [Al(H2O) 6] 3, [Cu(H2O) 2Br2], [HgI4] 2
Бұлармен қатар NH4 және H3O, иондары комплексті бөлшектерге H. Кейде комплексті бөлшектерге донор-акцептор механизмімен түзілген химиялық күрделі заттарды жатқызады. Көптеген комплексті бөлшектерде, мысалы алюмокалилі квасцта [K(H2O) 6] [Al(H2O) 6] SO4 комплексті бөлшекте [Al(H2O) 6] 3 Al және O атомдары өзара донор-акцептор механизммен түзілген, [K(H2O) 6] комплексті бөлшекте электростатикалық (ион-дипольдық) әсер болады. Бұған дәлел- [NH4(H2O) 6], су молекулалары және NH4 ионы өзара тек ион-дипольмен әсер етеді.
Комплексті қосылыстар-құрамында бір немесе бірнеше донорлы-акцепторлы байланыс болатын жоғары ретті қосылыстар.
Комплексті бөлшектер зарядтары бойынша катион, анион, және де бейтарап молекула болады. Комплексті қосылыстар химиялық заттардың әртүрлі топтарына жатады. (қышқыл, негіз, тұз) . Мысалы: (H3O) [AuCl4] - қышқыл, [Ag(NH3) 2] OH - негіз, NH4Cl және K3[Fe(CN) 6] - тұздар. Комплекстүзуші - комплексті бөлшектегі орталық атом.
Комплекстүзуші - көбінесе оң зарядталған металл иондары, немесе комплекс түзуші элемент атомы, бірақ бұл и атом оттегі, азот, күкірт, йод және де басқа элементтер атомдары болуы мүмкін. Комплекстүзуші тотығу дәрежесі оң, теріс немесе нольге тең болады, комплекстік қосылыстан неғұрлым жай зат түзгенде ол өзгермейді.
Лигандалар
Лигандалар - комплекстүзуші маңайындағы атомдар немесе бейтараптанған топ атомдар.
Лигандалар болып комплексті қосылыстар түзуші молекулалар (H2O, CO, NH3т. б. . ), аниондар (OH, Cl, PO43 и др. ), және де сутегі катионы болуы мүмкін. Оларды унидентатты немесе монодентатты лигандалар (орталық атомның бір -байланыспен байланысуына сай), бидентатты (орталық атомның екі -байланыспен байланысуына сай), тридентатты т. б.
Комплексті бөлшектердің лигандалар типіне сай
1) Аквакомплекстер, лигандасы су молекуласы болатын комплексті бөлшектер. Катиондық аквакомплекстер неғұрлым [M(H2O) n] m тұрақты, аниондық аквакомплекстер тұрақсыз. Барлық кристаллогидраттар аквакомплексты қосылыстарға жатады, мысалы:
Mg(ClO4) 2. 6H2O шын мәнінде [Mg(H2O) 6] (ClO4) 2;
BeSO4. 4H2O шын мәнінде [Be(H2O) 4] SO4;
Zn(BrO3) 2. 6H2O шын мәнінде [Zn(H2O) 6] (BrO3) 2;
CuSO4. 5H2O шын мәнінде [Cu(H2O) 4] SO4. H2O.
2) Гидроксокомплекстер, лигандасы гидроксиль топтары болатын комплексті бөлшектер, комплексті бөлшектер гидроксид-иондар, мысалы: [Zn(OH) 4] 2, [Cr(OH) 6] 3, [Pb(OH) 3]
Гидроксокомплекстер аквакомплекстерден түзіледі, катиондық қышқылдық қасиетті:[Zn(H2O) 4] 2 + 4OH = [Zn(OH) 4] 2 + 4H2O
3) Аммиакаттар, лигандасы NH3 тобы болатын комплексті бөлшектер (комплексті бөлшектер-аммиак молекуласы), мысалы: [Cu(NH3) 4] 2, [Ag(NH3) 2], [Co(NH3) 6] 3.
Аммиакаттар да аквакомплекстерден алынуы мүмкін, мысалы:
[Cu(H2O) 4] 2 + 4NH3 = [Cu(NH3) 4] 2 + 4 H2O
Ерітіндідегі түсі көгілдірден ультракүлгін түске айналады.
4) Ацидокомплекстер, лигандасы оттекті, оттексіз қышқыл қалдықтары болатын комплексті бөлшектер (комплексті бөлшектер - аниондар, мысалы: Cl, Br, I, CN, S2, NO2, S2O32, CO32, C2O42 т. б. ) .
Ацидокомплекс түзілуіне мысалы:
Hg2 + 4I = [HgI4] 2
AgBr + 2S2O32 = [Ag(S2O3) 2] 3 + Br
Соңғы реакция фотографияда күміс бромидімен реакцияға енбеген фотоматериалдарды өшіру үшін қолданылады (фотопленка, фотоқағазда күміс бромиді, фотографиялық эмульсияда тотықсызданбайды, сондықтан қолданылады. )
5) лигандасы сутегі атомы болатын комплексті бөлшектер екі түрлі топқа жіктеледі: гидридті комплекстер және ониендік қосылыстар құрамына кіретін комплекстер.
гидридті комплекстер - [BH4], [AlH4], [GaH4] - акцептор орталық атом электрондары, ал донор - гидрид ионы. Сутегі атомының комплексте тотығу дәрежесі -1.
В ониендік комплекстерде орталық атом электрон доноры болады, ал акцептор -+1 тотығу дәрежелі сутегі атомы. Мысалы: H3O немесе [OH3] - оксоний ионы, NH4 немесе [NH4] -аммоний ионы. Сонымен қатар аралас иондар бар: [N(CH3) 4] -тетраметиламмоний ионы, [As(C6H5) 4] -тетрафениларсоний ионы, [OH(C2H5) 2] -диэтилоксоний ионы және т. б.
6) Карбонильді комплекстер - лигандасы CO тобы болатын комплекстік бөлшектер мысалы: [Cr(CO) 6], [Fe(CO) 5], [Ni(CO) 4] және т. б.
7) Анионгалогенаттые комплекстер -[I(I) 2] . типті комплекстер
Басқа да типті лигандалар бар. Мысалы-аква-гидроксокомплекс [Zn(H2O) 3(OH) ] .
Координациялық саны (КС) - орталық атом мен лиганда арасындағы ð-байланыс саны. Егер лигандалар унидентатты болса координациялық сан лигандалар санына тең.
КС орталық атомның электрондық құрамына, тотығу дәрежесіне, орталық атом мөлшері және лигандалар, комплексті қосылыстар түзілу жағдайы, температура және басқа да факторларға тәуелді. КС 2 ден 12 дейін мәнге ие бола алады. Көбінесе - алтыға, одан сирек -төртке тең болады.
Бірнеше орталық атомды комплекстік бөлшектер де кездеседі. Комплексті қосылыстың ішкі сферасы-лигандамен байланысқан орталық атом, яғни комплексті бөлшек.
Комплексті қосылыстың сыртқы сферасы - комплексті бөлшектермен иондық немесе молекулааралық, сутектік байланыспен байланысқан комплексті бөлшектердің қалған бөлшектері.
Комплексті бөлшектердің екі құрылымдық түрі қолданылады: орталық атом және лигандалардың зарядын формальды көрсету немесе комплексті бөлшектің зарядын формальды көрсету:
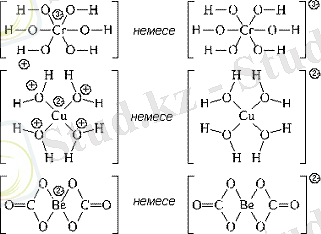
Комплексті қосылыстар жіктелуі
Химиялық зат ретінде комплексті қосылыстар иондық (кейде ионогенді деп те атайды) және молекулярлық (ионогенді емес) деп бөледі. Иондық комплексті қосылыстар зарядталған комплексті бөлшекті - қышқыл, негіз, тұздардың иондары. Молекулярлық комплексті қосылыстар зарядталмаған комплексті бөлшектерден тұрады (молекула), мысалы: [Fe(CO) 5] немесе[Cr(C6H6) 2] - бұлар негізгі топтардың кез-келгеніне жатқызу қиын. Комплексті қосылыстардың құрамындағы комплексті бөлшектер әртүрлі. Сондықтан комплексті қосылыстарды жіктеуде бірнеше белгілерін алып қарастырады: орталық атом саны, лиганда типі, координациялық сан және т. б.
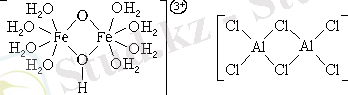
Орталық атом санына қарай комплексті бөлшектер бірядролы және көпядролы болып бөлінеді. Көпядролы комплексті бөлшектердің орталық атомы өзара үздіксіз немес лиганда арқылы байланысады. Бұл екі жағдайда да орталық атом лиганда атомдарымен комплексті қосылыстардың бір ішкі сферасын құрайды:
Комплексті қосылыстардың негізгі атаулары
Комплексті қосылыс формулалары кез-келген иондық қосылыстар сияқты құрастырылады: алдымен катион формуласы, сосын - анион формуласы.
Комплексті бөлшектер формуласы квадрат жақшада төмендегі ретпен жазылады: бірінші орында комплекстүзуші элемент символы, сосын - комплекстік катиондар лигандалар формулалары, одан кейін- комплекс бейтарап молекулалы лигандалар формулалары, кейіннен комплекс аниондар лиганда формулалары жазылады.
Комплексті қосылыстар аталуы кез-келген тұз негіз атауы сияқты аталады, (комплексті қышқылдар сутегі немесе оксоний тұздары деп аталады) . Аталуына катион және анион атаулары кіреді.
Комплексті бөлшектер атауына комплекстүзуші атауы және лиганда атауы кіреді (аталуы формулаға сай, бірақ оңынан солға қарай) комплекстүзуші катиондарда элементтің қазақша атауы, ал аниондарда- латын атауы қолданылады.
Көбірек таралған лигандалар атауы
H2O - аква
Cl - хлоро
SO42 - сульфато
OH - гидроксо
CO - карбонил
Br - бромо
CO32 - карбонато
H - гидридо
NH3 - аммин
NO2 - нитро
CN - циано
NO - нитрозо
NO - нитрозил
O2 - оксо
NCS - тиоцианато
H+I - гидро
Комплексті катиондардың аталуы
[Zn(H2O) 4] 2 - мырыштыңтетрааква ионы
[Fe(H2O) 5Cl] 2-темірдің(III) хлоропентааква ионы
[Ag(NH3) 2] - күмістің (I) диаммин ионы
[Al(H2O) 4(OH) 2] -алюминийдің дигидроксотетрааква ионы
[Cr(H2O) 6] 3 -хромның(III) гексааквааионы
Комплексті анион аталуы:
[Zn(OH) 4] 2 - мырыштың тетрагидроксо-ионы
[Ag(S2O3) 2] 3 - ди(тиосульфато) аргентат(I) -ионы
[Cr(CN) 6] 3 - гексацианохромат(III) -ионы
[Al(H2O) 2(OH) 4] - -ионы
[Co(NH3) 2(NO2) 4] - (III) -ионы
[Fe(H2O) (CN) 5] 3 - пентацианоакваферрат(II) -ионы[Co(NH3) 5SO3] - кобальттің (III) сульфитопентааммин ионы
Егер комплекс қосылыстың ішкі сферасы оң зарядты болса (катионды комплекс), сыртқы сферада теріс зарядты ион болады, не керісінше, ішкі сфера теріс зарядталса (анионды комплекс), сыртқы сферада оң зарядты ион болады. Егер ішкі сфера бейтарап болса, сыртқы сфера болмайды. Сыртқы сфера мен ішкі сфера арасында ионды байланыс болғандықтан күшті электролиттер сияқты жақсы диссоциацияланады. Ал ішкі сферада комплекс түзгіш пен лиганда арасында ковалентті байланыс болғандықтан, ерітіндідегі диссоциациясы аз болады:
K4[Fe(CN) 6] → 4K+ + [Fe(CN) 6] 4 -; [Fe(CN) 6] 4 -↔︎ Fe2 + + 6CN -
Комплекс иондардың зарядын анықтау үшін комплекс түзгіш пен лигандалар зарядтарын қосады.
Катионды комплекс қосылысты былай оқиды: алдымен грек санымен (ди, три, тетра, пента, гекса т. б. ) ↔︎0» жалғауы қосылған зарядталған лигандалар аталады, сосын бейтарап лигандалар саны мен аты аталады, артынан комплекс түзгіш аталады, оның тотығу дәрежесі жақшаның ішінде көрсетіледі. Бейтарап лигандалардан суды - аква, аммиакты - аммин деп атайды. Мысалы: [Pt(NH3) 3Cl] +-хлортриамминплатина(ІІ) ;
[Co(NH3) 5Br] 2+-бромпентаамминкобальт(ІІІ) .
Анион комплекс былай аталады: катионды комплекс ионы сияқты оқылып, ↔︎аты» жұрнағымен аяқталады:
[Сr(NH3) 3(SCN) 4] - − (ІІІ),
[Pt(ОH) 2Cl4] 2 - − (IV) .
Нейтрал комплекстерде комплекс түзгіштің тотығу дәрежесі көрсетілмейді, оқылуы катион комплекстері сияқты:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz