Тірі организмдердегі буферлік жүйелер және қандағы қышқыл-негіздік тепе-теңдіктің механизмі


Буферлік жүйелердің биологиялық маңызы
Тірі организмдердегі буферлік жүйелер қан мен тканьдердің рН тұрақтылығын қамтамасыз етіп отырады. Арнайы зерттеулердің нәтижесінде тірі организмдерде алмасу процесі кезінде көптеген мөлшерде қышқыл өнімдер түзілетіндігі дәлелденген. Мысалы, тәулігіне организмде 20-30 л бір нормальды күшті қышқылға эквивалентті әртүрлі қышқылдар түзіліп отырады. Организм сұйықтарының рН тұрақтылығын оның құрамындағы қуатты буферлік жүйелер сақтайды.
Клетка ішіндегі сұйықтардың рН мәндері көп жағдайда 6, 8-ден 7, 8-ге дейінгі аралықта өзгеріп отырады. Қажетті рН-ты сақтауға қатысатын көптеген буферлік жүйелердің ішінде НСО - 3 - Н 2 СО 3 және НРО 4 2- - Н 2 РО 4 - жүйелері бар. 7-кестедегі мәліметтерден рН 6, 5-8, 0 мәндеріне мүмкіндігінше жақын келетін осы аталған жүйелер екенін байқауға болады. Бұл буферлердің компоненттері қышқылдар және сілтілермен былайша әрекеттеседі:
Плазма (Na + , K + , Ca 2+ , Mg 2+ )
рH = 7, 4
рК
Гидрокарбонатты - 35% 6, 38
Фосфатты - 2% 7, 2
Белокты - 7%
44%
Эритроцит (негізінен К + )
рН = 7, 25
рК
ННb және ННbО 2 - 35% 6, 2 және 6, 92
Гидрокарбонатты - 18% 6, 38
Фосфатты - 3% 7, 2
56%
Артерия қаны
В = 25, 3 ммоль/л
ННbО 2 ⇄ Н + + НbО 2 -
әлс. қ-л қосарл. н-з
рК = 6, 95
рН(арт. қаны) = 7, 41 ± 0, 05
ННbО 2
Вена қаны
В = 24, 3 ммоль/л
ННb ⇄ Н + + Нb -
әлс. қ-л қосарл. н-з
рК = 6, 2
рН(вена қаны) = 7, 35 ± 0, 05
ННb - + О 2
НСl + НСО - 3 = Сl - + Н 2 СО 3
NaOH + Н 2 СО 3 = H 2 O + NaHCO 3
және HCl + HPO 4 2- = Cl - + H 2 PO 4 -
NaOH + H 2 PO 4 - = H 2 O + HPO 4 2-
Бикарбонат пен көмір қышқылынан түзілген буфер қандағы оттегі мен көміртегі диоксидін тасымалдауды реттеуде шешуші әрі өте маңызды роль атқарады. Қан плазмасының рН 7, 4 мәні негізінен НСО - 3 / Н 2 СО 3 және НРО 4 2- / H 2 PO 4 - жүйелерімен, сонымен қатар плазманың әртүрлі белоктарымен тұрақтандырылады. Қанның белоктары полиаминқышқылдар болғандықтан буферлік жүйелер сияқты қызмет атқарады. Бұл жүйені қарапайым Ме-белок / Н-белок жұбы түрінде қарастыруға болады. Плазма катиондарының басым бөлігін Na + иондары құрайды. Айтарлықтай аз мөлшерде К + , Са 2+ және Mg 2+ иондары кездеседі. Гендерсон-Гассельбах теңдеуі бойынша:
7, 4 = 6, 4 + lgHCO 3 - / Н 2 СО 3 немесе НСО 3 - / Н 2 СО 3 = 10
Эритроциттерде буферлік қызметті НСО 3 - / Н 2 СО 3 жүйесі және гемоглобин атқарады. рН 7, 25 шамасында. Катиондардан негізінен К + катионы бар. Тағы да Гендерсон-Гассельбах теңдеуін қолдансақ, НСО 3 - және көмір қышқылының қатынасы 7 шамасында екенін көреміз. Эритроцит мембранасы НСО 3 - , ОН - және Сl - иондарына жақсы өтімді де, керісінше, басқа иондарды нашар өткізеді.
Қанның маңызды буферлік жүйелері мен олардың салыстырмалы буферлік сыйымдылықтары 22-кестеде келтірілген.
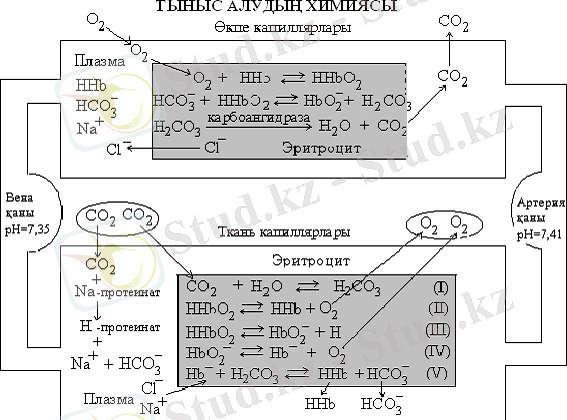
Өкпеде гемоглобин мен оттегінің реакциясы нәтижесінде түзілетін оксигемоглобин артерия қанымен қапилляр тмырларына тасымалданады, одан әрі миоглобиннің қатысуымен оттегі тканьдерге беріледі. Гемоглобин де, оксигемоглобин сияқты әлсіз қышқыл болып табылады. Дегенмен оксигемоглобин гемоглобинге қарағанда күштірек қышқыл болып келеді:
ННb ⇄ Н + + Нb - рК = 8, 2
ННbО 2 ⇄ Н + + НbО 2 - рК = 6, 95
мұндағы ННb және ННbО 2 - бір негізді гемоглобин және оксигемолобин. Олай болса, рН 7, 25 болғанда, шамамен 65% ННbО 2 диссоциацияланған түрде болады да, ННb тек қана 10% иондарға ыдырайды деген сөз.
Кесте 22
Қанның буферлік жүйелері және олардың салыстырмалы буферлік сыйымдылықтары
ННbО 2 оттегіні бөлуіне көміртегі диоксиді мықты әсер етеді. Көміртек диоксиді - метаболизмнің ақтық өнімі, оны қанға әртүрлі тканьдер бөліп отырады.
Оттектің бөлінуіне көміртек диоксиді болуы мықты әсер етеді.
СО 2 молекулаларының басым бөлігі мембрана арқылы эритроциттерге диффузияланып, онда сумен әрекеттеседі де Н 2 СО 3 түзеді. Бұл кезде төмендегі реакциялар орын алады:
ННbО 2 → ННb + О 2
ННbО 2 ⇄ НbО 2 - + Н +
НbО 2 - → Нb - + О 2
НbО 2 - -ге қарағанда ННbО 2 оттегіні оңайырақ бөледі, сондықтан көмір қышқылының пайда болуына байланысты рН-тың төмендеуі бірінші реакцияны ынталандырады. Әлсіз ННb қышқылының Нb - қосарланған негізі мына теңдеуге сәйкес көмір қышқылымен әрекеттесуге оңтайлы келеді:
Нb - + Н 2 СО 3 → ННb + НСО - 3
Түзілген бикарбонат-ион мембрана арқылы сыртқа шығып, қанның ағысымен өкпеге бағытталады. Қөмір қышқылының бөлініп шығу механизмдерінің бірі осындай. Вена қаны өкпеге қайта келіп жеткенде гемоглобин қайтадан оттегімен оксигемоглобин түзе әрекеттеседі:
ННb + О 2 → ННbО 2
Бикарбонат ионының қатысында рН өседі, сондықтан мына реакциялар орын алады:
ННbО 2 + НСО - 3 → НbО 2 - + Н 2 СО 3
және Н 2 СО 3 → Н 2 О + СО 2
Содан кейін көміртек диоксиді атмосфераға шығарылады.
Организмнен тыс (in vitro) гидратация және дегидратация баяу жүреді. Ал физиологиялық жағдайларда (in vivo) бұл реакциялар көміртек диоксидін тасымалдауды тиімді қамтамасыз ететін жылдамдықпен жүре алады. Осы екі реакция да эритроциттердің құрамында болатын арнайы карбоангидраза ферментімен катализденеді.
Тыныс алу процесінің біршама толық механизмі кестеде келтірілген.
Фосфатты буферлік жүйе (NaН 2 РО 4 + Na 2 НРО 4 ) дигидрофосфат және гидрофосфат-иондары арасындағы тепе-теңдікпен сипатталады:
Н 2 РО 4 - ⇄ НРО 4 2- + Н +
ПД ПА
Несеп және ас қорыту бездерінің сөлдері сияқты биологиялық сұйықтар үшін маңызы зор. Қандағы фосфатты буферлік жүйенің әсері мардымсыз.
Фосфатты буфер былайша қызмет жасайды: қанға күштірек қышқыл келіп түскенде ол Na 2 HPO 4 -пен әрекеттесіп, бейтарап тұз түзеді, нашар диссоциацияланатын бір негізді тұздың мөлшері өседі.
Қанға күшті негіз қосқанда ол бір негізді тұзбен әрекеттесіп, екі негізді әлсіз сілтілік тұз пайда болады. Қанның активті реакциясы бұл кезде аздап қана өзгереді. Екі жағдайда да бір немесе екі негізді тұздардың артық мөлшері несеп арқылы сыртқа шығарылады.
HCl + Na 2 HPO 4 = NaCl + NaH 2 PO 4
H + + HPO 2- 4 ⇄ H 2 PO 4 -
ПД ПА
NaOH + NaH 2 PO 4 ⇄ Na 2 HPO 4 + H 2 O
OH - + H 2 PO 4 + ⇄ HPO 2- 4 + H 2 O
ПА ПД
Қан плазмасының ақуыздары өздерінің амфотерлік қасиеттеріне байланысты буферлік жүйенің ролін атқарады. Қышқыл ортада олар өздерін сілтілер сияқты көрсетіп, қышқылдарды байлайды; сілтілік ортада қан плазмасының ақуыздары қышқылдар сияқты әрекеттесіп, сілтілерді бейтараптайды.
Ақуыз буферлерінің әсер ету механизмі алдында қарастырылған жүйелердің жұмысына ұқсас болып келеді:
Pt-COOH ⇄ Pt-COO - + H +
(ПД) әлсіз қ-л қосарланған н-з (ПА)
Н + + Pt-COO - ⇄ Pt-COOH
ПД ПА
ОН - + Pt-COOH ⇄ Pt-COO - + Н 2 О
ПА ПД
Амфолитті ақуыз молекулалары да буферлік әсер танытады:
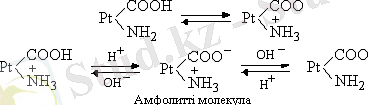
Екі жағдайда да Н + және ОН - иондары ақуыз молекуласымен байланысқан, сондықтан ортаның рН-ы айтарлықтай өзгермейді.
Қанның тұрақты реакциясын сақтауда тыныс алу аппаратынан басқа бүйректің маңызы өте зор. Ол организмнен қышқылдардың да, негіздердің де артық мөлшерін шығарып отырады. Активті реакция қышқылдық бағытқа қарай ығысқанда бүйректер көп мөлшерде несеппен сыртқа натрийдің бір негізді фосфатын шығарады, ал реакция сілтілік ортаға өткен кезде көп мөлшерде сыртқа сілтілік тұздарды - екі негізді фосфорқышқыл натрий мен натрий бикарбонатын шығарады.
Зат алмасу үрдістері кезінде сілтілік өнімдерге қарағанда қышқылдық өнімдер көптеп түзілетіндіктен, қанның қышқылдануының оның сілтіленуіне қарағанда қауіптілігі жоғары. Осыған байланысты қанның және ұлпалардың буферлік жүйелері сілтілерге қарағанда қышқылдарға деген жоғары төзімділік танытады. Мысалы, қан плазмасының реакциясын сілтілік бағытқа қарай ығыстыру үшін сумен салыстырғанда оған 40-70 еседей натрий гидроксидін артық қосу керек. Ал оның реакциясын қышқылдық бағытқа ығыстыру үшін таза сумен салыстырғанда 327 еседей тұз қышқылын артық қосу керек. Қандағы әлсіз қышқылдардың сілтілік тұздары қанның сілтілік қорын (резерв) түзеді. Оның шамасын көмір қышқылының қысымы 40 мм сын. бағ. (бұл шамамен альвеолярлық ауадағы көмір қышқылының қысымы) кезіндегі 100 мл қан байланыстыра алатын көмірқышқылының (СО 2 ) см 3 мөлшерімен анықтайды.
Қандағы қышқылдық және сілтілік эквиваленттердің қатынасы белгілі бір тұрақты шама болғандықтан, қанның қышқылдық-негіздік тепе-теңдігі деген түсінік қолданылады.
Ағзаның активті ортасының (қан) өзгеруін қорғайтын буферлік қуатты жүйелер болуына қарамастан, кейбір физиологиялық және патологиялық жағдайларда оның қышқылдығының немесе сілтілігінің өзгеруі байқалады. Активті реакцияның қышқыл бағытында өзгеруі ацидоз, ал сілтілік бағытта өзгеруі алкалоз деп аталады.
Ацидоз немесе алкалоз ас қорыту жолдары немесе тыныс алу мүшелері арқылы артық мөлшерде қышқылдығы немесе сілтілігі жоғары өнімдердің (тамақ, сусындар, медикаменттер, ауаны ластаушы заттар) келіп түсуі, ағзадан қалыпты зат алмасу, тыныс алу және қан айналу үрдістеріндегі патологияға байланысты түзілетін заттарды сыртқа шығарылуының бұзылуы кезінде орын алады.
Қазіргі клиникалық практикада ағзаның қышқылдық-негіздік тепе-теңдігін (ҚНТ) қанды Аструптың микроәдісі көмегімен зерттеп анықтайды. Ол ВЕ (лат. «би-эксцесс» - артық мөлшердегі сілті) бірлігімен анықталады. Ағзаның қалыпты қышқылдық-негіздік жағдайында ВЕ = 0 (Астрпуп аппаратында бұл мәнге рН 7, 40) сәйкес келеді.
ВЕ мәндері 0-ден +3-ке дейін болғанда ағзаның қышқылдық-негіздік жағдайы қалыпты деп есептелінеді, ВЕ = +(3-5) - стресс-қалыпты, ВЕ = + (6-9) - қауыпты, ВЕ = +(10-14) - қатерлі, ВЕ 14-тен асқанда - кризисті жағдай.
ВЕ < 0 (ацидоз) болғанда қышқылдық-негіздік тепе-теңдікті қалыпқы келтіру ұшін венаға 4%-дық натрий гидрокарбонаты еріиіндісін құяды. Бұл ерітіндінің қажетті көлемін (мл) мына эмпирикалық формуламен есептейді v = 0, 5mВЕ, мұндағы m - дененің массасы, кг.
Егер ацидоз жағдайы жүректің қысқа мерзімді тоқтауының нәтижесінде байқалса, онда ҚНТ ығысуын қалыпқа келтіру үшін 4%-дық NaHCO 3 қажетті көлемін (v, мл) мына формуламен есептейді: v = mz, мұндағы z - жүректің тоқтау ұзақтығы, мин.
Алкалоз кезіндегі ҚНТ-ні коррекциялау анағұрлым қиын және көптеген сыртқы факторларды ескеруді қажет етеді. Уақытша шаралардың бірі ретінде қанға 5-тен 15 мл-ге дейін 5 %-дық аскорбин қышқылының ерітіндісін құйған жөн.
Қышқылдық-негіздік титрлеу әдісінде қышқылдарды және қышқыл түзетін заттарды (әлсіз негіздердің катиондары мен күшті қышқылдардың аниондарынан түзілген тұздар және т. б. ) концентрациялары белгілі сілтілердің жұмыс ерітіндісімен (алкалиметрия), ал негіздер мен негіздік сипаты бар заттарды қышқылдардың жұмыс ерітінділерінің көмегімен (ацидиметрия) анықтауға болады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz