Сулы ерітінділердің физико-химиялық қасиеттері: осмостық қысым, изотониялық коэффициент, қышқыл-негіз теориялары және қанның буферлік жүйесі


Жоспар:
I. Кіріспе
II. Негізгі бөлім
2. 1. Осмостық қысым
2. 2. Изотоникалық коэффицент. Гипо, гипер және
изотоникалық ерітінділер
2. 3. Қышқылдық және негіздік теориясы
2. 4. Пролиттік тепе - теңдік. Қанның буферлік жүйесі
III. Қорытынды
Пайдаланған әдебиеттер
I. Кіріспе
Ерітінділер- кем дегенде екі құрамдас бөліктерден тұратын құрамы өзгермелі гомогенді (біртекті) жүйелер. Ерітінділер газ тәрізді, сұйық жәнеқатты болуы мүмкін. Олардың ішінде жан-жақты зерттелгені және жиі қолданылатыны сұйық, әсіресе, сулы ерітінділер. Сондықтан тұрмыста ерітінділер деп, көбінесе, сұйық күйдегі сипатталады. Ерітінділер қаныққан, қанықпаған және аса қаныққан деп бөлінеді. Берілген температурада жақсы еритін заттардың ерігіштігінің де шегі бар. Еріген заттың концентрациясы белгілі бір мөлшерден асқанда, оның артығы ерімей, ерітіндінің түбіне шөгеді. Бұл кезде ерітінді мен еріген зат тепе-теңдік жағдайда болады. Мұндай ерітінділерді қаныққан ерітінділер, ал концентрациялары қаныққан ерітіндінің концентрациясына дейінгі барлық ерітінділерді қанықпаған ерітінділер деп атайды. Кейбір еріткіштің белгілі бір мөлшерінде еритін заттың ерігіштігіне сәйкес мөлшерінен де артық мөлшерін ерітуге болады. Мұндай ерітінділер аса қаныққан ерітінділер деп аталады. Аса қаныққан ерітінділердің тұрақтылығы нашар болады. Кез келген сыртқы әсерден еріген заттың артық мөлшері ерітіндіден бөлініп, тұнбаға түседі. Сөйтіп аса қаныққан ерітінді жай қаныққан ерітіндіге айналады. Кей заттар ерігенде олардың молекулалары иондарға ыдырайды, яғнидиссоциацияланады. Электр тогын өткізетін болғандықтан, ондай заттардың ерітінділерін электролит ерітінділері деп атайды. Оған көптеген қышқылдар мен негіздердің, әсіресе, тұздардың ерітінділері жатады. Керісінше, ерігенде молекулалары иондарға ыдырамайтын, сондықтан электр тогын өткізбейтін заттардың ерітінділері бейэлектролиттердің ерітінділері деп аталады. Полимерлердің ерітінділері ерітінділердің үлкен тобын құрайды. Ерітінділердің бетіндегі бу қысымы және оның қату температурасы таза еріткіштікке қарағанда төмендеу, ал қайнау температурасы жоғарылау болады
II. Негізгі бөлім
2. 1. Осмостық қысым
Осмос. Осмос - еріткіш молекулаларын өткізіп, еріген затты өткізбейтін жартылай өткізгіш қабық (осмометр) арқылы еріткіштің қозғалысы. Осмостың классикалық үлгісі төмендегі суретте осмометрдің қант ерітіндісін таза судан бөлуі ретінде көрсетілген. Ерітіндідегі су концентрациясы таза суға қарағанд төмен. Таза еріткіш жағынан алғанда мембрана арқылы су молекуласының диффузиясы ерітіндідегі су концентрациясын мембрананың екі жағынан да теңестіруге тырысуда. Алайда концентрацияларда өзгешелік бар кезде мембрана екі жағынан да осмостық қысымға түседі. Сыртқы ыдыстағы еріткіш пен осмометрдегі ерітінді арасында тепе теңдік күй орнайды. Мұндай тепе теңдік ке сәйкес келетін қысымды осмостық қысымы деп аталады. Осмос қысымы - осмосты тоқтату үшін ерітіндіге түсірілетін қысым. Сонымен осмос қысымы деп ерітіндіні еріткішпен тепе теңдік күйде ұстап тұру үшін осмометр ішіндегі ерітіндіге түсірілетін қысым.
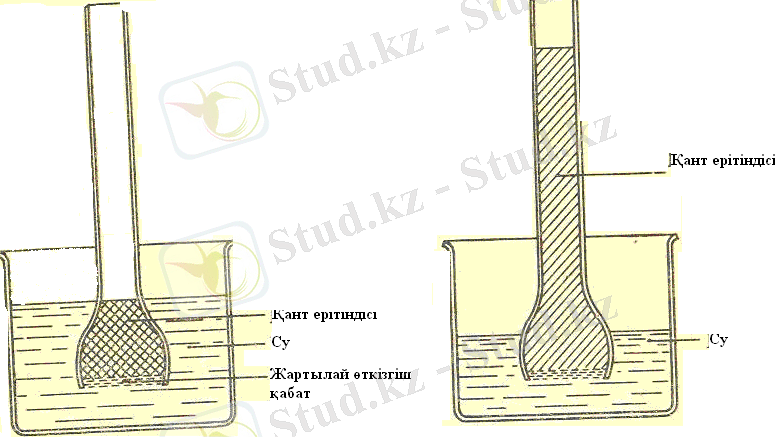
Сурет 1 (қант ерітіндісі, су, жартылай өткізгіш қабық)
Осмостық қысым - ерітінді диффузиясы кезіндегі ерітілген заттың жартылай өтімді мембранаарқылы тудыратын асқын қысымы. Сонымен қатар екі жақты бөлікте өзгереді. Осмостық қысым өсімдіктің сабағының өсімінде қоректенетін шырыныда маңызды рөл атқарады және басқа да организмдердің жасушаларындағы процестерде болады.
Электролит ерітінділері. Еріген кезде еріткішпен әрекеттесш, иондарға диссоциацияланып, ерітіндіге ток өткізгіштік кабілет беретін заттарды электролиттер дейді. Кейде электролиттер ионо-генді және ионоферлі болып екіге бөлінеді. Ионогенді электролит-тер таза күйінде диссоциацияланбаған молекулалардан тұрады. Бүл тектес электролиттерге сірке қышқылы, тұз қышқылы және тағы басқалар мысал болады. Ал, ионоферлі электролиттерге еш-бір еріткіште ерімесе де, таза қалпында-ақ өз құрамында диссо-циацияланған иондары бар қосылыстар жатады. Бұл топқа көпте-ген тұздар мысал болады. Егер электролит толық диссоциациялан-са және осы кездегі әрбір молекула v иондарға ыдыраса, онда ерітіндідегі иондар саны Nv болады, мұндағы N - электролит молекуласының саны. Егер де барлық молекула диссоциациялан-бастан, оның а бөлігі ғана ыдыраса, онда ерітіндідегі бөлшектер саны N электролитіндегіден і есе аз болады, мұндағы і - изото-никалық коэффициент, кейде оны Вант-Гофф коэффициенті де дейді.
і=1 + а(v-1) (95)
Мұндағы а - диссоциациялану дәрежесі, кейде оны иондану дә-режесі десе, енді бірде диссоциациялану коэффициенті дейді. Дис-социациялану дәрежесі иондарға ыдыраған молекулалардың электролиттегі барлық молекулаларға қатынасымен анықталады. Бұдан электролиттердің аномальдік, коллигативтік қасиеттерге бейім екендігі байқалады. Егер электролит емес ерітінділердің коллигативті қасиеттерін өрнектейтін теңдеуге изотоникалық коэффициентті енгізсе, онда тәжірибе кезінде және есептеу арқы-лы алынған шамаларды теңеуге болады.
2. 2. Изотоникалық коэффицент. Гипо, гипер және
изотоникалық ерітінділер
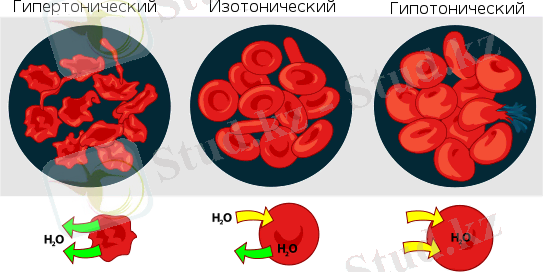
Жартылай өткізгіш қабат болмаған жағдайдың өзінде осмос қысымы туралы айтылады. Бұндай жағдайда ерітіндінің еріткіштің қосымша көлемін өзіне «сіңіріп» алуын меңзейді. Ерітінді концентрациясы жоғарылаған сайын оның осмос қысымы да арта түседі.
Біздің ағзамыздағы жасушалардың қабырғаларының өзі мембрана болғандықтан, осмостың физиологиялық үдерістердегі маңызы зор. Тірі табиғатта үнемі жасушаға және жасушадан судың осмостық қозғалысы жүріп тұрады. Егержасушаның өз ішіндегі қысымға өзі түскен ерітіндінің осмостық қысымы сәйкескелетін болса, онда жасуша құрамындағы сұйықтықтың көлемі өзгермейді, бірақсу екі бағытта да тең дәрежеде өтеді. Бұндай ерітінді изотоникалық деп аталады.
Адам қанының осмос қысымы NaCl ерітіндісінің 0, 9 %-на тең. Егер қан жасушалары осмос қысымы өз қысымынан төмен ерітіндіге түссе, су жасушаға оны ісіндіріп, жарып жіберетіндей дәрежеде кіреді. Сондықтан да адамға сұйықтық құйған кезде (мысалы, көп қан кеткенде), изотоникалық ерітіндіні пайдалау керек.
Диализ. Осмостың ертікіш затты емес ерітіндіні өткізетін жартылай өткізгіш қабық арқылы жүзеге асатынын айтып кеттік. Кейбір қабықтар коллоидты бөлшектерді өткізбей, төмен молекулалы ерітілген заттарды да өткізеді. Бұл құбылыс диализ деп аталады. «Жасанды бүйрек» құрылғысының жұмысы диализге негізделген. Яғни, жартылай өткізгіш мембрана арқылы қанға қажетті барлық коллоидты заттар мен қан жасушаларын, т. с. с. сақтай отырып, қаннан төмен молекулалы қалдық заттарды шығарады.
Тұтқырлық. Сұйықтықтағы тұтқырлық немесе ішкі үйкеліс дегеніміз сұйықтық ағысына қарсылық көрсету дегенді білдіреді. Әдетте ерітіндінің тұтқырлығы ондағы кедергінің артуымен өсе түседі. Әсіресе, жоғары молекулалы заттар сұйықтықтың ағу қабілетін нашарлатады, яғни, оның тұтқырлығын арттырады.
Сұйықтықтың тұтқырлығы температура артқан сайын төмендейді. (алайда, құрамында тұтқырлығы температураға байланысты болмайтындықтан косметикалық препараттарда жиі қолданылатын силикондар кездесетін ерітінділер жатпайды) .
2. 3. Қышқылдық және негіздік теориясы
Қышқыл (орысша: кислота) - химиялық қосынды, көк лакмус қағазына қызғылт рең беретін ерітінді, дәмі қышқыл. Қышқылдар құрамына қарай оттекті, оттексіз болып, олардағы сутекатомдарының сандарына қарай бір және көп негізді деп бөлінеді.
Азот, тұз, күкірт қышқылдары сұйық заттар, ал фосфор және бор қышқылы (Н 3 BО 3 ) - қатты заттар болса, кремний қышқылы суда ерімейтін іркілдек зат. Көмір және күкіртті қышқылдары тұрақсыз, оңай айырылатын заттар.
H 2 CO 3 →CO 2 ↑+H 2 O;
H 2 SO 3 →H 2 O+SO 2 ↑
Қышқылдардың құрылымдық формуласын жазғанда әуелі сутектің таңбасын шетіне жазамыз, өйткені ол бір валентті элемент.
Усанович теориясы - қышқылдық-негіздік әрекеттесудің жалпылама теориясы. Оны академик М. И. Усанович ұсынған (1938) . Теорияның басты ерекшелігі - 20 ғ-дан бері химиялық ғылымында қалыптасқан қышқылдық қасиеттің әмбебап иесі саналған сутекті жоққа шығару болды. Усанович қышқылдарға негізбен әрекеттесіп тұз түзуге қабілетті болатын бөлшектерді жатқызды. Солардың қатарында барлық катиондар, соның ішінде протондар бар. Негіздер қатарына табиғаттағы қышқылдарға қарама-қарсы заттар жатқызылады, өйткені олар қышқылдармен әрекеттескенде тұз түзеді. Демек, барлық аниондарда негіздік қабілетті бөлшек бар, себебі оларқышқылдық табиғаты бар катиондармен тікелей қосылып тұз түзеді.
Усановичтің қышқылдар мен негіздерге берген анықтамасы бұдан бұрынғы әйгілі болған иондық, сольвожүйелер және протондық, электрондық теориялардың анықтамаларын қамтиды.
Усанович теориясында химиядағы үйреншікті екі ұдайлылық (амфотерлік) қасиеттер кеңейте талқыланады, себебі ол барлық полюсті қосылыстарға тән. Полюсті бөлшектің молекуласының электр терістілігі жағынан катионқышқылдық, ал электрон жағынан анион-негіздік қабілетке ие болатындықтан олар әрдайым екі ұдайлылық қасиет көрсетеді. Жалпы алғанда заттар мен бөлшектердің әрекеттесетін серіктесіне байланысты қышқылдық немесе негіздік рөл атқаруы қышқылдық-негіздік табиғаттың салыстырмалы сипатқа ие болатынын дәлелдейді. Әрі бұл Усанович теориясының диалектілік мәнін аша түседі. Қарама-қарсы қасиеті бар заттар мен бөлшектердің, яғни қышқылдар мен негіздердің өзара күресі, дәлірек айтсақ, химиялық әрекеттесуі олардың бастапқы қасиеттерін әлсіретеді, көбіне түгелдей жойып жібермейді. Осыдан барып барлық дерлік заттарға белгілі бір дәрежеде қышқылдық (негіздік) қасиеттер тән деген қорытынды шығады, әрі ол сол заттың қышқылдар (негіздер) класына жатуына тәуелді еместігін көрсетеді.
Усанович теориясы дәстүрлі химиялық реакциялармен қатар кешентүзу процестерін де қамтиды. Ол көптеген жайлардың сырын айқын ашып берді. Мысалы, күрделі эфирлердің қалайы (ІV) мен сүрменің (ІV) галогенидтеріне қосылып, алил катионды бөліп, электролиттік диссоциацияға ұшырауын тек жалпылама теория тұрғысынан түсіндіруге болады. Кейбір аниондар электрон жұптарының доноры бола алмайды және протон қосып ала алмайды, алайда өзінен катиондар бөліп шығарып, күшті негіздік қасиет көрсете алады, олар ВН4 немесе АlН4. Бұл бөлшектер Льюис анықтамасы бойынша негіздерге жатпайды, өйткені бос электрон жұбы жоқ, дәл осылайша Бренетед көзқарасына сай өзіне протон қосып ала алмайтындықтан негіз бола алмайды. Ал өзінен Н-анионын бөле отырып, негіздік функцияға ие болатынын Усанович теориясы ғана дәлелдеп береді. Мұндай кешенді аниондарға сәйкес келетін сутекті қышқылдар бос күйінде кездеспейді, сондықтан оларды Усанович «болмайтын қышқылдар» деп атаған. Усанович теориясы кез келген жай және күрделі заттың, зарядты бөлшектің құрамына сүйеніп, олардың мүмкін болатын хим. қасиеттерін күні бұрын болжап бере алады. Усанович теориясы химияда кеңінен қолданыс тауып келе жатқан жалпылама теория болып саналады.
Оттексіз қышқылдарда сутек қышқыл түзуші элементпен тікелей байланысады: Н-CI Н-S-Н, т. б.
Қышқылдардың химиялық қасиеттері
Қышқылдардың касиеттері алуан түрлі болып келеді, оны көрсету үшін мынадай сұлба жазып аламыз:
Қышқылдар:
белсенді металдармен
негіздік оксидтермен
негіздермен
тұздармен
қыздырудың әсері (кейбір қышқылдар үшін)
Қышқылдардың металдармен әрекеттесуі металдың белсенділігіне қарай жүреді; белсенді металдардың көпшілігі қышқылдардан сутегін ығыстырады:
H 2 SO 4 +Ca=CaSO 4 +H 2 ↑
H 2 SO 4 +Zn=ZnSO 4 +H 2 ↑
белсенді металл + қышқыл = тұз + сутегі
Қышқылдардың негіздік оксидтермен әрекеттесуі нәтижесінде тұз бен су түзіледі:
H 2 SО 4 +CaО=CaSО 4 +H 2 О
2HCl+ZnО=ZnCl 2 +H 2 О
қышқыл + негіздік оксид = тұз + су
Қышқылдар еритін де, ерімейтін де негіздермен әрекеттеседі:
HCl+NaOH=NaCl+H 2 O
2HCl+Cu(OH) 2 ↓=CuCl 2 +2Н 2 O
қышқыл + негіз = тұз + су
Қышқылдар тұздармен алмасу реакциясына түседі
H 2 SО 4 +BaCl 2 =BaSО 4 ↓+2HCl
HCl+AgNО 3 =AgCl↓+HNО 3
2НСl+СаСO 3 =СаСl 2 +Н 2 O+СO 2 ↑
қышқыл + тұз = жаңа тұз + жаңа қышқыл
Кейбір қышқылдар қыздырғанда айырылады
H 2 SiO 3 →SiO 2 +H 2 0
Қолданыл уы
HNO 3 - азотты тыңайткыштар алу үшін
H 2 SO 4 - өте кең қолданыс табады, сондықтан оны химия өндірісінің «наны» деп атайды.
Н 3 РО 4 - фосфор тыңайтқыштарын алу үшін HCl - тұздарын алу үшін, медицинада. [1]
Қышқылд ық
Қышқылдық (орысша: кислотность) - ортаның рН өлшем бірлігінен берілетін сипаттамасы. Бұл өлшем бойынша рН7 мөлшері бейтарап орта саналады, егер ол көрсеткіштен жоғары болса ортаның сілтілік әсері жоғарылайды. РН шкаласы 10-дық логарифм негізінде жасалған сондықтан рН 4 артық рН 5 ортасына қарағанда 10 есе қышқыл, ал рН 6 ортасына қарағанда 100 есе қышқыл болады. [2]


Қышқылдар.
Қышқылдар - құрамында металға алмаса алатын сутектің бір немесе бірнеше атомы бар және суда ерігенде сутек иондарын Н+ түзетін химиялық қосылыстар.
2. 4. Пролиттік тепе - теңдік. Қанның буферлік жүйесі
Аррениустың электролиттік диссоциация ториясы түсіндіре алмаған мәселелерді Дания ғалымы Дж. Бренстед пен ағылшын химигі Т. Лоури ұсынған қышқылдар мен негіздердің протолиттік теориясы түіндіре алды. Бұл теория Бренстед- Лоуритеориясы деп аталды. Бұл теория қышқылдар мен негіздерді, заттардың протонға қандай байланысы бар екендігін анықтайды.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz