Ерітінділер мен буферлік жүйелер: құрамы, қасиеттері және физиологиялық маңызы


Тірі ағзадағы ерітінділердің маңызы. Буферлі ерітінділер.
Құрамы тұрақсыз, біртекті жүйе жүйе ерітінді деп аталады. Кез келген сұйық ерітінді еритін заттан, еріткіштен және солардың әрекеттесуі нәтижесінде пайда болған бөлшектерден тұрады. Ерітінділер - кем дегенде екі құрамдас бөліктерден тұратын құрамы өзгермелі гомогенді (біртекті) жүйелер.
Ерітінділер газ тәрізді, сұйық жәнеқатты болуы мүмкін. Олардың ішінде жан-жақты зерттелгені және жиі қолданылатыны сұйық, әсіресе, сулы ерітінділер. Сондықтан тұрмыста ерітінділер деп, көбінесе, сұйық күйдегі молекула-дисперстік жүйелерді айтады. Ерітінділердің құрамы құрамдас бөліктердің конценрацияларымен сипатталады. Ерітінділер қаныққан, қанықпаған және аса қаныққан деп бөлінеді. Берілген температурада жақсы еритін заттардың ерігіштігінің де шегі бар. Еріген заттың концентрациясы белгілі бір мөлшерден асқанда, оның артығы ерімей, ерітіндінің түбіне шөгеді. Бұл кезде ерітінді мен еріген зат тепе-теңдік жағдайда болады. Мұндай ерітінділерді қаныққан ерітінділер, ал концентрациялары қаныққан ерітіндінің концентрациясына дейінгі барлық ерітінділерді қанықпаған ерітінділер деп атайды. Кейбір еріткіштің белгілі бір мөлшерінде еритін заттың ерігіштігіне сәйкес мөлшерінен де артық мөлшерін ерітуге болады. Мұндай ерітінділер аса қаныққан ерітінділер деп аталады. Аса қаныққан ерітінділердің тұрақтылығы нашар болады. Кез келген сыртқы әсерден еріген заттың артық мөлшері ерітіндіден бөлініп, тұнбаға түседі. Сөйтіп аса қаныққан ерітінді жай қаныққан ерітіндіге айналады. Кей заттар ерігенде олардың молекулалары иондарға ыдырайды, яғнидиссоциацияланады. Электр тогын өткізетін болғандықтан, ондай заттардың ерітінділерін электролит ерітінділері деп атайды. Оған көптеген қышқылдар мен негіздердің, әсіресе, тұздардың ерітінділері жатады. Керісінше, ерігенде молекулалары иондарға ыдырамайтын, сондықтан электр тогын өткізбейтін заттардың ерітінділері бейэлектролиттердің ерітінділері деп аталады. Полимерлердің ерітінділері ерітінділердің үлкен тобын құрайды. Ерітінділердің бетіндегі бу қысымы және оның қату температурасы таза еріткіштікке қарағанда төмендеу, ал қайнау температурасы жоғарылау болады. Сонымен қатар ерітінділерде осмос қысымы байқалады.
Ерітінділердің бұл қасиеттерінің барлығы тек еріген заттың молекулалар санына ғана тәуелді. Олардың өзгерістері Вант-Гофф және Рауль заңдарымен сипатталады. Мысалы, ацетонның, кез келген эфирдің немесе спирттің
судағы концентрациялары бірдей ерітінділерінің осмос және бу қысымдарының салыстырмалы төмендеулері, қату температураларының төмендеуі, ал қайнау температураларының жоғарылауы бірдей болады. Бұдан кейбір ғалымдар ерітінді түзілгенде еріткіш пен еріген зат арасында ешқандай әрекеттесулер болмайды, олар тек араласады деген қорытындыға келген. Сондықтан бұл қасиеттер ерітінділердің физикалық теориясына тәжірибелік негіз болған. Идеал газдар сияқты молекулаларының арасында ешқандай әсерлесулер болмайтын, дәлірек айтқанда, мейлінше аз болатын ерітінділер идеал ерітінділер, ал қалғандарын реал ерітінділер деп атайды. Күшті электролиттердің ерітінділерінің кейбір қасиеттері сұйылтылған ерітінділердің қасиеттерін сипаттайтын заңдылықтарға бағынбайды. Олардың біраз қасиеттері Дебай мен Гюккельдің “күшті электролиттер теориясымен” сипатталады. Сонымен қатар ерітінділер түзілгенде жылу бөлінуі, жүйе түсінің құрамдас ебөліктер түсінен өзгешелігі және ерітінділер көлемінің құрамдас бөліктер көлемінің қосындысына қарағанда кемуі еріген зат пен еріткіш арасында химиялық әрекеттесулер болатынын көрсетеді. Кейде олардың арасындағы байланыстың беріктігі соншалық, ерітінділерді суытқанда еріткіштің біраз мөлшері еріген затпен бірге кристалданады. Оларды жалпы сольваттар, ал еріткіш су болғанда кристаллогидраттар деп атайды. Бұл қасиеттер ерітінділердің химиялық теориясына тәжірибелік негіз болды.
Агрегаттық күйіне байланысты ерітінділер: сұйық, қатты және газ тәріздес болып жіктеледі. Сұйық ерітінділерге теңіздер мен мұхиттардың суларын (тіпті құбыр суын), көптеген техникалық ерітінділерді, дәрілік заттар, мұнайдың әртүрлі фракциялары жатады. Қатты ерітінділердің мысалы ретінде металдардың құймасын, табиғи минералдарды қарастыруға болады.
Газ тәріздес ерітінділерге ауаны, карбогенді (медицинада қолданылатын СО2 және О2 қоспасы) жатқызуға болады.
Егер ерітінді екі сұйықтан түзілсе, олардың мөлшері артығы еріткіштің ролін атқарады. Егер ерітінді сұйықта еріген қатты зат пен газдан пайда болса, агрегаттық күйі өзгермейтін компонент еріткіш болады.
Еріген зат және еріткіш деген түсініктер қатты ерітінділер мен газ қоспаларына қолданылмайды.
Еріген зат бөлшектерінің мөлшеріне байланысты ертінділер нақты (бөлшектердің мөлшері <1ммк) және коллойдтық (бөлшектердің мөлшері 1-100 ммк) болып бөлінеді. Егер бөлшнетедің мөлшері 100ммк-нан үлкен болса суспензиялар мен эмульсиялар пайда болады.
Нақты ерітінділер иондық (электролиттердің ертінділері) және молекулалық (электролитеместердің ерітінділері) болып жіктеледі.
Барлық нақты ерітінділер гомогенді болып келеді, олардағы еріген зат пен ерткіштің арасында бөліну беткейі болмайды.
Коллойдтық ертінділер гетерогенді, еріген зат (дисперстік фаза) пен ерткіштің (дисперсиялық орта) арасында фазалық бөліну беткейі болады.
ЖМҚ (жоғары молекулалық қосылыстар), белоктар, полисахаридтердің ерітінділері нақты ертінділердің де, коллойдтық ертінділердің де қасиетін көрсетеді.
Дәрігерлер үшін маңызды болып сұйық ертінділер есептеледі, себебі қан плазмасы, лимфа, несеп және белоктар, липидтер, көмірсулар, тұздардың күрделі қоспасы болып табылатын биологиялық сұйықтар осындай ерітінділерге жатады.
Ертінділердің маңызды сипаттамасына концентрация жатады. Ертіндінің немесе еріткіштің белгілі бір мөлшеріндегі еріген заттың нақты мөлшері концентрация деп аталады.
Концентрацияны бейнелеудің бірнеше нақты түрі бар.
Массалық үлес, W; % - 100г ерітіндідегі еріген заттың массасын көрсетеді:
Мольдік концентрация, См, моль/л - 1л ертіндідегі еріген заттың мөлшерін көрсетеді:
Эквиваленттің мольдік концентрациясы немесе нормальді концентрация, Сн, моль/л - 1л ертіндідегі еріген заттың эквивалент мөлшерін көрсетеді:
Молальдық концентрация, См, моль/кг - ерткіштегі еріген заттың мөлшерін көрсетеді:
Буферлік жүйелер мен ерітінділер туралы түсініктер, олардың құрамы және жіктелуі
Буферлік ерітінділер - сутек иондарының концентрациясын белгілі бір дәрежеде ұстайтын ерітінділер. Олар негізінен әлсіз қышқылдар немесе негіздер және олардың тұздарының қоспасынан тұрады, сұйылтқанда, концентрлегенде, күшті қышқыл немесе негіздің аз мөлшерін қосқанда өзінің сутектік көрсеткішінің (рН) мәнін болымсыз өзгертеді. Мысалы: ацетаттықБуферлік ерітінділернің (СН3СООН+ +СН3СООNa қоспасының) pH-ы 4, 7, лимондық Буферлік ерітінділернің (С6Н6О7Na2 ерітіндісі) pH-ы 5, 0, фосфаттық Буферлік ерітінділернің (Na2Н2РО4+ +NaОН қоспасының ерітіндісі) pH-ы 11, 5. Буферлік ерітінділер аналитикалық химияда, биохимиялық және физиологиялық зерттеулерде кеңінен қолданылады. Буферлік ерітінділер тірі организмдерде үлкен рөл атқарады (мысалы, қанның, лимфалардың, клеткааралық сұйықтардың pH тұрақтылығы) . Олардың бикарбонаттық, фосфаттық, белоктық(белоктар әлсіз қышқылдық әрі негіздік қасиет көрсетеді) табиғаты бар.
Сұйылтқанда немесе қышқыл не сілті қосқанда рН-ы өзгермейтін ерітінділер буферлік жүйелер деп аталады. Буферлік жүйенің құрамында протонның доноры және протонның акцепторы болады. Құрамына байланысты буферлік жүйелер қышқылдық, негіздік және амфолиттік болып бөлінеді.
Қышқылдық буферлік жүйе донор болып есептелетін әлсіз қышқылдан және акцепторлардын рөлін атқаратын анионы бар осы қышқылдың тұзынан тұрады. Мысалы, ацетатты, бикорбанатты буферлік жүйелер.
ацетатты :
CH3COOH - протонның доноры
CH3COONa CH3COO
 - протонның акцепторы
- протонның акцепторы
бикарбонатты :
Н2СО3 - протонның доноры
NaHCO3 HCO3
 - протонның акцепторы
- протонның акцепторы
Негіздік буферлік жүйе әлсіз негізден (акцептор) және осы негіздің катионы (донор) бар тұздан тұрады. Мысалы:
NH4OH - протонның акцепторы
NH4CI NH4+ - протонның доноры
Амфолиттік буферлік жүйе әр донордың, әрі акцептордың рөлін атқаратын амфотерлік қосылыстан тұрады. Мысалы, белок буферлік жүйесі:
СООН COO-протонның акцепторы
R - CH
 R - CH
R - CH
NH2 NH3+ -протонның доноры
Буферлік жүйелердің рН-ын есептеу формулалары
Буферлік ерітінділердің рН-ы Гендерсон-Гассельбах теңдеуі бойынша анықталады. Қышқылдық буферлік ерітінділермен негіздік буферлік ерітінділердің рН-ын есептеу үшін әртүрлі теңдеулер қолданылады.
Қышқылдық буферлік ерітінділер үшін мына теңдеу қолданылады :
[тұз] [қышқыл]
рН = рК к-л + Ig нем есе рН = рКқ л Ig
[қышқыл] [тұз]
Негіздік буферлік ерітінділер үшін мына теңдеу қолданылады :
[негіз]
рН = 14 - рКн-з + Ig
[тұз]
Бұл теңдеу бойынша буферлік жүйелердің рН-ы қышқылдық немесе сілтінің диссоциациялану константасына және буферлік жүйенің құрамындағы компоненттердің қатынасына тәуелді. Сондыктан да белгілі бір буферлік жүйені дайындау үшін константалары сәйкес келетін қышқыл немесе негіз алу керек, сол сияқты компоненттердің қатынасы да есепке алынуы қажет.
Сұйытылу кезінде буферлік жүйелердің рН-ын сақтауы аса маңызды құбылыс, себебі биологиялық сұйықтарды пайдалану үшін оларды қатты сұйытылуға тура келеді. Сұйытылудың буферлік жүйелердің рН-ына әсері шамалы екендігі тәжірибе жүзінде анықталған. РН-ы компоненттердің концентрациясы емес, қатынасына тәуелді жүйелерді сұйылтқанда компоненттердің концентрациясы бірдей дәрежеде төмендейді, сондықтан олардың қатынасы және рН-ы өзгермейді. Мысалы:
[Н+] = К
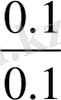 =К
=К
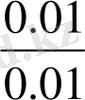 =К
=К
Буферлік ерітінділердің әсер ету механизмі
Күшті қышқыл немесе сілті қосқанда буферлік жүйелердегі сутегі иондары концентрациясының өзгермеуі олардың негізгі қасиеті болып табылады. Күшті қышқыл қосқанда сутегі иондары буферлік жүйедегі протонның акцепторымен әрекеттеседі, соның нәтижесінде сутегі иондарының концентрациясы өзгермейді. Сілті қосқанда гидроксид-иондар буферлік жүйедегі протонның донорымен әрекеттеседі, сол себепті рН өзгермейді. Мысалы, негіздік буферлік жүйедегі бұл процесс былай жүреді :
а) NH4OH
NH4CI + HCI
NH4OH + HCI = NH4CI + H2O
NH4OH + H+ + CI- = NH4+ + CI- + H2O
NH4OH + H+ = NH4+ + H2O
ә) NH4OH
NH4CI + NaOH
NH4CI + NaOH = NH4OH + NaCI
NH4+ + CI- + Na+ + OH- = NH4OH + Na+ + CI-
NH4+ + OH- = NH4OH
Қышқылдық буферлік жүйелердегі қорғаныс процесін былай көрсетуге болады, мысалы :
а) CH3COOH
CH3COONa + HCI
СН3СООNa + HCI = CH3COOH + NaCI
CH3COO- + Na+ + H+ + CI- = CH3COOH + Na+ + CI-
CH3COO- + H+ = CH3COOH
Буферлік жүйе күшті қышқылды әлсіз қышқылға айналдырады, сол себепті рН онша өзгермейді.
ә) CH3COOH
CH3COOH + NaOH
СH3COOH + NaOH = CH3COONa + H2O
CH3COOH + Na+ + OH- = CH3COO- + Na+ + H2O
CH3COOH + OH- = CH3COO- + H2O
Буферлік жүйе ОН -ионды суға айналдырады, сол себепті рН өзгермейді. Осылайша, кез келген буферлік жүйеге күшті қышқыл қосқанда буфыерлік ерітіндідегі протонның акцепторы, ал сілті қосқанда протонның доноры буферлік жуйені қорғайды.
Организмнің буферлік жүйелері.
Организмнің қалыпты жұмыс жасауы үшін оның ішкі ортасының тұрақтылығының маңызы зор. Ғылыми тілмен айтқанда оны - гомеостаз деп атайды. Ағзаның физиологиялық функцияларының бекемдігін, тұрақтылығын көрсететін, оның ішкі құрылысының құрамы мен қасиеттерінің салыстырмалы динамикалық тұрақтылығы гомеостаз деп аталады.
Гомеостаздың негізгі көрсеткіштерінің бірі - сутегі ( Н+) және гидроксил (ОН-) иондарының қатынасымен анықталатын химиялық ортаның реакциясы болып табылады. Ол қалыпты жағдайда қанда әлсіз сілтілік ( рН= 7. 4) орта болады, ал оның сәл ғана қышқылдық жаққа ығысуы барлық жүйенің қайтымсыз өзгерісіне ұшыратуы мүмкін. Сондада болса, ұлпалардан үнемі зат алмасу процесінің нәтижесінде түзілетін өнімдер, әсіресе СО2 қанға түсіп отырады. Шетел ғалымдары: З. Андерсон және П. Аструптың зерттеулері бойынша 3 секунд ішінде организмде өмір сүруге сәйкес келметін қышқыл мөлшері көбейіп кетуі мүмкін. Соған қарамастан қанның рН өзгермейді.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz