Аналитикалық химия (1-2 бөлім): аналитикалық реакциялар, қышқыл-негіз және тотығу-тотықсыздану әдістері, титриметрия мен гравиметрия


«Аналитикалық химия. 1-2 бөлімдер», Химия-5В060600, 2017 ж.
- Аналитикалық реакция: түрлері, негізгі сипаттамалары, оларды жүргізу жағдайлары мен тәсілдері.
- Әр түрлі тотығу дәрежесіндегі хром қосылыстарының қышқыл-негіздік және тотығу-тотықсыздану қасиеттерінің салыстырмалы сипаттамасы.
- Әр түрлі тотығу дәрежесіндегі марганец қосылыстарының қышқыл-негіздік және тотығу-тотықсыздану қасиеттерінің салыстырмалы сипаттамасы.
- Әр түрлі тотығу дәрежесіндегі темір қосылыстарының қышқыл-негіздік және тотығу-тотықсыздану қасиеттерінің салыстырмалы сипаттамасы.
- Қышқылдар мен негіздердің протолиттік теориясы. Иондану константалары. Қышқылдар мен негіздер күшіне еріткіштер табиғатының әсері.
- Қышқылдардың, негіздердің, амфолиттердің қышқылдығын анықтайтын факторлар.
- Әлсіз электролиттер түзетін тұздардың және буферлі қоспалардың қышқылдығын анықтайтын факторлар.
- Әлсіз қышқылдар мен олардың тұздары аниондарының концентрациясының ерітінді рН-на тәуелділігі. Материалдық баланс теңдеулерін құру.
- Ерітіндідегі комплекстүзілу процестерінің тепе-теңдіктері. Тепе-теңдік константалары.
- Тотығу-тотықсыздану потенциалы, оның шамасына әсер ететін факторлар.
- Тотығу-тотықсыздану тепе-теңдігінің константасы. Қорыту және есептеу.
- Гетерогенді тепе-теңдік. Тұнбаның ерігіштік көбейтіндісі және ерігіштігі.
- Иондарды бөлу және концентрлеу әдістері: тұндыру және қосатұндыру.
- Иондарды бөлу және концентрлеу әдістері: экстракция.
- Иондарды бөлу және концентрлеу әдістері: ионалмасу хроматографиясы.
- Талдауда ерітінділердің концентрациясын өрнектеу тәсілдері, олардың өзара байланысы.
- Титриметрлік талдаулар нәтижелерін есептеу. Ерітінділерді даярлау және сұйылту кезіндегі есептеулер.
- Талдаудағы қателердің түрлері, оларды анықтау және жою. Талдау нәтижелерін статистикалық өңдеу.
- Гравиметрия. Тұнбаның құрылымын реттеу тәсілдері. Аморфты және кристалды тұнбаларды алу.
- Гравиметрлік талдауда компоненттерді таңдауға қойылатын талаптар (аналитикалық үлгі, тұндырғыш, тұндырылған және гравиметриялық формалар) .
- Гравиметриядағы тұнбалардың ластану түрлері. Оларды жою тәсілдері.
- Титриметриядағы стандартты ерітінділердің түрлері және оларды даярлау тәсілдері.
- Титриметриядағы индикаторлардың түрлері, оларға қойылатын талаптар, оларды титрлеуге таңдау негіздері.
- Бірнегізді күшті қышқылды (негіз) күшті негізбен (қышқылмен) титрлеудің қисығын есептеу және талдау.
- Бірнегізді әлсіз қышқылды (негіз) күшті негізбен (қышқылмен) титрлеудің қисығын есептеу және талдау.
- Комплексонометрлік титрлеу қисықтарын есептеу және талдау.
- Тотығу-тотықсыздану титрлеу қисықтарын есептеу және талдау.
- Аналитикалық реакция: түрлері, негізгі сипаттамалары, оларды жүргізу жағдайлары мен тәсілдері.
Зерттелетін заттардың ерітінділері, әр түрлі иондардың қатысында, күрделі қоспа түрінде болады. Оларды ашу үшін сыртқы белгілері өзгере жүретін химиялық реакцияларды, мысалы, ерітіндінің түсі өзгеретін, тұнба еритін немесе тұнба түсетін, газ бөлінетін реакцияларды аналитикалық реакциялар деп атайды.
Қарастырылатын отырған жүйеге әсер етіп, оның құрамын анықтауға пайдаланатын зат реагент немесе реактив деп атайды.
Анықталатын зат пен химиялық реагент арасында аналтикалық белгімен анықталатын реакция аналитикалық реакция деп аталады.
Белгілі жағдайда аналитикалық сигнал бере алатын иондар санына байланысты аналитикалық реакциялар мен реагенттерді ортақ ерекше және талғағыш деп бөледі.
Бір реагент бірнеше иондармен қатар әрекеттесетін болса, ортақ реакциялар деп атайды. Бірнеше иондармен бірдей қатар әрекеттесіп, сол иондарға тән сипат беретін реактив немесе топтық реактив деп аталады. Мысалы, екі- үш валенттік танытатын көптеген металл иондары аммоний сульфидімен әрекеттесу барысында тұнба түзіледі. Демек, аммоний сульфидімен келтірілген иондар үшін ортақ реагент болып табылады.
Сол сияқты Zn 2+ , Cu 2+ , Cd 2+ иондары сілтімен, күкіртті сутекпен, карбонат иондарымен әрекеттесіп бәріде тұнба береді. Демек аталған реакциялар ортақ реакциялар қатарына жатады. Ал, осы иондардың ішінде тек мырыш ионының диметилглиоксим реагентімен әрекеттесуі ерекше сипатқа ие болады. Реакция мырыш ионына ғана тән болғандықтан диметилглиоксим ерекше реагент, ал реакция - ерекше реакция деп аталады.
Егер диметилглиоксим (Чугаев реактиві) көп иондардың ішінен тек Ni 2+ , Zn 2+ , Pd 2+ иондарымен ғана ерекшеленген реакцияға түсетін болса, онда реактивті де реакцияныда селективті талғағыш деп атайды.
Аналитикалық реакциялар алдына қойған мақсатына қарай бөлу және анықтау болып, екіге бөлінеді.
Бөлу реакцияларына қойылатын шарт - белгілі бір анықталатын компанентті бөгде қоспалардың толық бөліп алу, яғни ерітіндіде қалған компаненттердің мөлшері аналитикалық сигнал бермеуі тиіс.
Анықтау реакциялары нәтижесінде химиялық реагент анықталатын компанентпен әрекеттесуі қажет.
Реакцияның табиғатына қарай :
- қышқылдық - негіздік
- тұнба түзу
- Тотығу тотықсыздану
- Комплекс түзу болып төртке бөлінеді.
Бейорганикалық заттар құрамын көп жағдайда ерітіндіде анықтайтандықтан, әрбір ионның өзіне тән сапалық реакциялары болады.
Аналитикалық реакциялар орындалу жолдарыа байланысты екі тәсілмен
- құрғақ жол
- Ылғалды жолмен жүзеге асырылады.
Қатты немесе сұйық сынаманы жанарғы жалынына орналастыру, сынаманы басқа құрғақ затпен араластырып үгу және т. б. құрғақ реакцияларға жатады. Талдауды «құрғақ жолмен» орындауды көбінесе кристалл заттармен жүргізеді, ол тек алғашқы мәлімет алу үшін ғана қолданылады.
Талдауды «құрғақ жолмен» орындаудың бірнеше түрлері бар:
- Пиротехникалық әдісталданатын затты жоғары температурада қыздыру жалынның түсінің боялуы. Оған кейбір металлдардың тұздары әсерінен от жалынының әр түрлі түске боялуы жатады. Мысалы, натрий сары түске, калий күлгін.
- Ұнтақталу әдісіталданатын затты реагентпен бірге келіге салып үгуге негізделген. Реакция нәтижесінде түсті қосылыс түзіледі. Мысалы кобальт хлоридімен қосып үккенде көк түс пайда болады.
Ылғалды жолмен . Еріткіштер ретінде дистелденген су, қышқыл ерітінділері, сұйықтық патшасы, сілті ерітінділері және т. б пайдаланылады
2. Әр түрлі тотығу дәрежесіндегі хром қосылыстарының қышқыл-негіздік және тотығу-тотықсыздану қасиеттерінің салыстырмалы сипаттамасы.
Cr 3+ ионының ашылуы
1. Натрий (калий) гидроксиді Cr 3+ ионымен күлгін-сұр немесе жасыл-сұр түстегі Cr(OН) 3 тұнбасын береді, түзілген тұнбаның амфотерлік қасиеті бар.
Реакцияның орындалуы. Құрамында хромы бар ерітіндінің 2-3 тамшысына ақырындап тамшылата 2М натрий гидроксидін Cr(OН) 3 ↓ тұнбасы түзілгенше қосамыз. Сілтінің артық мөлшерінде ерітіндінің түсі ашық-жасыл түске ауысады.
2. Cr 3+ катионының H 2 O 2 ерітіндісімен тотығу реакциясы
2[Cr(OH) 6 ] 3- + 3H 2 O 2 = 2CrO 4 2- + 2OH - + 8H 2 O
Реакцияның орындалуы. Пробиркадағы 2-3 тамшы хромның (III) ерітіндісіне 3-4 тамшы 2М NaOH және 2-3 тамшы 3%-тік Н 2 О 2 ерітіндісін қосып, ерітіндінің түсі жасылдан ([Cr(H 2 О) 6 ] 3+ (аквакомплекс түсі) сарыға ауысқанша қыздырамыз (CrO 4 2- хромат-ионының түсі) .
3. Надхром қышқылының түзілу реакциясы. Хромат-иондарынан надхром қышқылын алу үшін орта қышқылды және ерітінді салқын жерде алыну керек.
2CrO 4 2- + 3H 2 O 2 + 2H + = H 2 CrO 4 + 2H 2 O
Реацияның орындалуы. 2-3 тамшы K 2 CrO 4 ерітіндісіне 5 тамшы сутек асқын тотығын, 4-5 тамшы амил спиртін қосып, мұқият араластырып және тамшылата H 2 SO 4 қосамыз. Органикалық қабат көк түске боялады.
Титрлеудің тотығу-тотықсыздану әдісі тотығу-тотықсыздану реакцияларын пайдалануға негізделген. Тотығу-тотықсыздану әдісінде стандартты титрленген ерітінділер ретінде әртүрлі тотықтырғыштардың және ерітінділері қолданылады. Белгілі он мыңдаған тотығу-тотықсыздану реакцияларының ішінде титримериялық әдісте тек жылдам, аяғына шейін, қосымша реакцияға қатыспай, белгілі стехиометриялық жолмен жүретін және құрамы белгілі қосылыстар түзетін реакциялар ғана пайдаланылады.
Бихроматометрия әдісінің негізі - қышқылдық ортада бихромат - анионының тотықсыздану реакциясы: Сr 2 О 7 2- + 14Н + + 6е → 2Сr 3+ + 7Н 2 О,
f экв. ( Сr 2 О 7 2- ) = 1/6, Е 0 Сr 2 О 7 2- /2Сr 3+ = 1, 33В.
К 2 Сr 2 О 7 тұзының таза кристалды препаратын жеңіл алуға болады. Ол ауада сақтағанда тұрақты, сондықтан бихроматтың стандартты ерітіндісін К 2 Сr 2 О 7 тұзының дәл нақты мөлшерін алып дайындауға болады.
Темір (II) бихроматпен тұзқышқылды ортада ешқандай шиеленіссіз титрленеді. Реактивтің бір кемшілігі - реакцияның нәтижесінде эквивалентті нүктені анықтауды қиындататын жасыл түске боялған Сr 3+ иондарының түзілуі. Бұл әдісте индикатор ретінде дифенилсульфон қышқылы, фенилантронил қышқылы, фосфор қышқылы қатысында дифениламин қолданылады.
Бихроматометрияның ең маңызды тәжірбиелік пайдаланылуы - әртүрлі үлгілердегі темірді анықтау. Алдан ала темір (III) иондарын (II) иондарына дейін жоғарыда келтірілген әдістердің бірін пайдаланып тотықсыздандырады.
кері титрлеу жолымен анықтайды. Мысалы, болаттардағы хромды Сr 2 О 7 2- -ионына дейін тотықтырады, содан кейін Мор тұзының Fe(NH 4 ) 2 (SO 4 ) 2 ⋅6Н 2 О титрленген ерітіндісінің артық мөлшерін қосады. Реакцияласпай қалған темір (II) - иондарын бихроматпен титрлейді.
3. Әр түрлі тотығу дәрежесіндегі марганец қосылыстарының қышқыл-негіздік және тотығу-тотықсыздану қасиеттерінің салыстырмалы сипаттамасы.
Титрлеудің тотығу-тотықсыздану әдісі тотығу-тотықсыздану реакцияларын пайдалануға негізделген. Тотығу-тотықсыздану әдісінде стандартты титрленген ерітінділер ретінде әртүрлі тотықтырғыштардың және ерітінділері қолданылады. Белгілі он мыңдаған тотығу-тотықсыздану реакцияларының ішінде титримериялық әдісте тек жылдам, аяғына шейін, қосымша реакцияға қатыспай, белгілі стехиометриялық жолмен жүретін және құрамы белгілі қосылыстар түзетін реакциялар ғана пайдаланылады.
5 Cr 2 O 4 2- + 2 МnO 4 - + 16Н + = 2Мn 2+ + 4H 2 O + 10СО 2
реакциясы өте баяу жүреді. Системада Мn 2+ ионының белгілі мөлшері пайда болғанда реакцияның жылдамдығы артады, себебі Мn 2+ ионы МnO 4 - -пен әрекеттесіп аралық Мn 3+ және МnO 2+ иондарын түзеді, ал бұл иондар оксалат анионын тотықтырады.
Мn 2+ + МnO 4 - → МnO 2+ + МnO 3 -
Мn 2+ + МnO 3 - → МnO 2+ + МnO 2 - МnO 2 - +4Н + → Мn 3+ + 2H 2 O
Пайда болған аралық бөлшектер оксалат анионымен әрекеттесіп:
МnO 2+ + Cr 2 O 4 2- → Мn 2+ + СО 2 ; Мn 3+ + Cr 2 O 4 2- → Мn 2+ + СО 2
реакцияны жылдамдатады.
Реакция нәтижесінде пайда болатын химиялық активті, косымша реакцияларға қатыса алатын, аралық қосылыстар анализді күрделендіреді. Мысал ретінде темірді перманганатометриялық жолмен анықтауды қарастыруға болады.
5 Fe 2+ + МnO 4 - + 8Н + → 5Fe 3+ + Мn 2+ + 4H 2 O
Бұл реакцияны тұз қышқылы қатысында жүргізгенде пермаганаттың шығыны күкірт қышқылды ортада жүргізгеннен көп болады. Оның себебі перманганаттың бір белгілі хлор-ионын тотықтыруға жұмсалады:
2MnO 4 - + 10Cl - +16H + → 2Мn 2+ +5Cl 2 + 8H 2 O
Ерітіндіде темір (II) болмағанда бұл реакция жүрмейді.
Темір (II) мен перманганат әрекеттескенде марганецтің тұрақсыз аралық тотығу дәрежесі бар иондары пайда болады: Mn(VI), Mn(IV), Mn(III) . Бұл химиялық активті бөлшектер темір (II) иондарымен қатар хлор-иондарымен де бос хлор (CI) түзіп әрекеттеседі. Пайда болған (CI) газ түрінде ерітіндіден ұшып кетеді, сондықтан тұз қышқылды ортада реакцияға перманганаттың артық мөлшері жұмсалады. Ерітіндіде Mn (III) -пен тұрақты комлекс түзетін сульфат-, фосфат-иондары жүрсе, Mn(III) /Mn(II) жұбының потенциалы Mn(III) пен хлор-иондарының арасында реация жүрмейтін мәнге дейін кемиді, бірақ бұл мән
 Fe(II) - ні Fe(III) -ке дейін тотықтыруға жеткілікті. Индуцирленген реакция Mn(II) иондары көп мөлшерде жүрсе де басылады.
Fe(II) - ні Fe(III) -ке дейін тотықтыруға жеткілікті. Индуцирленген реакция Mn(II) иондары көп мөлшерде жүрсе де басылады.
Сондықтан Fe(2) иондарын фосфор қышқыл, күкірт қышқыл, марганец сульфаты қоспаларының қатысында перманганатпен титрлесе хлор-ионының қатарласып тотығу реакциясы жүрмейді және титрлеу дұрыс нәтиже береді.
Күрделі тотығу-тотықсыздану системасын алсақ, мысалы:
5
+
+8
 5
+
4Н
2
О
5
+
4Н
2
О
= Е 0 +0, 058lg[ ] [ ]
=E 0 +0. 058/5lg[ ] [ ] =E 0 - 0. 058/5⋅8pH+0. 058/5⋅lg[ ] =E 0 1 +0. 058/5⋅
lg ; E 0 1 = E 0 -0. 058/5⋅8pH.
Екінші теңдікте бір электронға келтірсек:
5 =5 +0, 058lg ; 6Е= +5 +0, 058lg[ ] [ ] [ ]
6Е= +5 , Е= +5 /6,
не жалпы түрінде Е=n 1 * +n 2 * ∕n 1 +n 2
Эквивалентті нүктеден кейін ерітіндіде титранттың тотығу-тотықсыздану жұбы пайда болады Се 4+ /Се 3+ , системаның потенциалы осы жұптың потенциалымен анықталады:
Е =Е 0 +0, 058 lg*
Бұл жұптың тотықсызданған түрінің концентрациясы өзгермей, ал тотыққан түрінің концентрациясы титранттың көлемі артқан сайын өседі. Ерітіндіге титранттың 26, 0 мл құйдық дейік: =25, 00мл*0, 100; = -
=26, 00*0, 10-25, 00*0, 10 =1, 00*0, 100
Табылған мәндерді /9, 38/ теңдікке қойсақ:
Е=1, 44+0, 058 lg1, 00*0, 100/25, 00*0, 100 =1, 44+0, 058 lg1, 00/25, 00=1, 36 В.
4. Әр түрлі тотығу дәрежесіндегі темір қосылыстарының қышқыл-негіздік және тотығу-тотықсыздану қасиеттерінің салыстырмалы сипаттамасы.
Титрлеудің тотығу-тотықсыздану әдісі тотығу-тотықсыздану реакцияларын пайдалануға негізделген. Тотығу-тотықсыздану әдісінде стандартты титрленген ерітінділер ретінде әртүрлі тотықтырғыштардың және ерітінділері қолданылады. Белгілі он мыңдаған тотығу-тотықсыздану реакцияларының ішінде титримериялық әдісте тек жылдам, аяғына шейін, қосымша реакцияға қатыспай, белгілі стехиометриялық жолмен жүретін және құрамы белгілі қосылыстар түзетін реакциялар ғана пайдаланылады.
25, 00 мл 0, 100N FeSO 4 ерітіндісін 0. 100N Ce(SO 4 ) 2 ертіндісімен титрлеуін қарастырайық. Тотығу-тотықсыздану титрлеуінде титрлеу қисығының алғашқы нүктесін есептемейді, оның себебі ерітіндіде анықтайтын заттың бірақ түрі жүреді (Fe 2+ ), ал екінші түрінің концентрациясы өте аз және белгісіз. Сондықтан потенциалды титрантты құйғаннан кейін ғана есептей бастайды.
Титрлегенде жүретін реакция: Fe 2+ +Ce 4+ → Fe 3+ +Ce 3+
Эквивалентті нүктеге дейін системаның потенциалы титрлейтін заттың жұбының Fe 3+ / Fe 2+ потенциалымен анықталады: E=E 0 +0. 058/n*lg[ ] [ ]
Ерітіндіге титранттың 1, 00 мл құйсақ нәтижесінде (нормальдықтары тең болғандықтан) сонша мл Fe 3+ пайда болады:
[ = =1, 00 мл ⋅ 0, 100N;
[ ] = - =25, 00⋅0, 100-1, 00⋅0, 10 = 24, 00⋅0, 100; [ ] [ ] =1, 0/24, 0;
Е= 0, 77+0, 058⋅lg1, 0/24, 0=0, 69В.
Титрлеу нәтижесі 9, 9 таблицада келтірілген.
Эквивалентті нүктеде системаның потенциалы ерітіндіде жүрген екі тотығу-тотықсыздану жұбының потенциалымен анықталады: Fe 3+ / Fe 2+ және Се 4+ /Се 3+ . Сондықтан бұл потенциал екі жұптың потенциалдарының қосындысына сәйкес болады:
+ + = +0, 058lg⋅ [ ] [ ] + +0, 058lg⋅ = + +0, 058lg ⋅[ ] [ ] ⋅
Титрлеудің кез-келген нүктесінде [ ] =[ ], ал эквивалентті нүктеде [ ] =
Осыдан:
[
]
[
]
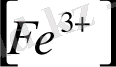 =1, 2Е=
+
себебі lg1=0
=1, 2Е=
+
себебі lg1=0
Е= + =0, 77+1, 44/2=1, 105B
Күрделі тотығу-тотықсыздану системасын алсақ, мысалы:
5
+
+8
 5
+
4Н
2
О
5
+
4Н
2
О
= Е 0 +0, 058lg[ ] [ ]
=E 0 +0. 058/5lg[ ] [ ] =E 0 -0. 058/5⋅8pH+0. 058/5⋅lg[ ] =E 0 1 +0. 058/5⋅ lg ;
E 0 1 = E 0 -0. 058/5⋅8pH.
Екінші теңдікте бір электронға келтірсек:
5 =5 +0, 058lg ; 6Е= +5 +0, 058lg[ ] [ ] [ ]
6Е= +5 , Е= +5 /6, не жалпы түрінде Е=n 1 * +n 2 * ∕n 1 +n 2
Эквивалентті нүктеден кейін ерітіндіде титранттың тотығу-тотықсыздану жұбы пайда болады Се 4+ /Се 3+ , системаның потенциалы осы жұптың потенциалымен анықталады:
Е =Е 0 +0, 058 lg
Бұл жұптың тотықсызданған түрінің концентрациясы өзгермей, ал тотыққан түрінің концентрациясы титранттың көлемі артқан сайын өседі. Ерітіндіге титранттың 26, 0 мл құйдық дейік: =25, 00мл*0, 100; = + - =26, 00*0, 10-25, 00*0, 10=1, 00*0, 100
Табылған мәндерді /9, 38/ теңдікке қойсақ:
Е =1, 44+0, 058 lg1, 00*0, 100/25, 00*0, 100 =1, 44+0, 058 lg1, 00/25, 00=1, 36 В.
2 Fe 3+ + Sn 2+ ↔︎2 Fe 2+ + Sn 4+
Бұл реакцияның жартылай тотығу реакциясы
Sn 2+ - 2е → Sn 4+ , не Sn 2+ → Sn 4+ + 2е
жартылай тотықсыздану реакциясы
Fe 3+ + е → Fe 2+ /*2 2 Fe 3+ + 2е → 2 Fe 2+
Жартылай реакцияға кіретін заттар тотығу - тотықсыздану жұбын түзеді (Sn 4+ / Sn 2+ , Fe 3+ / Fe 2+ ) . Бұл жұптың бір компоненті тотыққан түрі (Sn 4+ , Fe 3+ ), екінші компоненті тотықсызданған түрі (Sn 2+ , Fe 2+ ) болып табылады.
Екінші жартылай реакция
Fe 2+ -1e →Fe 3+ не Fe 2+ →Fe 3+ + 1e
Қосып алатын электрондар мен берілетін электрондардың санын теңестіру үшін реакция беске көбейтіледі:
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz