Судың диссоциациясы, рН және рОН: қышқыл-негіз индикаторлары мен буферлік ерітінділер


Судың диссоциациялануы. Сутектік көрсеткіш. Қышқылдық-негіздік индикаторлар. Буферлік ерітінділер.
Су әлсіз электролит, электр тоғын нашар өткізеді, тек аздап қана диссоциацияға түседі: 2Н 2 О ↔︎ H 3 О + + OH - не Н 2 О ↔︎ H + + OH - деп жазады. Судың электр өткізгіштігін өлшеу арқылы сутек- және гидроксид- иондарының концентрациясы 10 -7 моль/л екендігі анықталған. Тепе-теңдікке келген жүйе үшін әрекеттесуші массалар заңын пайдаланып, диссоциация константасын жазуға болады: К = [H + ] × [OH - ] /[H 2 O] = 1, 8×10 -16 екендігі 22°С температурада анықталған. Судың диссоциациялануы өте нашар болғандықтан,
[H + ] × [OH - ] = [H 2 O] ×1, 8×10 -16 деп жазуға болады, себебі су концентрациясы өзгермейді деп қараса, осыдан [H + ] ×[OH - ] = К су - судың иондық көбейтіндісі. Температура өзгермесе бұл шама К су = [H + ] ×[OH - ] = 10 -7 × 10 -7 , яғни 10 -14 болады не 1литр суда 1000:18 = 55, 56моль болғандықтан:
[H + ] ×[OH - ] = [H 2 O] ×К = 55, 56×1, 8×10 -16 = 10 -14
Су - бейтарап зат. Сондықтан сутек және гидроксид иондарының концентрациялары бірдей, әрқайсысы 10 -7 г-ион/л тең. Қышқыл ерітінділерде сутек иондары көбірек, сілтілік ерітінділерде гидроксид иондары көбірек; бірақ ерітіндіде қышқыл не сілті болсын бәрібір H + және OH - иондары концентрацияларының көбейтіндісі әрдайым тұрақты болады.
Егер, мысалы, таза суға қышқыл қосып сутек иондарының концентрациясын 10 -3 моль/л дейін көтерсе, гидроксид иондарының концентрациясы кемиді, өйткені [H + ] [OH - ] көбейтіндісі 10 -14 өзгермейді. Демек, бұл ерітіндіде гидроксид иондарының концентрациясы
[OH - ] = 10 -14 /10 -3 = 10 -11 моль/л болады.
Керісінше, ерітіндіге сілті қосып гидроксид иондарының концентрациясын 10 -5 дейін көтерсе, онда сутек иондарының концентрациясы
[H + ] = 10 -14 /10 -5 = 10 -9 моль/л болады.
Сутектік, гидроксидтік көрсеткіш. Ерітіндінің қышқылдығын не сілтілігін жоғарыда қолданғандай теріс мәнді көрсеткіші бар сандармен жазғанда, жұмыс кезінде ыңғайсыз, қиындық туғызады, сондықтан оларды сутек иондарының, не гидроксид иондарының теріс таңбамен алынған ондық логарифмдерімен көрсетеді. Ол сутектік не гидроксидтік көрсеткіш деп аталып, рН, рОН арқылы белгіленеді:
рН = − lg [H + ] ; рОН = − lg [ОH - ] .
Мысалы, егер [H + ] = 10 -3 моль/л болса, рН= 3; егер [H + ] = 10 -10 моль/л болса, онда рН = 10 т. с. с., осылай болғандықтан нейтрал (бейтарап) ерітіндіде рН = 7 болады, қышқыл ерітіндіде рН < 7, ал сілтілі ерітіндіде рН > 7.
Сонда рН + рОН = 14 болады.
Ерітіндінің рН-ын білу химиялық зерттеу жұмыстарында, әр түрлі өндірістік процестерде, тірі организмдерде жүретін құбылыстарды түсіндіруде өте керек. Көпшілік жағдайларда рН-тің дәл мәнін емес, ерітіндінің реакциясы (ортасы) қандай, қышқыл не сілтілік пе - соны сапалық түрде білу жеткілікті, ол үшін индикатор деп аталатын арнаулы реактивтерді қолданады. Сонда индикаторлар сутегі не гидроксид иондары индикаторлар: фенолфталеин, лакмус, метилоранж, метилқызыл.
Қазіргі кезде рН өлшеу арнаулы аспапта - рН -метрді қолданады, ол шыны электродты пайдалануға негізделген; бұл аспап нөлден14 -ке дейінгі аралықтағы рН-ты 0, 01 -ге дейінгі дәлдікпен өлшеуге мүмкіндік береді. [H + ], рН және ерітіндінің реакциялары арасындағы өзара байланс төмендегідей:
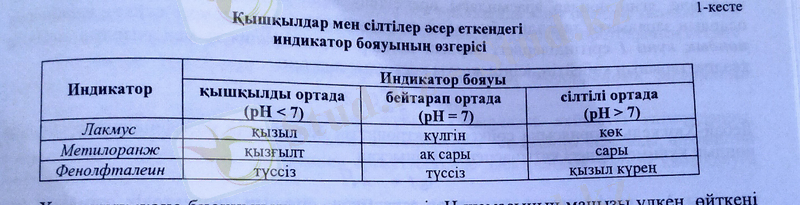
Химиялық және биохимиялық процестердегі рН шамасының маңызы үлкен, өйткені ортаның сипатына байланысты бұл процестер әртүрлі жылдамдықпен және көп бағытта жүруі мүмкін. Сондықтан, ерітіндінің рН анықтау медицинада, ғылымда, технткада, ауыл шаруашылығындааса маңызды. Қанның немесе асқазан сөлінің рН өзгерісі медицинадағы ауру түрін анықтауға көмектеседі. Топырақтағы ерітіндінің реакциясын зерделеу ауыл шаруашылығын тиімді жүргізуге көмектеседі.
рН мәнін аралымдық (буферлік) қоспаларды қолдану арқылы іс жүзінде тұрақты ұстап тұруға болады. Қышқыл мен негіздің шамалы мөлшерін қосқан кезде рН мәні өзгермейтін немесе салыстырмалы түрде өте аз өзгеретін ерітінділерді аралымдық (буферлік) ерітінді д. а. Аралымдық ерітінді түрінде әлсіз қышқылдар ерітіндісі және олардың тұздардың қоспалары ( СН 3 СООН+СН 3 СООNa), немесе әлсіз негіздер ерітіндісі және оның тұздары қоспасы(NH 4 OH+ NH 4 Cl) , немесе көп негізді тұздың әртүрлі дәрежеде алмасқан тұздар қоспасы(NaH 2 PO 4 +Na 2 HPO 4 ) жиі қолданылады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz