Бензол қатары: альдегидтер мен кетондардың құрылымы, алынуы және химиялық қасиеттері


Қазақстан Республикасының Білім және ғылым министрлігі
М. Өтемісов атындағы Батыс Қазақстан мемлекеттік университеті
КУРСТЫҚ ЖҰМЫС
Тақырыбы:
«Бензол қатары. Альдегидтер мен кетондар»
Орындаған:
Тексерген:
Орал, 2017ж.
Мазмұны
Кіріспе . . . 3
1. Ароматты қосылыстар. Ароматтылық. Кекуленің формуласы. Бензол құрылысы. Бензол және оның гомологтары
1. 1 Ароматты қосылыстар. Ароматтылық . . . 5
1. 2 Кекуле формуласы. Бензолдың құрылысы . . . 9
1. 3 Бензол және оның гомологтары . . . 13
1. 4. Бензолдың гомологтық қатары. Изомериясы. Номенклатурасы . . . 16
2 Ароматты қосылыстарының галоген туындылары және альдегидтер және кетондардың химиялық қасиеттері
2. 1 Көмірсутектердің моно- және полигалоген туындылары . . . 17
2. 2 Альдегидтер және кетондардың химиялық қасиеттері . . . 24
Қорытынды . . . 26
Қолданылған әдебиеттер тізімі . . . 28
Кіріспе
Ароматты қышқылдар деп құрамында бензол ядросының көміртек атомдарымен тікелей байланысқан карбоксил тобы бар бензол туындыларын айтамыз. Ароматты қышқылдарды карбоксил топтардың санына қарай бір-‚ екі- және көп негізді қышқылдарға бөлуге болады. Карбоксил топ тікелей ядромен байланысқан қышқылдардың аттарын ароматик көмірсутектерден шығарады. Карбоксил тобы бүйыр тізбегінде орналасқан қышқылдардың аттары әдетте тиісті май қатарының атауларынан алынады. Маңызы ең үлкен бірінші тип қышқылдары: мысалы‚ бензоин - бензекарбон қышқылы болып аталады.
Алу тәсілдері:
1. Бензол гомологтарының алкил топтарын тотықтыру.
2. Ароматты кетондарды тотықтыру.
3. Галогендері бір көміртек атомында орналасқан үш-галоген туындыларының гидролизі.
4. Нитрилдердің гидролизі.
5. Сульфонаттарды формиаттармен қоса балқыту.
6. Көмірсутектердің көмір қышқылының реакциясы.
7. Металорганикалық қосылыстармен СО 2 реакциясы.
Бензол қатарының монокарбон қышқылдары - түссіз кристалдық заттар. Орынбасарлары пара-қалыптағы қышқылдар өздерінің изомерлерінен гөрі әлеулі жоғары температурада балқиды. Ароматты қышқылдар өздерімен көміртек атомдарының саны бірдей май қатары қышқылдарынан гөрі шамалы жоғарырақ температурада қайнайды және жоғары температурада балқиды.
Монокарбон қышқылдар суық суда тым нашар‚ ал ыстық суда тым нашар‚ ал ыстық суда едәуір жақсы ериді. Төменгі сатыдағы қышқылдар су буымен бірге ұшады.
Антранил қышқылы - кристалды зат, суда онай ериділе.
Арендердің алғашқы табылған мүшелерінің өздеріне тән жағымды иістері болғандықтан, оларды Ароматты көмірсутектер деп те атаған. Бірақ киінірек ароматты көмірсутектерге жататын көптеген заттардың хош иістері болмайтыны анықталды. Осыған қарамай, тарихи қалыптасып қалған бұл атау осы кезге дейін қолданып келеді.
Жалпы ұғымдағы ароматтылықты неміс ғалымы Э. Хюккель тұжырымдаған және Хюккель ережесі деген атау бойынша белгілі.
Бұл ереже бойынша, ароматты молекулалардың δ -қаңқалы жазықтықтағы сақинасының ортақ электрондарының саны- 4 n-2 тең болуы керек., ондағы n= 0, 1, 2, 3 т. б. Тек осы жағдайда ғана молекулалары ароматтылық сипат алады. Ортақтасқан π -электрондардың саны 6, 10, 14 және басқада санға тең болуы мүмкін.
Бензол - химиялық формуласы C6H6. Түссіз сұйықтық, тәттілеу иісі бар. Бөлме температурасында бензол тез буланады: ауамен араласып қопарылғыш қауіпті затқа айналады. Буының массасы ауа массасынан 2, 7 есе көп (жерге жақын орналасып, үлкен концентрацияда жиналуға ықтималдылығы жоғары) . жанғанда басқа көмірсутектер сияқты, бензол көп күйе бөледі. Бензолдың тұрмыста қолдану аясы кең. Бұл химиялық өндіріс өнімінің ең кең тараған өнімдерінің бірі.
Зерттеу жұмысының мақсаты: Оқушыларға бензолдың қаныққан және қанықпаған көмірсутектерден айырмашылығын айта отырып тақырып мазмұнын ашу . Бензолдың құрылысына тоқталу, түсінік беру
Зерттеу жұмысының міндеті:
- Оқушыларға бензол құрылысын үйрену;
- Құрылымдық формуласын жаза отырып, халықаралық атау жүйесін үйрету;
- Бензолдың алынуына, қасиетіне түсінік беру алады.
1. Ароматты қосылыстар. Ароматтылық. Кекуленің формуласы. Бензол құрылысы. Бензол және оның гомологтары
1. 1 Ароматты қосылыстар. Ароматтылық.
Ароматик көмірсутектердің жалпы формуласы C n H 2n-6 (n>6) ең қарапайым типтер тобына бензол (толуол) бар деп санайды. Одан әрі бірнеше изомерлер бола береді. Мысалы, бензол сақиналары төмендегідей 4көмірсутек C 8 H 10 бар:

толуол этилбензол
Изомерия бұл арада радикалдың үлкендігі мен санына, әрі орнына байланысты. Екі радикал ядро орта (1, 2) мета (1, 3) және пара(1, 4) деп аталатын әр түрлі үш орынға ие бола алады.
Күрделірек көмірсутектерден кумол мен цимолды атап өту керек.
Ароматик көмірсутектер үшін эмпирикалық атаулардан(толуол, ксилол, кумол) басқа системалық номенклатура дабар. Бұл номенкулатура бойынша басқа қосылыстар белгілі атом не атомдар тобы (орынбасарлар) бензол(бензиннің) атомдарының орнын басушы ретінде қарастырылады және әрбір орынбасардың орны цифрмен көрсетіледі.
Ароматик көмірсутектер, бұрын айтылғандай, тас көмір смоласы мен мұнайдан, сонымен қатар май қатарының көптеген қосылыстарынан алынады.
Лаброторияда таза күйіндегі ароматик көмірсутектерді таза күйінде көбірек кездесетін ароматик қосылыстардан алады.
Алу әдістері.
1 Бензойлы қышқылдың тұздарын сілтілермен бірге айдау арқылы бензол алуға болады:
C 6 H 5 - COONa+NaOH→N a2 CO 3 + C 6 H 6
Бұл әдіс басқа да көмірсутектер алу үшін қолданылады.
2. Бензолдың гомологтары Вюрц- Фиттиг реакциясы (1864 ж. ) бойынша галоген туындыларынан оңай алынады:
C 6 H 5 Br+BrC2H5+2Na→C 6 H 5 - C 2 H 5 + 2NaBr
Май қатарындағы Вюрц синтезімен салыстырғанда бұл арада реакция өнімдерін бірінен -бірін оңай бөлуге болады. Al k 2 және Ar 2 типтес қосымша өнімдердің қайнау нүктелерінің Alk-Ar 1 типтес көмірсутектердің қайнау нүктелерінен күрт өзгешелігі бар.
Бұл синтез механизімінің Вюрц синтезінің механизмінен айырмасы жоқ : реакция металорганикалық қосылыс түзілу сатысы арқылы жүреді.
3. Бензол гоиологтарың алудың маңызды әдісісінің бірі- Фридель - Крафтс -Густавсонның реакциясы(1877ж. )
C
6
H
6
+C
2
H
5
Cl
AlCl
→C
6
H
5
-C
2
H
5
+HCl
Катализатор ретінде AlCl
3
және басқа сусыз хлоридтерді, сонымен қатар НҒ пайдалануға болады.
Бұл әдіс лабораториялар мен заводтарда кең түрде қолданылады. Қосымша өнімдер есебінде бензол полиалкил туындыларының түзілуі, сондай -ақ кейбір радикалдардың реакция кезінде изомерленуі бұл әдістің кемшілігі болып табылыды. Мысалы, нормаль хлорлы пропил мен бензолдан - кумол, хлорлы изобутилден үшіншілік бутилбензол алынады.
C
6
H
6
+CH
3
-CH
2
-CH
2
Cl→
Al Cl
3
C
6
H
5
-CH (CH
3
)
2
C
6
H
6
+(CH
3
)
2
CH-CH2Cl
AlCl
3→
C
6
H
5
-C(CH
3
)
3
+HCl
Бұл реакция галоген туындыларды олефиндер немесе спирттермен айырбастауға бролады. Онда катализатор есебінде AlCl 3 басқа фосфор, күкірт және фторлы сутек қышқылдарын қолданған өте қолайлы.
Механизмі жөнінен бұл кәдімгі элетрофильдік орын басу реакциясы. Мұндай реакциялардың механизмі кейініректе қарастырылады.
4. таза ароматик көмірсутектер тиісті ароматик кетондары амальгамдалған мырышпен тұз қышқылдарында тотықсыздандыру арқылы алынады(Клеменсен бойынша) Бастапқы кетондар Фридель- Крафте реакциясы бойынша оңай алынады.
C 6 H 6 +СН 3 - СОСI→ Al Cl 3 C 6 H 5 -CО - CH 3 +HCl
C 6 H 6 - CО - CH 3 +2Н 2 →C 6 H 5 - CH 2 -СН 3 +Н 2 О
Физикалық қасиеттері. Ароматик көмірсутектер -әдетте сұйық, ал кейде қатты заттар, ерекше күшті исі бар. Бензолдың қайнау температурасы (80, 1 0 С) гексанның қайнау температурасынан (68, 8 0 C) жоғары.
Изомерлес қосылыстардың қайнау температураларының айырмашылығы шамалы. Жалғыз, бір-ақ үлкен радикалы бар изомерлерден гөрі бірнеше радикалы бар изомерлер жоғарырақ температураларда қайнайды. Радикалдар жақын орналасқан сайын қайнау температурасы әдетте жоғарылайды . Сондықтан орто-изомерлер әдетте пара-изомерлерден гөрі жоғарырақ температурада қайнайды. Нормаль құрылысты орынбасары бар изомерлерден гөрі изоқұрылысты орынбасары бар изомерлердің қайнау температурасы төменірек. Әрбір жаңа CH 2 тобы қайнау температурасын шамамен 30°С арттырады.
Симметриялы құрылысты изомерлердің балқу температурасы жоғарырақ болып келеді. Екі орынбасарлары изомерлердің ішінде - пара-изомер ең жоғары температурада балқиды.
Май қатары мен алициклді қатар көмірсутектерінен гөрі ароматик көмірсутектердің тығыздығы және жарық сындыру көрсеткіштері анағұрлым жоғары.
Ароматик көмірсутектерді суда ерімейді десе де болады. Олардың буымен ұзақ уақыт бойы демалса улануға ұшыратады.
Химиялық қасиеттері: Ароматик көмірсутектердің қосылу реакцияларынан гөрі орнын басу реакцияларына түсу қабілеті күштірек. Сондай-ақ бензол сақинасына үлкен тұрақтылық тән. Ароматик көмірсутектердің бұл өзгншеліктері олардың ароматик деп аталатын ерекшелігін анықтайды.
1. 2 Кекуле формуласы. Бензолдың құрылысы
Жалпы формуласы СnН2n -6 болғандықтан, бензолды өте қанықпаған қосылысқа жатқызуға болар еді. Бірақ бензол бромды сумен және калий перманганатының ерітіндісімен әрекеттеспейді, яғни қанықпаған қосылыстарға тән реакцияларға түспейді. Осылай бензолдың құрамы мен қасиеттерінің арасында біздің түсінігімізше сәйкессіздік туады. Бензол буы мен сутек газының қоспасын катализаторы бар қыздырылған түтік арқылы өткізсе, бензолдың бір молекуласы сутектің үш молекуласын қосып алып, құрылысы бізге таныс циклогексан түзіледі екен:

Бензол бұл қасиетті тек циклді құрылысты болғанда ғана көрсете алады деп тоқтам жасауға болады. Молекула құрамындағы көміртектің алты атомы цикл жасап тұйықталады және олар өзара қос байланыс пен дара байланыс арқылы кезектесіп жалғасады деп, бензолдың құрылымдық формуласын ең алғаш неміс ғалымы А. Кекуле ұсынды (1865 ж. ) .
Бірақ құрамында үш қос байланысы болса, бензол қанықпаған көмірсутектерге тән қасиеттер көрсетіп, бромды су және калий перманганатының ерітіндісімен әрекеттесер еді.
Сонымен бұл формула:
а) құрамында қос байланыс болғанымен, бензол неге қосылу реакцияларынан гөрі, орынбасу реакцияларына бейім;
ә) бензол молекуласындағы барлық көміртек атомдарының араларындағы байланыстардың ұзындықтары неге бірдей;
б) бензол молекуласының химиялық тұрақты болуы неліктен, т. б. сұрақтарды қанағаттандыра алмады. Бірақ Кекуле ұсынған формула бензолдың химиялық қасиеттерін толық сипаттамағанымен, осы уақытқа дейін қолданылып келеді.
Бензол молекуласындағы көміртегінің барлық атомдары sp 2 гибридтену күйінде болады. Созылған сегіздік пішінді, әрбір көміртегі атомының гибридтік үш электрон орбитальдары сақина жазықтығында көміртегінің көрші атомдарымен екі σ байланыс және сутегі атомдарымен бір σ байланыс түзеді.
Ароматты көмірсутектерді жұйелеу номенклатурасы бойынша арендер деп аталады.
Егер бензол молекуласының екі сутек атомы радикалдарға алмасқан болса, онда бензолдың орто-, мета-, пара- туындылары түзіледі. Оларды атағанда, қысқаша бірінші әрпімен белгілейді: орто-о, мета-м, пара-п. Немесе әріатердің орнына сандар арқылы белгілеулерде қолданылады.
Қосып алу реакциялары.
1. Ароматик көмірсутектерге сутектің қосылуы тек қана катализаторлардың қатысуымен және жоғары тепературада өтеді. Сонда циклогексан мен оның гомологтары алынады.
C 6 H 6 +3Н 2 →C 6 Н 12
2. Күн көзінің ультракүлгін сәулелерінің әсерінен бензолдың хлор және бром қосып алуы арқылы гексагалогенидтер түзіледі. Олар қызған кезде галогенсутектің үш молекуласынан айрылады және үш галогенбензолдар береді:
C 6 H 6 +3Cl 2 →C 6 Н 6 Cl 6 -3HCI →C 6 H 3 CI 3
3. Басқа қанықпаған қосылыстар сияқты бензол озон қосып алады да аса қопарылғыш зат - үш озонид құрады. Бұл озонид сумен әрекеттескенде глиоксальдің үш молекуласын береді.
C 6 H 6 +3О 3 →C 6 Н 6 О 9 →3CНО - CНО
Бұл өзгерістердің бәрі де бензолды қанықпаған қосылыс ретінде сипаттайды.
Орын басу реакциялары. Бензол мен оның гомологтары галогендермен (катализатордың қатысуымен), азот және күкірт қышқылдарымен басқаша әрекеттеседі. Барлық жағдайда да басқа атомдар немесе қалдықтар бензол ядросы сутектерінің орнын басады.
1. Катализаторлардың, мысалы, темірдің қатысуымен хлор немесе бром бензолмен әрекеттестіргенде галоген сутек атомдарының орнын басады, әрі бағытталу ережесі сақталады: хлор бензолдан көбінесе дихлорбензолдың пара-изомері алынады.
C
6
H
6
+Cl
2
kt
→C
6
Н
5
CI
C
6
H
5
CI+Cl
2
→C
6
Н
4
Cl
2
+HCl
2. Бензолға нитрлегіш қоспамен азот және күкірт қышқылдарының қопасы әсер еткенде сутек атомдарының орнын нитротоп басады. Нитрлеу әрі қарай жүргенде де орын басу ережесі сақталады; нитробензолдан динитробензолдың мета- изомері алынады.
3. Бензолды концентрациялы күкірт қышқылымен әрекеттестіргенде сульфоландыру реакциясы жүреді. : сульфотоп сутек атомдарының орнын басады. Бұл арада моносульфоқышқылмен м - дисульфоқышқыл пайда болады.
C 6 H 6 →C 6 H 5 - SO 3 Н→ C 6 H 5 - (SO 3 Н) 2
М - бензолдисульфоқышқыл
Бұл үшін реакция ароматик көмірсутектердің басқа кластардың көмірсутектерінен айырмашылығын көрсетеді.
4. Бензол және оның гомологтарының тотығуы. Бензол сақинасы тотықтырғыштармен өте қиын әрекеттеседі.
V 2 O 5 катализатор усубінде қолданып бензолды ауадағы оттекпен тотықтырғанда малеин қышқылы түзіледі.
Бензол гомологтары әдеттегі тотықтырғыштардың әсерімен ароматик қышқылдарға айналады. Ұзын-қысқалығына қарамай бүйір тізбек карбоксил тобын береді. Бірнеше орынбасарлары болса тотықтырғыштарды іріктеп қолдану арқылы алдымен ұзындау, содан кейін қысқалау тізбектерді немесе керісінше тотықтыруға болады. Бұл реакция ароматик көмірсутектердің құрылысын айырып білу үшін пайдаға асады:
C 6 H 5 - СН 3 +2KMnO 4 → C 6 H 5 COOK+2MnO 2 +KOH+H 2 O
Толуол бензоин қышқылының калий тұзы
C 6 H 5 - СН 2 - СН 3 +4KMnO 4 → C 6 H 5 COOK+K 2 CO3+4MnO 2 +2H 2 O
Этилбензол
Алкилбензолдардың, мысалы, изопропилбензолдың тотығуы нәтижесінде гидроасқынтотық түзіледі, оны ыдырату арқылы ацетон мен фенол алады.
1. 3 Бензол және оның гомологтары
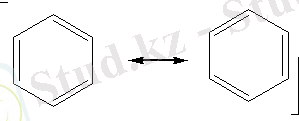
XX ғасырдың басында ғана әр түрлі физикалық тәсілдерді пайдаланудың аркасында, бензол молекуласының құрылысын түсіндіруге мүмкіндік туды. Бензол молекуласы жазық пішінді. Барлық көміртек атомдары ұқсас, электрон тығыздығы бірдей бөлінген, көміртек атомдарының арақашықтықтары өзара тең (0, 140 нм) . Бензол молекуласы тең қабырғалы жазық алтыбұрыш пішінді болады.
Барлық көміртек атомдарының s-байланыстары мен р-электрон тығыздығының біркелкі бөлінуі (орналасуы) нәтижесінде едәуір берік және бәрі бірдей "ароматты" байланыс түзіледі. Яғни, бензол молекуласындағы барлық көміртек атомдары арасындағы байланыстар "таза" дара байланыстардан да, қос байланыстардан да өзгеше болады. Бензолдың бұл қарастырылған құрылымдық формуласы жоғарыда қойылған сұрақтарға (бензол неліктен қосылу реакцияларына бейім емес, неге барлық алты қабырғалары тең және неге химиялық тұрақты, т. б. ) жауап бере алады. Бензол молекуласының барлық алты қабырғаларының ұзындықтары бірдей 0, 140 нм-ге тең болады. Бензолдағы С-С байланыстардың энергиясы 490 кДж/моль-ге тең дара байланыс пен қос байланыстар мәндерінің арасындағы сан болады.
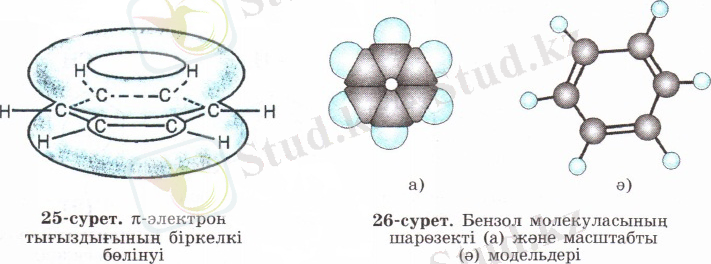
Молекуласында электрон тығыздығының біркелкі бөлінуін ескеріп, бензолдың құрылымдық формуласында ортақ байланысты тең қабырғалы алтыбұрыштың ішіндегі дөңгелек арқылы да бейнелеуге болады. Сонымен қатар кемшіліктерін ескере отырып, Кекуле ұсынған формуланы да пайдалануға болады.
Жеке өкілдері. Бензол - сұйықтық, балқу температурасы 5, 4°C, қайнау температурасы 80, 1°С. Сумен азеотроп қоспасын түзеді, сондықтан айдау кезінде оңай сусызданады. Химия өнеркәсібінде кеңінен қолданылады.
Толуол - сұйықтық, балқу температурасы - 93°C, қайнау температурасы 110, 6°C.
Негізгі қолданылатын орны - қопарылғыш заттар (үшнитрол, толуол, тротил) өндірісі; анилбояула, парфюмерия, тамақ және өнеркәсіптің басқа салаларының жартылай шикізаттары - бензоин альдегиді мен хлорлы бензил өндірісі. Еріткіш есебінде қолданылады.
Ксилолдар. Тас көмір смоласының көмірсутек фракцияларын айдаумен алынған ксилолдың үш изомерінің қоспасы соңғы уақытқа дейін лабораториялық практикамен техникада қолданылып келеді. Қайнау температурасы 138° - 142°C, мұндай қоспа көбінесе еріткіш және мотор отынының бөлігі (октандық саны 120-дан артық) есебінде пайдаланылады.
Кейінгі онжылжықтарда ксилолдың жеке изомерлері, әсіресе n- ксилол кеңінен пайдаланылуда лавсан, терилен синтетикалық талшықтардың өндірісі үшін, аминоксилолдар (ксилидиндер) антидетонаторлар есебінде қолданылады.
Ксилолдарды сатылапмұздату арқылы айырады. Қазіргі уақытта пайдаланылатын барлық ксилолдың 90% мұнай өңдеу өнімдерінен өндіріледі.
Этилбензол. Хлорлы аммонийдің қатысуымен бензолды этиленмен алкилдеу синтезі арқылы алынады. Қайнау температурасы 136, 1°C. Көбінесе стирол алу үшін қолданылады.
Кумол. Бензолды пропиленмен жоғарыдағыдай алкилдеу арқылы алады. Қайнау температурасы 152°C фенол мен ацетонның өндірістік синтезі үшін қолданылады.
Сонымен, ароматик, алициклді алифатик қосылыстар арасында біріне-бірі өз ара алмасады.
Ароматик қосылыстарлы зерттеуді құрамында тек бір ғана бензол сақинасы бар ең қарапайым тобынан бастаймыз. Содан сщң бұл ароматик көмірсутектердің әр түрлі туындыларын зерттейміз, ол курстың соңында күрделірек көмірсутектермен танысу үшін керек.
1. 4. Бензолдың гомологтық қатары. Изомериясы. Номенклатурасы
Орын басу реакцияның механизмі. Орынбасушылардың бағытайтын әсерінің механизмі.
Бензолдың алу әдістері:
1) циклоалканды және циклоалкендерді дегидрирлеу (Зелинский) . Реакция катализатор Pt және 300 0 С температурада жүреді:
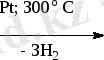
циклогексан бензол
2) Алкендерді дегидроциклдеу:
гексан бензол
3) Ацетиленді тримерлендіру
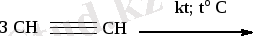
бензол
2 Ароматты қосылыстарының галоген туындылары және альдегидтер және кетондардың химиялық қасиеттері
2. 1 Көмірсутектердің моно- және полигалоген туындылары17
Көмірсутектердің моно- және полигалоген туындылары. Галоген туындыларын көмірсутектердегі бір немесе бірнеше сутек атомдарының орнын галоген атомдарының басуынан шыққан өнімдер деп қарастыруға болады.
Қаныққан көмірсутектердің моногалогенді туындылары.
Қаныққан көмірсутектердің моногалогенді туындылары галоген алкилдер деп аталады. Олардың жалпы формуласы C n H 2n+1 Hlg. Галоген атомының орналасуына, галоген атомымен байланысқан көміртек атомының тур айырмашылығына байланысты галоген туындылары біріншілік(I), екіншілік(II), үшіншілік (III) болып бөлінеді:R-CH 2 -Cl(I), R 2 CH-Cl(II) және R 3 C-Cl(III) .
Изомериясы. Номенклатурасы. Галоген туындыларының изомериясы көміртек қаңқасының құрлысына және тізбектегі галоген атомының орнына байланысты. Сондықтан қаныққан көмірсутектерінен гөрі галоген туындыларының изомерлері саны көбірек болады. Изомерия қатарының үшінші мушесінен басталады. Галоген туындыларының аттары систематикалық номенклатура бойынша, оларға сәйкес қаныққан көмірсутектерінің аттарына галогендердің атын қосу арқылы құрайды, галоген атомының тізбектегі орны цифрмен көрсетіледі. Галоген туындыларыының ең қарапайым мушелерін олардың құрамына кіретін радикалар бойынша атайды:
CH 3 -Cl хлорметан, хлорлы метил.
CH 3 -CH 2 Cl хлорэтан, хлорлы этил,
CH 3 -CH 2 -CH 2 Cl 1- хлорпропан, хлорлы пропил
CH 3 -CHCl-CH 3 2-хлорпропан, хлорлы изопропил, хлорлы . екіншілік пропил.
CH 3 -CH 2 -CH 2 -CH 2 -Cl 1-хлорбутан, хлорлы бутил,
CH 3 -CHCl-CH 2 -CH 3 2-хлорбутан, хлорлы екіншілік бутил.
CH 3 -CH(CH 3 ) -CH 2 Cl 1-хлор-2-метилпропан, хлорлы изобутил
CH 3 -CCl(CH 3 ) -CH 3 2-хлор-2-метилпропан, хлорлы ушіншілік бутил.
Алу әдістері. Көбінесе моногалогенді туындыларды орынбасу реакциясы бойынша қаныққан көмірсутектердің, галогенсутектерін қосу арқылы олефиндерден, галогенді сутектерді және фосфор галогенидтері реакциясы арқылы спирттерден алады.
1. Моногалоген туындыларын қаныққан көмірсутектерден сутек атомдарын галогендермен орын басу реакциясы арқылы алу ең маңызды техникалық әдіс болып табылады, Сутектің галоген атомдарымен алмасу реакциясының ерекшеліктері жоғарыда қарастырылған.
2. Олефиндерге галоген сутектердің қосылуы әдетте салқын кезінде ақ журеді. Бұл тәсіл әсіресе моногалоген туындыларын алуға өте ыңғайлы. Себебі, жоғарыда сипатталған тәсілдердегідей бұл реакциядан жанама өнімдер полигалогенді туындылар пайда болмайды.
3. Көбінесе галоген туындыларын сутектерінің әрекетімен спирттердің гидроксил тобын галогенге алмастыру:
R-OH +H-Cl=R-Cl+H 2 O
Немесе
R-OH+KBr+H
2
SO
4
=R-Br+KHSO
4
+H
2
O
Фосфор галогенидтерімен:
R-OH+ PCl 5 =R-Cl+HCl+POCl 3
3R-OH+PCl 3 =3R-Cl+P(OH) 3
Немесе хлорлы тионил
R-OH+SOCl 2 =R-Cl+SO 2 +HCl
Арқылы алады.
РСІ 3 жұмыс істегенде жанама өнімдері ретінде курделі эфир P(OR) 3 алынады.
Кейде фосфор галогенидтерін тікелей сол реакция ортасында қызыл фосфорға броммен немесе йодпен әрекеттестіру арқылы алады.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz