Комплексті қосылыстардың құрылымы, теориялары, қасиеттері және медициналық қолданылуы


Жоспар.
І. Кіріспе.
Комплексті қосылыстарға жалпы сипаттама.
ІІ. Негізгі бөлім.
2. 1. Координациялық теория.
2. 2. Комплексті қосылыстандың номенклатурасы.
2. 3. Комплексті қосылыстардың класификациясы.
2. 4. Комплексті қосылыстардың изомериясы.
2. 5. Комплексті қосылыстардың тұрақсыздық сонстантасы.
2. 6. Комплекс қосылыстардағы химиялық байланыстардың табиғаты.
2. 7. Төменгі және жоғарғы спинді комплекстер.
2. 8. Төменгі және жоғарғы спинді комплекстер.
2. 9 Молекулалық орбитальдар теориясы.
ІІІ. Қорытынды.
Комплексті қосылыстардың биологиялық маңызы және
медицинада қолданылуы.
ІV. Қолданылған әдебиеттер.
I. Кіріспе.
Комплексті қосылыстар.
Комплексті қосылыстар туралы түсінік.
Бұрынғы бізге белгілі косылыстарда атомдар бір - бірімен иондык^жөне коваленттік байланыстар аркылы крсылған. Мүндай крсылыстар бірінші ретгі деп аталатын. Осы крылыстардьщ молеқулалары өзара врекетгескенде, комплексгі крсылыстар деп аталатын жоғары ретті крсылыстар түзіледі.
Мысалы: Си(ОН)
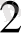 + 4МН
+ 4МН
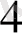 ОН = [Си(МН )
ОН = [Си(МН )
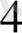 ] (ОН)
] (ОН)
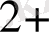 + 4Н
+ 4Н
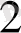 О
О
Сулы ерггіцдіде комплекс косылыстар диссоциацияланады.
[Си (МН
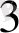 )
)
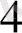 ] (OH)
] (OH)
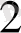 →[Cu(NH
→[Cu(NH
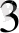 )
)
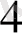 ]
]
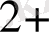 +2OH
+2OH
[Cu (NH
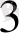 )
)
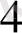 ]
]
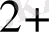 → комплексті ион
→ комплексті ион
Кристалда да, ерітіндідеде кұрамында комплексті ионы
болатын жоғары ретті қосылыстар комплексті қосылыстар деп аталады.
Химиялық байланыс теориясы тұрғысынан қарағанда, "Комплекс қосылыстар дегеніміз кұрамында бір немесе бірнеше донорлы - акцепторлы байланыс болатын. жоғары ретті қосылыстар
II. Негізгі бөлім.
2. 1 Координациялық теория.
1893 жылы Швейцария ғалымы Вернер комплексті қосылыстардың кұрылысымен касиетін түсіндіретін коордңнациялық теория усынды.
Негізгі кағидалары
І. Комплексті қосылыстағы басты орын комплекс түзушінің үлесіне тиеді. Комплекс түзуші көбінесе оң зарядты металл
иондары болады.
2. Комплекс тузушінің маңайына теріс зарядталған аниондар немесе электронейтрал молекулалар - лигандалар - жиналады.
3. Комплекс түзушінің маңайына орналасқан лигандалардың жалпы саны комплекс түзушінің координациялық саны (к. . с . . . ) болып табылады.
4. Комплекс түзушімен лигандалар-комплекс қосылыстың сыртқы сферасы.
Мысалы: Си(МН
3
)
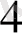 ] SO
] SO
Си
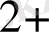 комплекс түзуші, NH
комплекс түзуші, NH
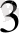 Equation. 3 - лиганда, К. С=4
Equation. 3 - лиганда, К. С=4
Си(МН
3
)
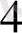 ]
]
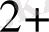 ішкі сфера SO
ішкі сфера SO
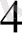 Equation. 3
Equation. 3
 сыртқы сфера
сыртқы сфера
Комплекс түзушінің координациялық саны.
Негізгі комплекс түзушілерге Д. И. Менделеевтің периодтық системасының d-элементтері жатады. Комплекс түзушілердің координациялық саны тотығу дәрежесіне тәуелді.
 , Ag
, Ag
 , Au
, Au

1 +
2
Cu
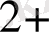 , Ag
, Ag
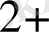 , Au
, Au
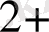
Pd
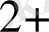 ; Pt
; Pt
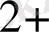 , Pb
, Pb
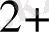 , Cd
, Cd
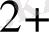
Sn
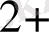 . Zn
. Zn
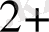
2 +
4
AI
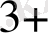 +Cr
+Cr
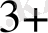 +, Co
+, Co
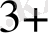 , Fe
, Fe
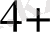
Fe
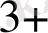 +, Ni
+, Ni
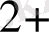 , Pt
, Pt
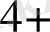 , Pb
, Pb
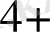
Pd
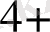
2 +
3 +
4+-
6
Cd
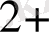 , Sr
, Sr
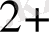
W
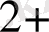 +. Mo
+. Mo
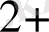
2 + 6 +
8 (өте сирек)
Маңызды лигандалар:
- Полюсті молекулалар Н2О, N Н3, СО, N0, N Н2ОН
- Иондар F, CI, Br, P, O, OH, CN, CNS, SO, CO, CO
Комплексті қосылыстың формуласын қүрастыру. Комплексті қосылыстың формуласын құрастыру үшін комплекс тузушінің координациялық санын, оның зарядын, лигандалардың зарядтарын, сыртқы сфераның зарядын анықтау керек.
Мысалы: Ғе 2+ - комплекс тузупгі, СN - лиганда, Қ + -сырткы сфера. Ғе
+ -координациялық саны 6, , сондыктан Ғе(СИ) 6 деп жазамыз, (СN) заряды (-1), сондыктан комплекс ионының заряды (Ғе(СМ) б ] 4 ~ Молекула нейтрал болу керек. Сонда комплексті крсылыстың формуласы: К 4 [Ғе(СМ б ) ]
2. 2 Комплексті қосылыстардың номенклатурасы
І. Құрамында комплекс катионы бар крсылыстардың систематикалық аты былай кұрастырылады. Ең бірінші кышкылдық калдық лигандалар аталады, олардың саны грек тілінде көрсетіледі. 2-ди, 3-три, 4- тетра, 5- пента, 6- гекса, 7-гепта, 8- окта. Қышкылдықкалдыкка "О" жұрнағы косылады. Вг-бромо, СГ - хлоро, Ғ - фторо, О
2
- оксо, N
3
-нитридо, ОН" -. гидроксо, СN-циано, СОз
2
-карбонато, РО
4
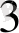 -фосфато, S
2
О
3
2
-тиосульфато, С2О4
2
- оксалато.
-фосфато, S
2
О
3
2
-тиосульфато, С2О4
2
- оксалато.
Бұлардан кейін электронейтрал моддекулалар айтылады:
СеНб - бензол, С 2 Н 4 - этилен, N
H 4 - гидразин, Н 2 О - аква, NН 3 - аммин, N0 - нитрозил, СО- карбонил, СS - тиокарбонил.
Ішкі сферадағы лигандаларды атағаннан кейін, комплекс
түзуші аітау септігінде аталады, рим санымен зарядыкөрсетіледі, ең соңында сырткы сферадағы анион ы, і әрпін
қосып айтылады. ' .Мысалы: [Ag(NН 3 ) 2] СІ -диаммин күміс (I) хлориді, [А1(Н 2 О) 5 ОН] 5О 4 - (III) сульфаты
Қурамында комплексті анионы бар қосылыс былай аталады :Алдымен сырткьі сфера атау септігінде аталады. Осыдан кейін ішкі сфераны бүрынғы ретпен атап, комплекс түзуішге "аты" деген жұрнақ қосып, соңынан жақша ішінде оның тотығу дәрежесін көрсетеді. К[Аg(СN) 2 ] - калий дицианоаргентаты (I)
Nа 3 ІСО(N0 2 ) 6І - натрий гексанитрокобальтаты (III)
Сырткы сфера жоқ қосылыстардың аталуы:
Сг(С 6 Не) 2 - дибензолхром.
2. 3 Комплексті қосылыстардың классификациясы.
1. Лигандалар типіне кдрай:
а) аквакомплекстер : [А1(Н 2 О) 6 ] С1 3 ( лиганда - Н 2 О)
б) аммиакаттар : [Сг(НН 3 ) 6 ] С1 3 ( лиганда - МН 3 )
в) -«арбонилдер''. [Ғе(СО) 5 ] ( лиганда - СО)
г) ацидокомплекстер : К 4 [Рd(СМ) 6 ] ( лиганда - аниондар) Бұлар бір ядролы комплекстер.
2) Циклды комплексті қосылыстар. Мұндай қосылыста лигандалар екі немесе одан да көп орын алады. Комплекс түзуші лигандамен әрі ковалентті, әрі донорлы- акцепторлы байланыс аркылы қосылады.
1905 жылы Чучаев мынадай циклды комплекс ашқан
О-Н О
Н 3 С -С = N N = С- СН 3
Ni
Н 3 С -С = N " N = С- СН 3
О-Н О
Никель (II) диметилглиоксиматы кьізыл түсті төрт циклді комплекс. Бұл қосылыста екі ковалентті, екі донорлы акцепторлы байланыс жәнё сутекті байланыстар бар.
Бұл комплекс никельді апықтауға қолданылады.
Циклді комплекстер хелатш комплекстер деп те аталады.
Бұлар көп дентантты комплекстёр. Хелатты комплекстерге хлорофилл . жене = гемоглобин жатады. Хлорофиллде. комплекс түзупгі Мg, (комплекс жасыл) ал гёмоглобинде - Ғе(комплекс қызыл.
C C C
C C C C
C N N C
C Mg C
C N N C
C C C C
C C C
хлорофилл
Хлорофилл, гемоглобин
сияқты комплекс қосылыстардың биологиялық процестерде маңызы өте зор.
Көп ядролы комплекстер: Н 4 SіО 4 12WО 3 пН 2 О, Изополи қ қышқылдар: Н 2 Сг 2 О 7
2. 4 Комплексті қосылыстардың изомериясы
Комплексті қосылыстардың сапалық құрамы бірдей болып, ал кұрылысы мен кдсиеттері өр түрлі болуын изомериядеп атайды Изомерияның түрлері
І. Геометриялық: Лигандалар өзара өр түрлі орналасады
CI NH3 NH3 CI
Pt Pt
CI NH3 CI NH3
Цис-изомер транс-изомер
Қызғылт сары суда ерімейтін сары кристалдар
Гидраттық изомерия
Ішкі және сыртқы сферада су молекулаларының әр түрлі орналасуы
[Сг(Н 2 О) 5 ] С1 2 Н 2 О [Сг(Н 2 О) 4 С1 2 ] а2Н 2 О
қызыл күлгін ақщыл жасыл қою жасыл
Иондық изомерия: Ішкі және сыртқы сферада иондар өр түрлі.
[Со 3+ (НН 3 ) 5 Вг] 2+ 5О 4 [Со(НН 3 ) 5 SO4] Br
қызыл күлгін қызыл
З. Оптикалық (айналык изомерия)
Екі комплекс қосылыстың кұрамы бірдсяй, тек бір комплекс екіншісінің айнадағы бейнесі .
4. Координациялық изомерия: Қүрамында бірнеше комплексті
иондар болса, олардың қурылысы әр түрлі .
[Со(НН 3 ) б ] [Сг(СН) 6 ] [Со(СК) б ИСг(НН 3 ) 6 ]2. 5 Комплексті қосылыстардың тұрақсыздық константасы.
Комплексті қосылыстар сулы ерітіндіде сыртқы және ішкі
сфераларға диссоциаци5іланады.[Ад{NН 3 ) 2 ] С1 -> [Аg(НН 3 ) 2 ] + + СI
Түзілген комплекс иондар аз мөлшерде диссоциацияланады:
[Аg(НН 3 ) 2 ] + -> Аg + + 2NН 3
Бұл қайтымды процесс, сондыкган әсер етуші массалар заңы бойынша диссоциациялану константасы:
[Аg + (НН 3 ) ]

K= =6. 8 10- осы шама тұрақсыздық
[Аg(НН 3 ) 2 ] + константасы (Ктұрақсыздық)
К тұрақсыздық шамасына керісінше шаманы тұрақтылық константасы дейді. К тұрақтылық = 1/К тұрақсыздық = К тұрақтылық неғұрлым тұрақты болса комплекс соғұрлым тұрақты.
2. 6Комплекс қосылыстардағы химиялық байланыстардың табиғаты.
Валенттік байланыс әдісі.
Негізгі түсініктері
а) Комплекс тузуші мен лигандалардың арасындағы байланыс
донорлы-акцепторлы болады. Лигандалар өздерінің электрон
косағын, ал комплекс түзуші өзінің орбиталін береді. Лигандалар-
донор, комплекс түзуші- акцептор.б) Комплекс түзушінің орбитальдары алдымен гибридтенеді, содан кейін лигандалардың орбитальдарымен бүркеседі. Гибридтену типтері лигандалардьң сандарына, табиғатына электрондық кұрылымына байланысты.
в) Комплекс тузушінің орбитальдарының гибридтену типі
комплекс косылысының геометриялық формасын анықгайды.г) Комплекс косылыста дара электрондар болса-парамагнитті,
яғни Магнитке тартылады, ал дара электрон жоқ болса-
диамагнитті (магнит өрісінде тартылмайды. ) НМысалы: [NН4] + - ионы H:N:H SP
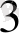
N (Z=7) (1S
2S
2P
) H гибридтену
H (S
) H
1S орбиталь
3 ковалентті байланыс, 1 донорлы -акцепторлы.
Кристалдық өріс теориясы
1929 ж Бетэ ұсынды. Негізгі түсінктері:
а) Комплекс түзуші мен лигандалардың арасындағы байланыс
иондық немесе ионды -дипольдік болып табылады.б) Байланыс түзілгенде лигандалардың электростатикалық
өрісінің әсері ескеріледі.в) Бір ядролы комплекс тузуші үшін d-орбитальдар мынадай
болады: dz, dx
- y
, dxy, dyz.
г) Бос атомда, немесе ионда барлык, 4-орбитальдар бірдей
болады. (энергия бірдей) . Ал осы атом лигандалардың арасына
түссе, d-орбитальдардың энергиялары әр түрлі болады.
д) Октаэдрлік қоршауда:
dz
 Equation. 3 dx
Equation. 3 dx
 Equation. 3 - y
Equation. 3 - y
 Equation. 3 ) d
Equation. 3 ) d
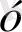 Equation. 3
Equation. 3
d
dxy, dxz, dyz) d
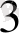 Equation. 3
Equation. 3
Тетраэдрлік қоршауда
dxy, dxz, dyz
d
dx
 Equation. 3, dx
Equation. 3, dx
 Equation. 3 -y
Equation. 3 -y
 Equation. 3
Equation. 3
d
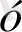 Equation. 3 және d
Equation. 3 және d
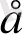 Equation. 3 орбитальдарының арасындағы энергияның айырымы
Equation. 3 орбитальдарының арасындағы энергияның айырымы
∆ - ажырау энергиясы .
е) Егер лигандалар күшті өріс туғызса, ∆ көп болады.
Өрісінің күшіне карай лигандалар мынадай қатарға орналасады:
СN > NО
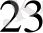 > ЭД > NH
> ЭД > NH
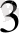 >NСS >NCS > H
>NСS >NCS > H
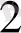 O> F> СО > ОН > С1 > Вг > Г
O> F> СО > ОН > С1 > Вг > Г
Бұл катар - спектроскопиялық катар.
2. 8. Төменгі және жоғарғы спинді комплекстер.
Кристалдық өріс теориясы комплекстердің магниттік кәсиетін және әр түрлі түсін түсіндіреді.
Әлсіз өрісте: Co
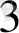
 (3d
(3d
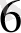 )
)
[CoF
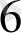 ]
]
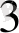 ∆-ажырау энергиясы аз, сондықтан электрондар
∆-ажырау энергиясы аз, сондықтан электрондар
↑ ↑ бір - бірден орналасады. Дара электронды комплекс- жоғарғы спинді- парамагнитті.
≡
↑↓ ↑ ↑
[Со(NH
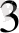 )
)
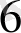 ]
]
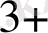 күшті өріс. Күшті өрісте ∆-көп сондықтан
күшті өріс. Күшті өрісте ∆-көп сондықтан
− − электрондар төменгі орбитальдарға орналасады комплекс-
≡ төменгі спинді- диамагнитгі, дара электрон жоқ.
↑↓ ↑↓ ↑↓
Комплекстің тусі.
Егер комплексте d-электронды төменгі орбитальдан жоғары
орбитальға ауыстыратын энергия жарық квантының энергиясына (Е=Һу) сәйкес болса, комплекс тусті болады.
2. 9 Молекулалық орбитальдар теориясы.
Бұл теория комплекс тузуші мен лигандалардың электрондық
құрылысын толық есепке алып, комплекс осы бөлшектердің
ядролары мен электрондарынан тұратын тұтас система деп
карайды. Комплекс косылыстардағы молекулалықорбитальдардың тузілуі және қәсиеттері атомдық косылыстардағы молекулалық орбитальдардың тузілуіне және касиеттеріне ұксас.
Комплекс косылыстарында энергетикалық диаграмма күрделі болып келеді. Бүұарда байланыстырушы және босаң орбитальдардан басқа байланыстырмайтын орбитальдар болады.
Мысалы : [Nı(NH
)
]
Ni
3d
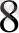
↑↓
Комплекс түзу үшін никельдің 3 электроны, аммиактың 12 электроны катысады (6 МН 3 -өрқайсысы 2 электроннан) . Осыдан басқа 4S, 4Р- орбитальдар катысады. Никельден 9 орбиталь, аммиактан 6 орбиталь барлығы 15 орбиталь, 20 электрон
Формуласы: (0
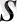
) 2 (0
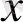
) 2 (0
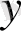
) 2 (0
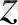
) 2 (0
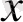
) 2
(0
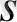

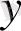
) 2 (0
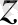
) 2
(П
)
(П
)
(П
)
X(0
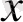

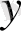
)
(0
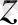
)
III. Қортынды
Комплексті қосылыстардың биологиялық маңызы және медициңада қолданылуы.
Комплеқсті косылыстар медицинада, әсіресе, фармакопиялық реакцияларда кеңінен қолданылады. Одан баска олардың биологиялық маңызы өте зор. Бірнеше мысалдар келтірейік.
Темір иондарының комплекс қосылыстары. Темір иондары әрі катионды, әрі анионды комплекс тузе алады.
ҒеО + 2Н
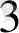 О
О
 + ЗН
+ ЗН
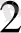 О = [Ғе(Н
О = [Ғе(Н
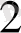 О)
О)
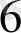 ]
]
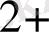 - катаонды комплекс
- катаонды комплекс
6КСN + ҒеSО
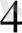 = К
= К
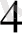 [Ғе (СN)
[Ғе (СN)
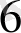 ] + К
] + К
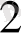 SО
SО
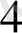 - аниону комплекс
- аниону комплекс
К
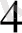 [Ғе (СN)
[Ғе (СN)
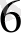 ] - сары қан тұзы, Ғе
] - сары қан тұзы, Ғе
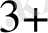 - ионын анықгау үшін анали-тикалық химияда қолданылады, мынадай реакция нәтижесінде
- ионын анықгау үшін анали-тикалық химияда қолданылады, мынадай реакция нәтижесінде
К
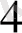 [Ғе(СN)
[Ғе(СN)
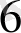 ] + Ғе
] + Ғе
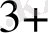 = КҒе
= КҒе
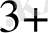 [Ғе
[Ғе
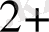 (СN)
(СN)
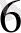 ]
]
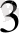 -көк түсті қосылыс
-көк түсті қосылыс
( берлин көгі) түзіледі.
К
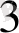 [Ғе(СN)
[Ғе(СN)
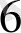 ] - қызыл қан тұзы, Ғе
] - қызыл қан тұзы, Ғе
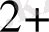 - ионын анықтау үшін қолданылады.
- ионын анықтау үшін қолданылады.
Ғе(СN)
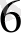 ]
]
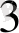 + Ғе
+ Ғе
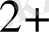 = Ғе
= Ғе
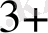 + Ғе(СN)
+ Ғе(СN)
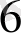 ]
]
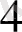 (тотығу-толықсыздану) содан кейін
(тотығу-толықсыздану) содан кейін
Ғе
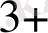 + [Ғе (СN)
+ [Ғе (СN)
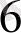 ]
]
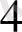 = К[Ғе
= К[Ғе
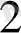 (СN)
(СN)
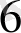 ] немесе КҒе[Ғе(СN)
] немесе КҒе[Ғе(СN)
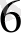 ] туруибуялкөгі
] туруибуялкөгі
Гемоглобин хлорофилл- циклды комплекс қосылыстар. Оларды хелаттар деп те атайды.
Гемоглобиннің реакциялары
ННЬ + О
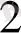 = ННЬО
= ННЬО
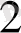 - ауаны жүтқанда
- ауаны жүтқанда
ННЬ + С = ННЬ СО
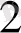 (тканьде)
(тканьде)
ННЬ СО
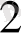 = ННЪО
= ННЪО
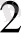 + СО
+ СО
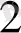 ↑ ауаны сыртқа шығару
↑ ауаны сыртқа шығару
гемоглобин бұл жерде катализатор ролін аткарып тұр.
Хлорофилл.
... жалғасы- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz